线粒体自噬在干细胞中的作用及其机制研究进展
2022-01-18谢丹李婧媛裴琴万雪叶婷
谢丹,李婧媛,裴琴,万雪,叶婷
西南医科大学附属医院医学检验部,四川泸州 646000
线粒体自噬是一种选择性清除功能异常或多余线粒体的自噬分子机制。在细胞分化、线粒体活性氧(ROS)积累及低氧环境等刺激因素的作用下,细胞内的线粒体可出现损伤或功能异常,导致线粒体发生去极化,被特异性地包裹进双层膜结构的自噬体中,通过与溶酶体融合将隔离起来的线粒体降解,从而维持细胞内线粒体的质量及功能稳定,这对细胞的健康及稳态至关重要[1-2]。线粒体自噬在细胞衰老、代谢性疾病、神经变性疾病及恶性肿瘤中均表现出异常的功能状态[3]。干细胞具有自我更新、多能性及分化能力,在生物体的整个成年过程中持续存在并可分化为体内各种细胞,在个体发育、组织更新及疾病过程中均发挥重要作用[4-5]。线粒体自噬与干细胞的生物学特征密切相关。本文对线粒体自噬在多种正常干细胞[多能干细胞、造血干细胞(hematopoietic stem cells,HSCs)、间充质干细胞(mesenchymal stem cells,MSCs)、神经干细胞(neural stem cells,NSCs)、心脏干细胞]及肿瘤干细胞(cancer stem cells,CSCs)中的重要作用进行综述,以期为进一步阐明干细胞的调控机制提供新的见解。
1 线粒体自噬的分子机制
线粒体自噬最初是由Kim等[6]通过电镜观察在哺乳动物细胞中发现,线粒体被带有自噬标记物微管相关蛋白轻链3(LC3)的囊泡包裹,形成自噬体后被降解。在不同的内外界因素刺激下,线粒体自噬存在不同的分子机制,主要包括PTEN诱导激酶1(PINK1)/帕金森幼年病蛋白2(Parkin)通路介导的泛素相关的线粒体自噬,以及低氧诱导的线粒体自噬受体蛋白BCL2/B腺病毒E1B相互作用蛋白3(BNIP3)、NIP3样蛋白X(NIP3-like protein X,NIX,又称BNIP3L)及含FUN14域蛋白1(FUNDC1)介导的线粒体自噬[7](图1)。
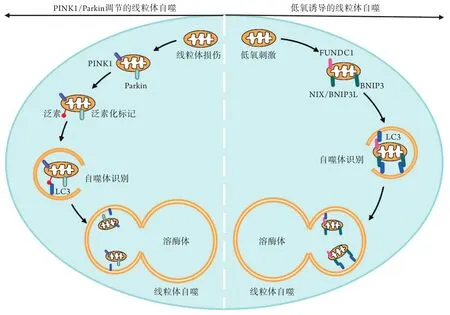
图1 线粒体自噬的分子机制Fig.1 The molecular mechanism of mitophagy
1.1 PINK1/Parkin通路介导的线粒体自噬 PINK1/Parkin通路介导的线粒体自噬是受损线粒体清除的主要机制,为通过泛素化标记线粒体外膜蛋白,使受损线粒体被自噬体识别并吞噬的过程[7]。研究显示,PINK1是一种丝氨酸/苏氨酸激酶,通过激活E3泛素连接酶Parkin发挥作用[8]。在正常的线粒体中,PINK1通过易位至线粒体内膜而被降解,因此无法启动线粒体自噬;当线粒体受损、膜电位下降时,PINK1特异性聚集在去极化的线粒体外膜上,随后发生磷酸化,激活Parkin的E3连接酶,并招募泛素(Ub)至线粒体外膜上,以泛素化的形式标记受损线粒体,并被自噬衔接蛋白(如SQSTM1/p62、OPTN及NDP52)所识别[7-9]。自噬衔接蛋白靶向受损的线粒体后,通过与LC3/GABARAP家族成员结合将线粒体包裹入自噬体,随后自噬体与溶酶体融合降解受损线粒体,最终完成线粒体的自噬过程[9]。
1.2 低氧诱导的线粒体自噬 低氧诱导的线粒体自噬包括BNIP3、NIX/BNIP3L 及FUNDC1介导的线粒体自噬。BNIP3与NIX/BNIP3L有56%的同源序列,是含有非典型BH3结构域的B淋巴细胞瘤-2(Bcl-2)家族促凋亡蛋白,可作为LC3的受体蛋白[10]。BNIP3与NIX/BNIP3L在C端均具有跨膜结构域,可靶向线粒体外膜,而N端包含LC3相互作用区(LIR),可与LC3/GABARAP结合,将线粒体连接到自噬体上,从而启动线粒体自噬[7,10]。有研究表明,BNIP3及NIX/BNIP3L是低氧诱导因子-1α(HIF-1α)的下游靶点[11],在低氧环境下,HIF-1α被激活并在转录水平上调BNIP3及NIX/BNIP3L的表达,增多的BNIP3及NIX/BNIP3L蛋白可诱导线粒体自噬的发生[11]。FUNDC1是一种新型的线粒体外膜蛋白,其N端的保守LIR序列可与LC3相结合,从而介导缺氧诱导的线粒体自噬[12]。研究发现,FUNDC1的多位点磷酸化及去磷酸化是其作为线粒体自噬受体被特异识别的关键[13]。在低氧时,FUNDC1的Tyr18、Ser13及Ser17位点从磷酸化变为去磷酸化状态,可促进FUNDC1与LC3的相互作用,从而诱导线粒体自噬的发生[13-14]。
2 线粒体自噬在干细胞中的作用
线粒体自噬在多能干细胞、各种组织干细胞及CSCs中均发挥重要作用,除了能维持干细胞多能性及自我更新的特性外,还涉及多种干细胞的分化调控及干细胞样特征的获得;此外,在神经性疾病的干细胞中,线粒体自噬也表现出功能异常(图2)。
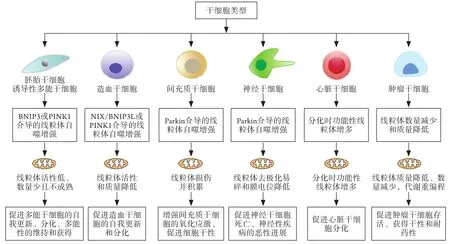
图2 线粒体自噬在干细胞中的调控机制Fig.2 The regulatory mechanism of mitophagy in stem cells
2.1 线粒体自噬与多能干细胞 多能干细胞包括胚胎干细胞(embryonic stem cells,ESCs)及诱导性多能干细胞(induced pluripotent stem cells,iPSCs)。ESCs是存在于早期胚胎中的多能干细胞,具有自我更新、多能性及分化潜力[15-16]。研究发现,线粒体自噬通过清除多余及异常的线粒体以保证ESCs中的线粒体数量及功能稳定,有利于ESCs的自我更新[15]。在自噬相关蛋白3(Atg3)缺失的小鼠胚胎干细胞(mESCs)中,线粒体清除受到抑制,导致mESCs中线粒体积累,并伴随ROS产生增多及ATP生成减少,从而抑制mESC的自我更新[17]。此外,在ESCs分化过程中,Atg3介导的线粒体自噬参与了线粒体质量重塑,以及ESCs多能性及分化的调节。Liu等[17]利用Atg3缺失的ESCs进行胚胎体分化测定发现,在胚胎体分化过程中,Atg3缺失降低了线粒体质量及多能性基因的表达,导致ESCs的多能性受损及胚胎体分化异常。还有研究表明,来自大脑和肌肉ARNT样1(BMAL1)缺陷的人ESCs通过抑制BNIP3介导的线粒体自噬导致线粒体功能障碍,从而造成ESCs分化的心肌细胞功能受损,即线粒体自噬的缺失可以导致ESCs分化障碍[18]。此外,在ESCs发育过程中,NIX介导的线粒体自噬是ESCs正常分化为成熟红细胞所必需的[19]。在mESCs中敲除NIX后,由mESCs发育而来的小鼠表现为网织红细胞线粒体清除率较低及成熟红细胞减少,造成NIX缺失小鼠贫血。
分化成熟的体细胞可重编程为iPSCs,在获得多能性的过程中,必须进行特定的线粒体重塑,以满足多能态的能量及代谢合成要求[20]。而线粒体自噬可通过降解iPSCs生成过程中的多余线粒体,调节线粒体的能量代谢转变,最终促进成熟体细胞重编程为iPSCs。研究表明,PINK1-/-iPSCs的糖酵解作用及胚胎干细胞样代谢能力明显低于PINK1+/+iPSCs,表明PINK1介导的线粒体自噬在iPSCs的能量代谢中发挥重要作用[21]。PINK1介导的线粒体自噬缺失可损害iPSC衍生过程中从成熟体细胞向多能干细胞能量代谢转化的能力,从而明显降低了成熟体细胞重编程为iPSCs的速度及效率[21]。此外,在SKP/SKO(Sox2、Klf4、Pou5f1/Oct4)诱导的成熟体细胞重编程过程中,BNIP3L介导的线粒体自噬上调导致线粒体质量降低,从而促进了iPSCs多能性的获得[22]。以上研究结果表明,在成熟体细胞重编程为iPSCs的过程中,线粒体自噬对线粒体能量代谢及质量的控制是调节成熟体细胞重编程的效率及iPSCs多能性获得的关键机制之一。
线粒体自噬在多能干细胞中发挥着不可或缺的作用[18],可通过重塑线粒体网络(包括减少线粒体数量、调节线粒体质量及功能、改变线粒体能量代谢)使线粒体处于低活性及相对不成熟的状态,从而有利于多能干细胞的自我更新、分化潜能以及多能性的维持及获得。但PINK1/Parkin及FUNDC1介导的线粒体自噬在ESCs中的作用机制尚未见相关研究,因此,要明确地将线粒体自噬定义为多能干细胞生物学特征的调节机制,尚需要更多的证据,以证实线粒体自噬是维持及获得多能干细胞生物学特性所必需的。
2.2 线粒体自噬与HSCs 线粒体自噬与HSCs的自我更新及分化密切相关。生理状态下,大多数HSCs的能量代谢以糖酵解为主,这对于维持HSCs的自我更新至关重要[23]。Ho等[24]发现,HSCs中自噬的丧失会导致线粒体积累及氧化代谢激活,从而损害HSCs的自我更新及再生潜力。而线粒体自噬通过减少线粒体质量限制了氧化代谢,使HSCs处于低水平的氧化代谢及高糖酵解状态,从而维持HSCs的自我更新[23-24]。HSCs的自我更新依赖于线粒体清除,在TEK受体酪氨酸激酶(Tie2+)HSCs中,PINK1表达上调增加了线粒体自噬,使受损的线粒体更容易被清除,从而促进了Tie2+HSCs的自我更新[25]。此外,在具有长期自我更新能力的HSCs中,线粒体的活性及质量均较低,用解偶联剂诱导线粒体自噬后,可促进HSCs的自我更新[26]。其他研究还发现,O-连接的N-乙酰氨基葡萄糖转移酶(OGT)可通过PINK1依赖性线粒体自噬确保线粒体质量稳定,从而严格调节HSCs的自我更新及应激反应[27]。转化生长因子-β1(TGF-β1)可通过增强NIX/BNIP3L介导的线粒体自噬加速并增强HSCs在体外分化为红细胞[28]。上述研究提示,在HSCs中,PINK1介导的线粒体自噬可通过清除多余的线粒体而降低线粒体的质量及活性,并将细胞代谢重编程为糖酵解,从而促进HSCs的自我更新,而NIX/BNIP3L介导的线粒体自噬增强可能有助于HSCs的分化。目前,关于FUNDC1介导的线粒体自噬在HSCs中的潜在作用尚未明确,这也是未来研究的方向之一。
2.3 线粒体自噬与MSCs MSCs是最初从人类骨髓中分离出来的一类多样化的多能前体细胞,能够分化为间充质细胞谱系,包括脂肪、骨骼、软骨及肌肉[29]。有研究发现,线粒体自噬可促进骨髓来源间充质干细胞(bone marrow-derived mesenchymal stem cells,BMSCs)的干性特征,大鼠BMSCs中的线粒体裂变可诱导线粒体自噬增强,从而上调干细胞标志物Oct4及Sox2的表达,促进BMSCs的干性[30]。此外,诱导线粒体自噬增强可能在保护BMSCs免受氧化应激引起的凋亡中起关键作用。据报道,BMSCs在受到H2O2刺激的后期,其线粒体自噬能力降低,而细胞凋亡增加,这表明H2O2处理通过抑制线粒体自噬促进了细胞凋亡[31]。目前BMSCs移植已被用于治疗多种疾病,而线粒体自噬则有利于移植治疗过程中BMSCs的存活。例如,在BMSCs移植治疗股骨头坏死后,受到氧化应激的刺激,BMSCs中P53表达上调并与Parkin相互作用,抑制Parkin的线粒体易位及E3泛素连接酶的激活,导致线粒体自噬减少,线粒体清除受阻,从而增加了氧化应激诱导的BMSCs凋亡及衰老[32]。以上研究表明,线粒体自噬在促进MSCs干性及MSCs免受氧化应激损伤中均发挥了重要作用,有利于提高MSCs移植治疗的效率。但目前的研究较少,不足以确定线粒体自噬对MSCs移植治疗有明显益处,因此尚需进一步深入研究,以为临床辅助MSCs移植治疗提供新策略。
2.4 线粒体自噬与NSCs 有研究证实,PINK及PARK2(编码Parkin)基因在早发性遗传性帕金森病中发生了突变[33],因此,PINK1/Parkin介导的线粒体自噬在NSCs的正常发育中尤为重要。最近的研究发现,携带LRRK2-G2019S突变的帕金森病患者特定的人类神经上皮干细胞(neuroepithelial stem cells,NESCs)中表现出异常的线粒体形态及功能,如线粒体易碎、更易释放ROS、膜电位降低及线粒体清除率降低,最终可导致帕金森患者后期恶性进展[34]。另一方面,线粒体自噬增强可促进海马NSCs的自噬依赖性细胞死亡。在成年大鼠海马神经干细胞中,通过无胰岛素培养增加去极化线粒体的数量后,可上调Parkin的表达水平,导致线粒体过度自噬,最终在海马神经干细胞中诱导了自噬依赖性细胞死亡[35]。此外,胰岛素信号受损导致的过度线粒体自噬可能与海马区缺陷引起的各种神经退行性疾病有关[35]。上述研究结果提示,神经系统疾病中的NSCs表现出线粒体自噬功能异常,可使疾病向恶性发展,而线粒体自噬对调节NSCs的自我更新及向其他神经元的分化有潜在促进作用,但目前少有相关研究,值得进一步深入探讨。
2.5 线粒体自噬与心脏干细胞 线粒体自噬可通过调节线粒体的数量及形态变化,促进心脏干细胞的分化。在心脏祖细胞分化过程中,BNIP3L及FUNDC1明显上调,并迅速诱导线粒体自噬,促进分化过程中的功能性线粒体增多[36]。破坏BNIP3L及FUNDC1介导的线粒体自噬可引起线粒体裂变,形成“甜甜圈样”线粒体,其功能明显降低,导致心脏祖细胞对死亡信号的敏感性增加[36]。已有研究显示,线粒体的氧化代谢是心脏干细胞分化所必需的[37]。由此可见,在心脏干细胞分化过程中,线粒体自噬可调控线粒体的数量、形态及能量代谢,有助于分化的细胞形成数量多、形态稳定及功能成熟的线粒体,以适应终末分化细胞的需求。但目前仍不清楚心脏干细胞分化时线粒体自噬是如何调节线粒体代谢变化的。
2.6 线粒体自噬与CSCs CSCs又叫肿瘤起始细胞,是具有自我更新及分化潜能的一小部分肿瘤细胞,并在肿瘤进展过程中表现出高度侵袭性及耐药性[38-39]。最新研究发现,缺氧触发的线粒体自噬可能是CSCs在低氧环境中存活的机制。Jung等[40]对胶质母细胞瘤干细胞(GSCs)的研究发现,胶质母细胞瘤缺氧区域中线粒体NIX表达增强,并优先在GSCs中表达。NIX介导的线粒体自噬被HIF/低氧应激反应及NFE2L2/氧化应激激活,增强了GSCs在低氧环境下的存活能力,而沉默NIX可破坏线粒体自噬,导致GSCs在体内外的存活受到抑制,从而抑制肿瘤的发生[40]。此研究还提出一种新见解,即靶向NIX可优先消除GSCs,NIX可能提供一种靶向治疗缺氧性胶质母细胞瘤的新策略[40]。已有研究表明,缺氧反应性的miR-137可通过靶向FUNDC1及NIX而明显抑制缺氧诱导的线粒体自噬[41]。在低氧条件下,乳腺癌干细胞(BCSCs)中miR-137表达下调,可明显降低miR-137对FUNDC1的靶向作用,导致线粒体自噬增强,从而降解异常线粒体,避免了ROS的积累,最终抑制了细胞凋亡,并促进了BCSCs的存活[41-42]。值得注意的是,实体瘤通常在低氧环境中生长,这有助于线粒体自噬增强及CSCs的存活。因此,有必要进一步研究线粒体自噬对不同CSCs在低氧条件下生存的影响,为根治肿瘤提供新的策略。
CSCs具有高度的可塑性,在癌症进展中,普通的肿瘤细胞可以去分化获得干性特征,从而转变为CSCs[43]。线粒体自噬可促进肿瘤细胞干性的获得。在肝癌中,乙肝病毒x蛋白(HBx)表达增加了BNIP3L依赖性线粒体自噬,导致糖酵解代谢重编程,从而促进肝癌细胞的干性,因此,BNIP3L可作为肝癌CSCs相关的潜在治疗靶标[44]。同样在肝癌中,线粒体自噬增强还可通过激活Nanog同源盒(NANOG)的表达促进肝癌CSCs的生成。NANOG是维持CSCs干性及自我更新能力至关重要的转录因子,当PINK1介导的线粒体自噬被抑制时,在线粒体膜上的PINK1使p53丝氨酸392磷酸化,p53易位至细胞核,从而抑制NANOG启动子的激活,导致肝癌CSCs种群减少[45]。还有研究发现,Parkin介导的线粒体自噬可通过促进上皮间质转化(EMT)而促进CSCs样特征的获得[46]。在EMT介导的CD44+食管鳞状细胞癌细胞中,可检测到线粒体片段化、Parkin向线粒体易位及线粒体含量降低,反过来,Parkin依赖性线粒体自噬的抑制可导致干细胞标记CD44表达的丧失[46]。
线粒体自噬在CSCs耐药中也发挥着重要作用。耐顺铂的口腔癌FaDu细胞具有干细胞样特征,并表现出线粒体自噬增强,CD44及相关耐药蛋白ABCB1、ADAM17的表达水平升高,而抑制线粒体自噬,降低CD44、ABCB1及ADAM17的表达,则可导致细胞耐药性丧失[47]。另一项研究也报道了类似的结果,BNIP3L介导的线粒体自噬可赋予CSCs耐药性,在CD133+/CD44+的HCT8结直肠癌干细胞中,BNIP3L沉默明显降低了线粒体自噬,并增强了CSC对阿霉素的敏感性[48]。
以上研究结果表明,线粒体自噬在CSCs的存活、干性获得及维持、代谢转变及耐药性中均发挥着积极作用,提示线粒体自噬相关蛋白可作为干扰CSCs的潜在治疗靶标。
3 总结及展望
线粒体自噬能调节干细胞的线粒体质量、功能、形态及代谢重编程,从而在维持干细胞自我更新、分化、多能性及干性获得中发挥重要作用。目前,线粒体自噬在干细胞中的作用研究已取得突破性进展,但仍有很多机制尚未完全阐明,如:干细胞是否必须激活线粒体自噬机制以确保自我更新及分化功能;线粒体自噬是否通过赋予某些组织干细胞自我更新能力,从而有利于干细胞的治疗策略;线粒体自噬是否能成为CSCs治疗的潜在目标等。未来的研究应致力于线粒体自噬在干细胞治疗策略中的作用,及其作为CSCs治疗的潜在靶标,以期为开发针对血液疾病、骨骼疾病、神经疾病及某些癌症的新治疗措施提供依据。
