550例男性不育症患者染色体核型和Y染色体微缺失情况分析
2022-01-18靳化赵勇钟建容沈梦尘陈蕾
靳化,赵勇,钟建容,3,沈梦尘,陈蕾*
1安徽医科大学海军临床学院,合肥 230032;2解放军总医院第六医学中心妇产科,北京 100048;3华南理工大学医学院,广州 510006
根据WHO规定,夫妇未采取任何避孕措施同居生活1年以上,由于男方因素造成女方不孕者,称为男性不育症。研究表明,不孕不育的发病率约为15%,男女因素各占一半[1]。生殖系统感染、性功能障碍、免疫因素、染色体异常等均可导致男性不育症的发生[2-5]。在遗传学病因中,克氏综合征(47,XXY)及Y染色体微缺失为主要原因,均可导致无精子症、极严重少精子症及严重少精子症[6-7]。对就诊的不育患者进行遗传学筛查,有助于明确其是否患有导致不育的遗传学疾病,对后续诊疗策略的制定以及辅助生殖方法的选择至关重要[8]。本研究回顾性分析796例男性的染色体核型、Y染色体微缺失结果及其中部分男性的性激素检测结果,以探讨临床诊疗中男性不育人群的遗传学病因及性激素水平变化特征。
1 资料与方法
1.1 研究对象 回顾性分析2018年9月-2020年12月于解放军总医院第六医学中心生殖中心就诊的550例男性不育症患者的临床检验资料,其中无精子症187例,少精子症363例(极严重90例、严重101例、轻中度172例)。同时纳入健康男性246名(即同期于我院行辅助生殖助孕,经检查无不育因素的男性)作为对照。所有男性禁欲2~7 d,通过自慰获取精液标本,根据WHO《人类精液检查与处理实验室手册》(第五版)[9]进行精液分析,并根据精子浓度进行分级[10]。(1)无精子症:连续3次精液及射精后的尿液经离心后镜检未见精子;(2)极严重少精子症:精子浓度<1×109/L;(3)严重少精子症:精子浓度为(1~5)×109/L;(4)轻中度少精子症:精子浓度为(5~15)×109/L;(5)正常:精子浓度>15×109/L。所有研究对象均进行染色体核型及Y染色体微缺失检测。同时对纳入此研究中的部分人群(无精子症156例,极严重少精子症70例,严重少精子症75例,正常对照75例)进行性激素(促黄体生成素、卵泡刺激素、催乳素、睾酮)水平检测。本研究获解放军总医院第六医学中心伦理委员会批准(HZKY-PJ-2021-46)。
1.2 检测指标分析 染色体核型分析:采用GRQ带技术检测,根据《人类细胞遗传学国际命名体制》描述染色体核型;分析染色体异常与精子浓度之间的关系。Y染色体微缺失情况检测:使用人Y染色体无精子症因子(azoospermia factor,AZF)区微缺失核酸检测试剂盒(PCR-荧光探针法,北京爱普益生物科技有限公司;Bio-Rad CFX96荧光定量PCR仪)检测Y染色体AZFa、AZFb、AZFc 3个区域的缺失状态,每个区域分别以两个序列标签位点(sequence tag site,STS)为代表。AZFa区:sY84和sY86;AZFb区:sY127和sY134;AZFc区:sY254和sY255。以SRY和β-actin位点为内参照,FAM、VIC、CY5为荧光基团;分析Y染色体微缺失在不同精子浓度人群中的发生情况。性激素4项检测:使用化学发光法(UniCel DxI 800仪器及试剂盒均由美国贝克曼公司提供)进行检测;分别比较不同精子浓度人群、有无Y染色体微缺失人群的性激素水平差异。
1.3 统计学处理 采用SPSS 23.0软件进行统计分析。定性资料以例(%)表示,组间比较采用χ2检验。定量资料不服从正态分布,均以M(Q1,Q3)表示,组间比较采用秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 染色体核型情况 550例不育症患者及246例健康对照中共有62例染色体核型异常或正常多态性变化(62/796,7.8%)。其中无精子症18例(18/187,9.6%),极严重少精子症11例(11/90,12.2%),严重少精子症5例(5/101,5.0%),轻中度少精子症9例(9/172,5.2%),健康对照19例(19/246,7.7%)。不育症患者染色体异常发生率为4.0%(22/550),健康对照为2.4%(6/246),差异无统计学意义。所有男性中常染色体异常15例(15/796,1.9%),其中罗伯逊易位5例,平衡易位6例,倒位3例,多一条标记染色体1例;常染色体正常多态性12例(12/796,1.5%);性染色体异常13例(13/796,1.6%),其中克氏综合征8例(7例无精子症及1例极严重少精子症),超雄综合征、46,XX男性综合征、嵌合体、Y染色体双着丝粒、Y染色体部分缺失各1例;性染色体正常多态性19例(19/796,2.4%);另外有3名男性为常染色体+性染色体正常多态性变化(3/796,0.4%)(表1)。
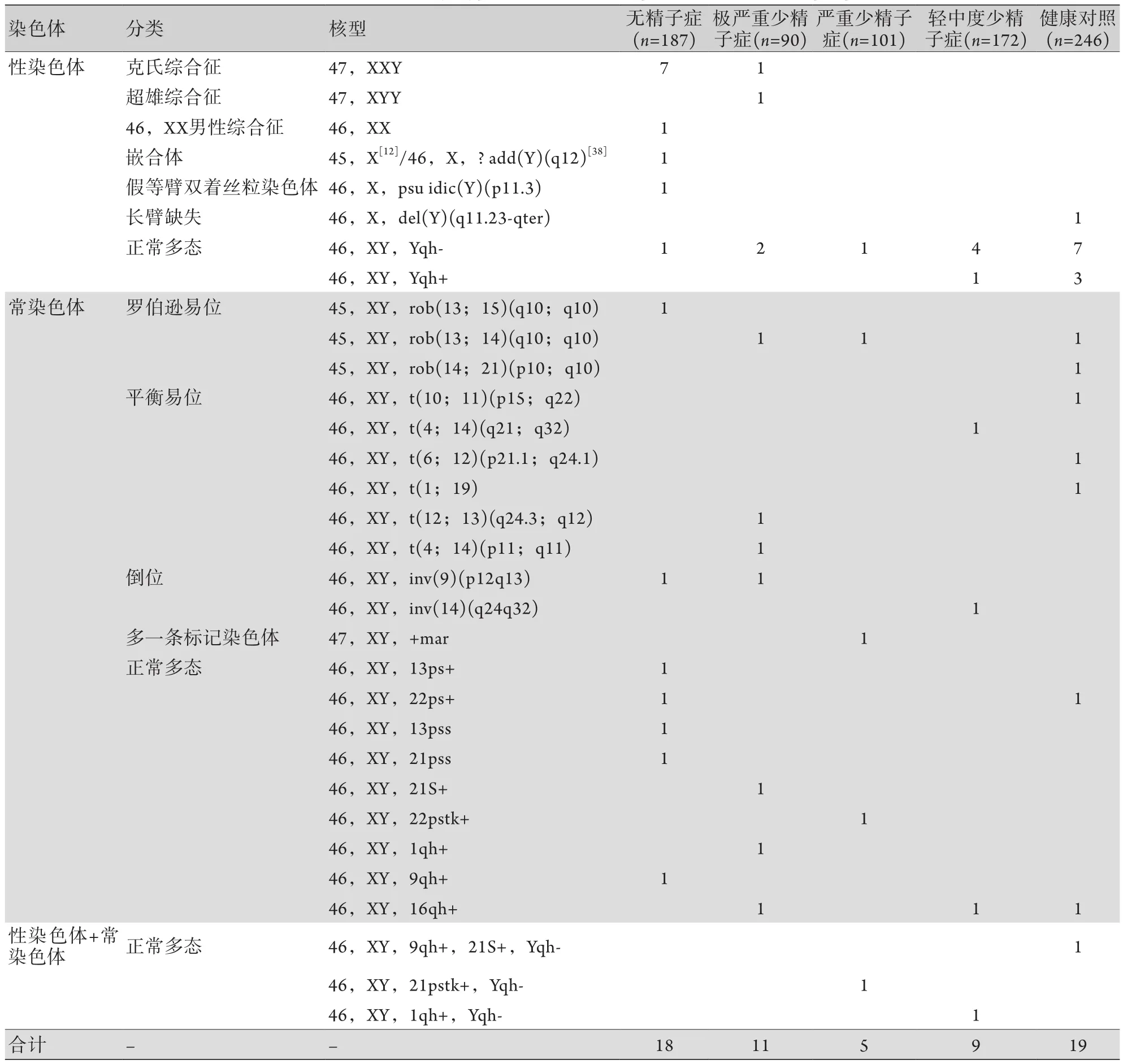
表1 男性不育症患者及健康对照染色体核型分布(例)Tab.1 Chromosome karyotype of male infertile patients and normal people (n)
2.2 Y染色体微缺失情况 550例不育症患者中,Y染色体微缺失者共38例(6.9%),其中无精子症17例,极严重少精子症18例,严重少精子症2例,轻中度少精子症1例;246例健康对照中未出现Y染色体微缺失;4例不育症患者为染色体正常多态性+Y染色体微缺失,分别为46,XY,9qh+(1例)、46,XY,22ps+(1例)、46,XY,Yqh-(2例),其中前2例为无精子症,后2例为极严重少精子症;46,XY,9qh+为AZFb区缺失,其余为AZFc区缺失;1例不育症患者为染色体异常+Y染色体微缺失,为46,XX、AZFabc区缺失(表2)。
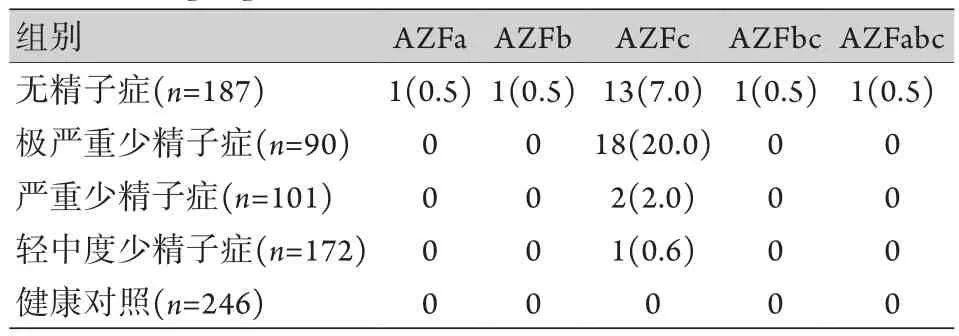
表2 男性不育症患者及健康对照Y染色体微缺失情况[例(%)]Tab.2 Y chromosome microdeletion in male infertile patients and normal people [n(%)]
2.3 性激素检测结果
2.3.1 无精子症、极严重少精子症、严重少精子症及健康对照的比较 四组的促黄体生成素(P=0.000)、卵泡刺激素(P=0.000)及睾酮(P=0.023)水平差异有统计学意义,但催乳素水平差异无统计学意义(表3)。

表3 男性不育症患者及健康对照的性激素水平比较[M(Q1,Q3)]Tab.3 Comparison of sex hormone levels between male infertile patients and normal people [M(Q1, Q3)]
2.3.2 无精子症、极严重少精子症、严重少精子症中有无Y染色体微缺失患者性激素水平比较 Y染色体微缺失组的卵泡刺激素水平明显高于无Y染色体微缺失组(P=0.032),但两组的促黄体生成素、催乳素、睾酮水平差异无统计学意义(表4)。

表4 男性不育症有无Y染色体微缺失患者的性激素水平比较[M(Q1,Q3)]Tab.4 Sex hormone levels in male infertile patients with or without Y chromosome microdeletion [M(Q1, Q3)]
3 讨 论
在众多导致男性不育的因素中,染色体异常较为常见。既往研究显示,无精子症患者中染色体异常比例为14.30%~22.97%,在极严重及严重少精子症患者中该比例为2.30%~3.87%[11-13]。本研究不育男性中染色体异常22例(22/550,4.0%)。其中无精子症患者12例(12/187,6.4%),极严重少精子症患者6例(6/90,6.7%),两者染色体异常的发生率差异无统计学意义(P=0.937)。与以往的研究相比,本研究人群染色体异常发生率偏低,可能为调查人群的选择、种族、区域等原因导致。
导致男性不育症的遗传学因素包括克氏综合征、Y染色体微缺失、先天性双侧输精管缺失、低促性腺激素性性腺功能减退等[6]。克氏综合征(47,XXY)在导致男性不育的遗传学病因中占据重要地位,其主要表现包括性欲低下、小睾丸症和不育症等[6]。既往针对中国不育患者克氏综合征的研究发现,其在无精子症中的发病率为6.56%~15.54%,重度少精子症中为0.52%,少精子症中为3.77%[11-12]。本研究中克氏综合征共有8例(无精子症7例,7/187,3.7%;极严重少精子症1例,1/90,1.1%),发生率低于以往的研究数据。绝大部分的克氏综合征患者表现为无精子症[14],与本研究结果相符。本研究中8例克氏综合征患者有7例(无精子症6例、极严重少精子症1例)选择辅助生殖技术获得后代,其中6例无精子症患者因睾丸穿刺未见精子而选择供精,极严重少精子症患者通过卵泡浆内单精子显微注射技术(ICSI)获得后代。有研究结果显示,部分因克氏综合征导致无精子症的患者可通过显微取精方式获得精子,继而行ICSI获得后代,但其胚胎染色体异常的发生率明显增高[15-16]。因我中心诊疗手段有限,故本研究中的无精子症患者仅行睾丸穿刺而未行显微取精,但其有可能通过显微取精方式获得精子从而避免选择供精获得后代。
本研究中有一例男性核型为46,X,del(Y)(q11.23-qter),两次精液检测显示精子密度分别为53.4×109/L、81×109/L,同时其Y染色体微缺失检测结果未见异常,考虑缺失的Y染色体长臂片段可能易位于其他染色体上。
本研究的550例不育症患者及246名健康男性中常染色体异常的发生率为1.9%,与性染色体异常的发生率(1.6%)比较差异无统计学意义(P=0.703)。在不育男性及正常对照人群中均出现罗伯逊易位及平衡易位,猜测此两种核型可能与男性精子的产生无关。常染色体异常中有一例罕见的核型为47,XY,+mar的患者,表现为严重少精子症,目前尚不清楚该异常(多一条标记染色体)是否会对生育力产生影响,对于此类核型尚需要收集更多临床数据进行进一步研究。
1976年,Tiepolo等[17]第一次证实Y染色体长臂缺失与男性不育有关。随后的研究发现,Y染色体上存在AZFa、AZFb、AZFc 3个与精子产生有关的区域,每个区域在精子产生的不同时期均起着重要作用,不同的区域缺失呈现出不同的临床表现和发生频率[6,18-22]。Y染色体微缺失是导致男性不育的另一重要遗传学因素[6]。既往在中国人群中的调查发现,无精子症和重度少精子症(精子浓度<5×109/L)患者的Y染色体微缺失发生率分别为11.75%和8.51%[12]。本研究中Y染色体微缺失在无精子症、极严重少精子症及严重少精子症患者中的发生率分别为9.1%、20.0%及2.0%,再次证实Y染色体微缺失与男性不育症密切相关。
在本研究550例不育男性中,AZFc区缺失最为常见(6.2%,34/550),但AZFa、AZFb、AZFbc、AZFabc区缺失发生率无明显差异,且这4种类型均表现为无精子症,推测可能的原因为本研究是单中心研究且受研究人群的限制,使不同类型缺失的发生率未表现出明显的差异。部分AZFc区缺失的患者可通过显微取精的方式获得精子,然后行ICSI以产生后代[23-24]。在本研究中已确诊为Y染色体微缺失的患者中,有9例无精子症患者因诊疗手段受限未行显微取精,而是直接通过供精获得后代(AZFa区 1例,AZFb区 1例,AZFc区 7例);有14例极严重少精子症患者(AZFc区)选择ICSI方式获得后代,但另有1例严重少精子症患者(AZFc区)选择供精。
有研究表明,AZFc区缺失的患者其精液质量随着年龄的增长逐渐变差[25],但本研究AZFc区缺失患者中表现为无精子症的年龄为23~36岁,表现为极严重少精子症或严重少精子症的年龄为24~45岁,未表现出明显的精液质量随年龄增长而下降的趋势,这可能是由于本研究中Y染色体微缺失患者较少,缺乏充足数据导致的。本研究发现有1例30岁的轻中度少精子症(3次精液常规显示精子浓度分别为10.2×109/L、12.4×109/L、14.4×109/L)患者表现为AZFc区缺失。根据既往对Y染色体微缺失患者精液质量与年龄之间的相关性研究结果,同时结合本研究中Y染色体微缺失患者所行的辅助生殖方法,临床上应重视对轻中度少精子症患者Y染色体微缺失的检测,以便尽早发现阳性患者,从而选择合适的治疗方法。
目前的研究表明,克氏综合征及Y染色体微缺失是导致男性出现严重少精子症、极严重少精子症甚至无精子症的常见遗传学病因[6]。本研究中的部分无精子症、少精子症患者染色体核型及Y染色体微缺失检测均未见异常,但这并不能说明此类患者无其他遗传学方面的病因。通过高通量测序及表观遗传学等方法,已有研究发现其他与男性不育相关的遗传学因素如CFTR、ADGRG2、TEX11、SPINK2、TEX15、PKD1基因等[26]。故针对此类患者需要进行进一步的基因检测以明确病因。
男性体内存在下丘脑-垂体-性腺轴调节性激素的水平及精子的生成。卵泡刺激素为男性体内一种重要的激素,可与曲细精管的支持细胞膜受体结合,促进性激素结合球蛋白及抑制素B的生成,影响精子的产生,同时抑制素B也对FSH水平起反馈作用[27]。既往针对Y染色体微缺失患者性激素水平的研究发现,Y染色体上AZF位点的缺失可对精子的产生造成影响,从而导致抑制素B水平降低,而抑制素B则通过负反馈作用导致卵泡刺激素水平升高;对于无Y染色体微缺失的不育症患者,也会出现因精子产生障碍而导致的抑制素B水平降低、卵泡刺激素水平升高现象;但与无Y染色体微缺失的患者相比,Y染色体微缺失患者的抑制素B水平更低[28-29]。本研究中Y染色体微缺失患者的卵泡刺激素水平明显高于无Y染色体微缺失的患者,与既往研究结果一致。但因本院未对男性不育患者常规开展抑制素B的检测,故本研究人群的抑制素B与卵泡刺激素水平之间的关系无法验证。
综上所述,在行辅助生殖助孕的男性不育患者中进行遗传学筛查,有助于发现潜在的不育原因,从而明确诊断,且对后续治疗方法的选择具有重要意义。
