术前炎症免疫及营养指标对胸腺瘤患者预后的预测价值
2022-01-18毛文杰尹泚李斌王成蒋鹏杨建宝李政余琦瑶李杰
毛文杰,尹泚,李斌*,王成,蒋鹏,杨建宝,李政,余琦瑶,李杰
1兰州大学第二医院胸外科,兰州 730030;2兰州大学第二临床医学院,兰州 730030
胸腺上皮性肿瘤起源于胸腺上皮细胞,占前纵隔肿瘤的35%[1],包括胸腺瘤和胸腺癌[2]。其中胸腺瘤的发病率约为1.5/100万人,而胸腺癌较少见[3]。由于胸腺瘤较罕见且呈相对惰性[4],很难开展大规模的前瞻性随机研究和回顾性研究,故对胸腺瘤预后的研究充满挑战性[5]。影响胸腺瘤预后的因素较多,大多数研究主要对Masaoka分期、组织学分类和手术切除是否完整等进行评估[6]。然而截至目前,尚无成熟实用的胸腺瘤预后评估系统。越来越多的证据表明,炎症和免疫系统与癌细胞的相互作用在肿瘤的发生、发展和转移中起着关键作用[7-8]。此外,血清白蛋白是反映机体营养状态的重要参数[9]。有研究发现,单独的血清白蛋白或基于血清白蛋白的标志物可以预测多种癌症患者的预后[10-11]。因此,基于炎症免疫和全身营养的预后指标在各种癌症患者中被广泛评估并显示出了一定的预后价值,包括中性粒细胞/淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)[12]、血小板/淋巴细胞比值(platelet to lymphocyte ratio,PLR)[13]、血小板/血清白蛋白比值(platelet to albumin ratio,PAR)[14]及预后营养指数(prognostic nutritional index,PNI)[11]等,但国内外对于胸腺瘤的相关研究较少[15-16]。本研究旨在探讨炎症免疫及营养指标对胸腺瘤患者预后的预测价值以及最佳预后指标与胸腺瘤患者临床病理特征的关系。
1 资料与方法
1.1 临床资料 回顾性分析2014年2月-2019年12月就诊于兰州大学第二医院胸外科并经病理确诊为胸腺瘤患者的临床资料。纳入标准:(1)术前未进行任何治疗,未行二次手术;(2)采血前2周未合并明确的感染性疾病;(3)不伴有其他恶性肿瘤史;(4)随访时已完成所有相关辅助放化疗。排除标准:(1)转移性疾病;(2)临床资料不完整和失访病例;(3)合并贫血或其他血液系统疾病;(4)其他病理类型的胸腺肿瘤;(5)患血管炎或其他相关疾病。本研究获得兰州大学第二医院医学伦理委员会批准(2021A-398)。
1.2 方法
1.2.1 信息采集 收集患者性别、年龄、病史资料、手术记录、病理报告及术前常规实验室检查结果等数据。胸腺瘤分期采用Masaoka分期标准[17],组织学分类采用2015年WHO组织学分型并将各种胸腺癌归为C型胸腺瘤[18]。
1.2.2 随访 治疗完成后通过电话及门诊随访,随访截至2021年3月1日,随访时间(36.39±19.43)个月。
1.3 观察指标 结局指标为总生存期(overall survival,OS)和无进展生存期(progression free survival,PFS)。OS定义为手术之日至死亡的时间,PFS定义为从手术之日至肿瘤发生任何方面的进展或死亡的时间。肿瘤复发评估参照国际胸腺肿瘤协作组织(the International Thymic Malignancy Interest Group,ITMIG)制定的胸腺恶性肿瘤标准预后指标[19],肿瘤进展评估根据ITMIG针对胸腺上皮肿瘤对实体肿瘤疗效评估标准(Response Evaluation Criteria in Solid Tumors,RECIST) 1.1版进行改良的标准[20]。
依据实验室检查结果计算NLR、PLR、PAR和PNI,其中PNI=淋巴细胞绝对值×5+血清白蛋白。采用受试者工作特征(receiver operating characteristic,ROC)曲线分析术前PAR、PNI、PLR及NLR与胸腺瘤患者OS的关系,计算最佳截断值,依据最佳截断值进行分组,比较不同组胸腺瘤患者的临床资料。
1.4 统计学处理 采用SPSS 25.0软件进行统计分析。连续变量以表示,组间比较采用t检验;分类变量以例(%)表示,组间比较采用Pearsonχ²检验。采用Kaplan-Meier生存分析法绘制胸腺瘤患者的OS和PFS生存曲线并计算累计生存率,组间差异比较采用Log-rank检验。利用单因素和多因素Cox比例风险模型分析影响胸腺瘤患者预后的因素。P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况 共纳入109例胸腺瘤患者,其中男57例(52.3%,57/109),女52例(47.7%,52/109);年龄19~84(51.3±9.9)岁。有胸闷气短、胸痛、咳嗽咳痰或声音嘶哑等症状者53例(48.6%,53/109),有重症肌无力症状者18例(16.5%,18/109),体检发现38例(34.9%,38/109)。所有患者均无围术期死亡。根据术后病理及手术记录,91例(83.5%,91/109)完整切除肿瘤,18例(16.5%,18/109)手术切除不完整[其中12例(66.7%,12/18)行减瘤术,6例(33.3%,6/18)行单纯活检术]。术后72例(66.1%,72/109)接受辅助治疗[其中单纯放疗24例(33.3%,24/72),单纯化疗10例(13.9%,10/72),联合放化疗38例(52.8%,38/72)],37例(33.9%,37/109)未接受任何辅助治疗。共18例(16.5%,18/109)死亡[其中4例(22.2%,4/18)死于肿瘤复发,3例(16.7%,3/18)死于肿瘤进展,5例(27.8%,5/18)死亡原因不明,5例(27.8%,5/18)死于其他系统性疾病,1例(5.6%,1/18)死于辅助治疗并发症];10例复发者中有6例(60.0%,6/10)目前正在接受治疗。
2.2 胸腺瘤患者临床病理特征分析 ROC曲线分析结果显示,PAR、PLR、NLR及PNI预测胸腺瘤患者OS的曲线下面积(area under curve,AUC)分别为0.708(P=0.005)、0.600(P=0.181)、0.484(P=0.832)和0.693(P=0.010,图1)。PAR和PNI的最佳截断值分别为5.05、51.48,依据最佳截断值将患者分为低PAR组(PAR<5.05)和高PAR组(PAR≥5.05),以及低PNI组(PNI<51.48)和高PNI组(PNI≥51.48),各组患者临床病理特征如表1所示。相较低PAR患者,高PAR患者肿瘤组织学类型倾向于B型和C型(72.7%vs.50.8%,P=0.030),且不容易完整切除(27.3%vs.9.2%,P=0.013);相较高PNI患者,低PNI患者肿瘤易侵犯血管(34.7%vs.13.3%,P=0.008)、组织学类型倾向于B型和C型(69.4%vs.51.7%,P=0.004),且具有较高的Masaoka分期(47.0%vs.28.3%,P=0.021)。
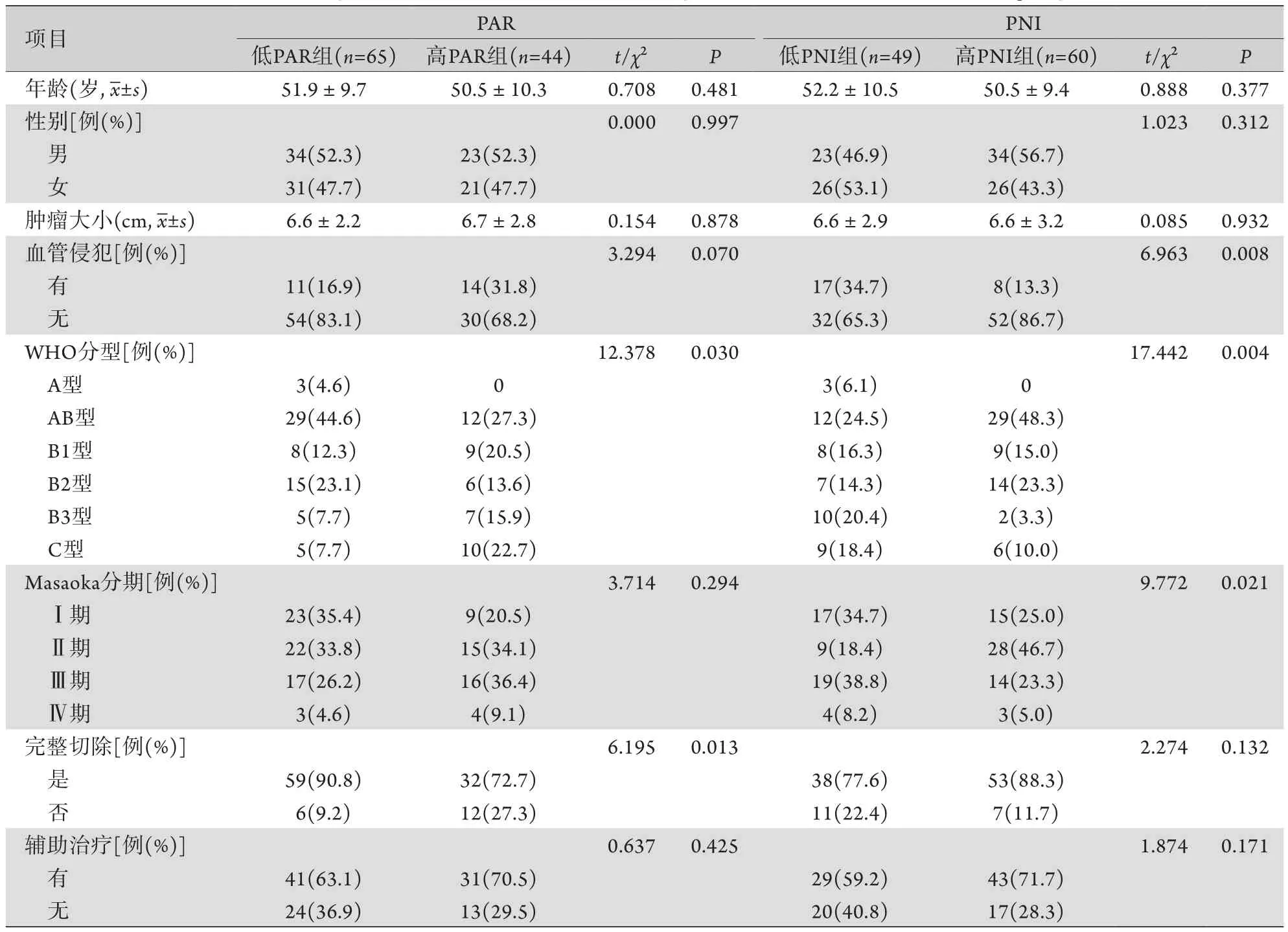
表1 不同PAR和PNI组胸腺瘤患者临床资料比较Tab.1 Comparison of clinical data of thymoma patients in different PAR and PNI groups
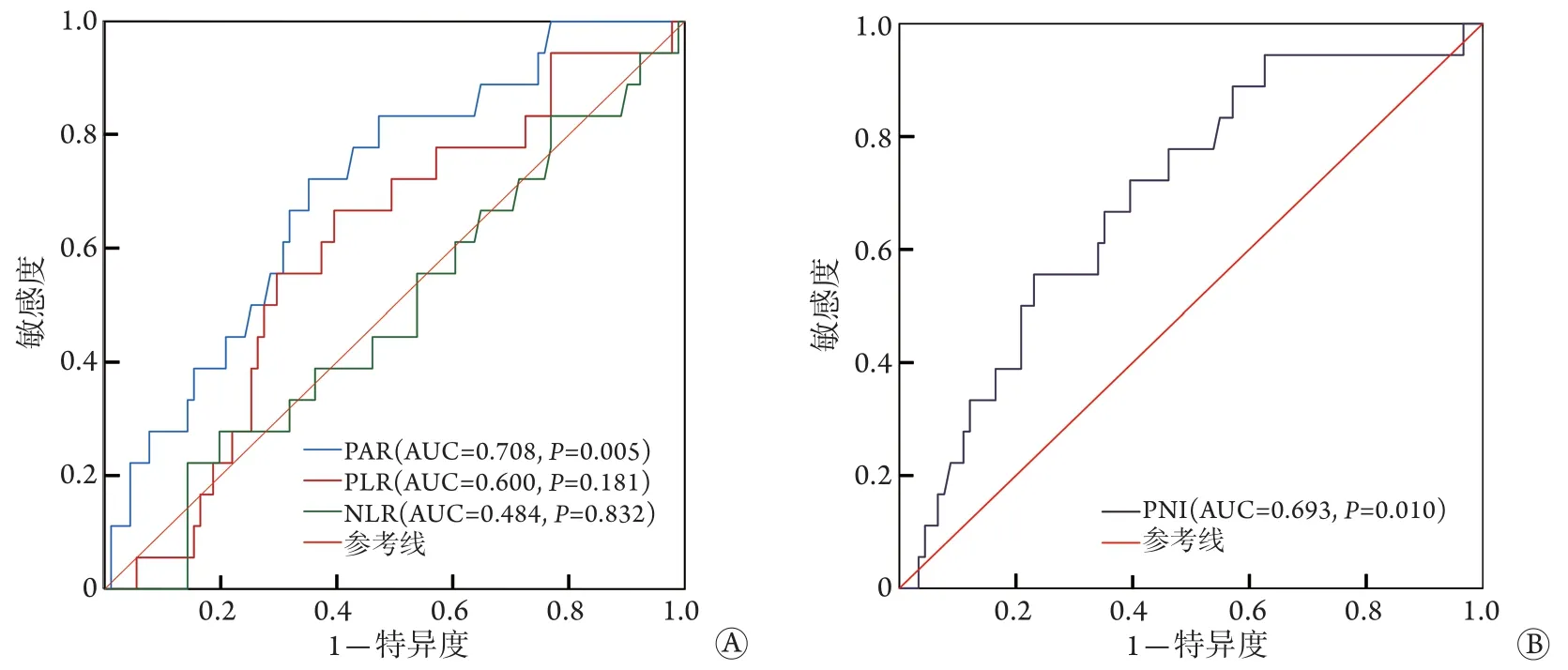
图1 各炎症免疫及营养指标(PAR、PLR、NLR和PNI)预测胸腺瘤患者OS的ROC曲线Fig.1 ROC curves of overall survival in thymoma patients predicted by inflammatory immune and nutritional indicators (PAR,PLR, NLR, and PNI)
2.3 胸腺瘤患者预后影响因素分析 将年龄、性别、肿瘤大小、有无血管侵犯、WHO分型、Masaoka分期、手术是否完整切除、有无辅助治疗、PAR及PNI等临床资料纳入Cox风险比例模型进行预后分析。单因素分析结果显示,年龄、性别、肿瘤大小及辅助治疗与胸腺瘤患者的OS和PFS均无相关性(P>0.05);血管侵犯、WHO分型、Masaoka分期、完整切除、PAR及PNI与胸腺瘤患者的OS和PFS明显相关(P<0.05,表2)。虽然辅助治疗与胸腺瘤患者OS不相关(P=0.056),但考虑到其在临床上的重要意义,将其与其他变量一起纳入多因素分析,结果显示,Masaoka分期、完整切除、辅助治疗和PNI为胸腺瘤患者OS的独立预后因素(P<0.05),完整切除为PFS的独立预后因素(P<0.05,表3)。
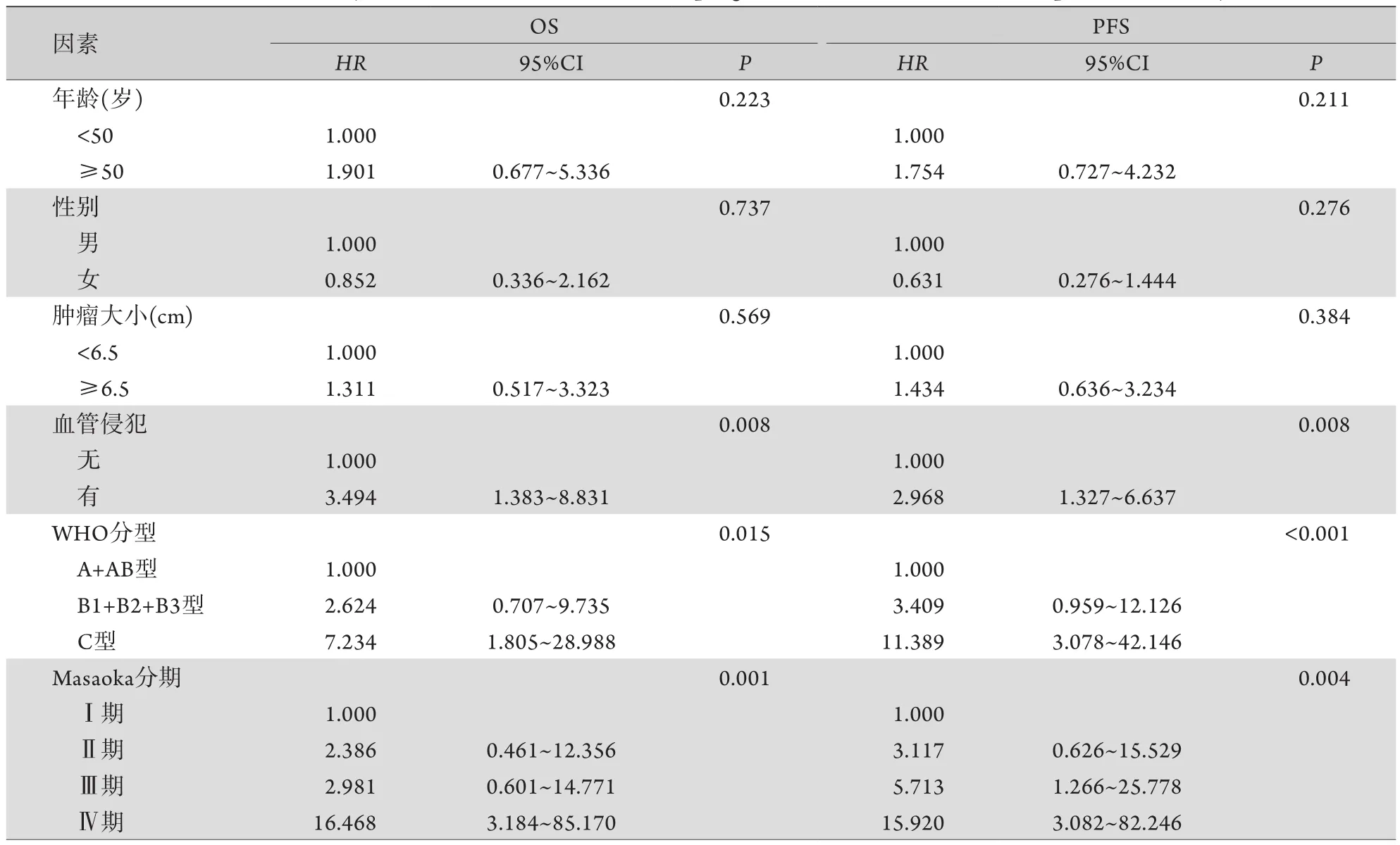
表2 胸腺瘤患者OS和PFS影响因素的单因素分析Tab.2 Univariate analysis of overall survival (OS) and progression free survival (PFS) in patients with thymoma
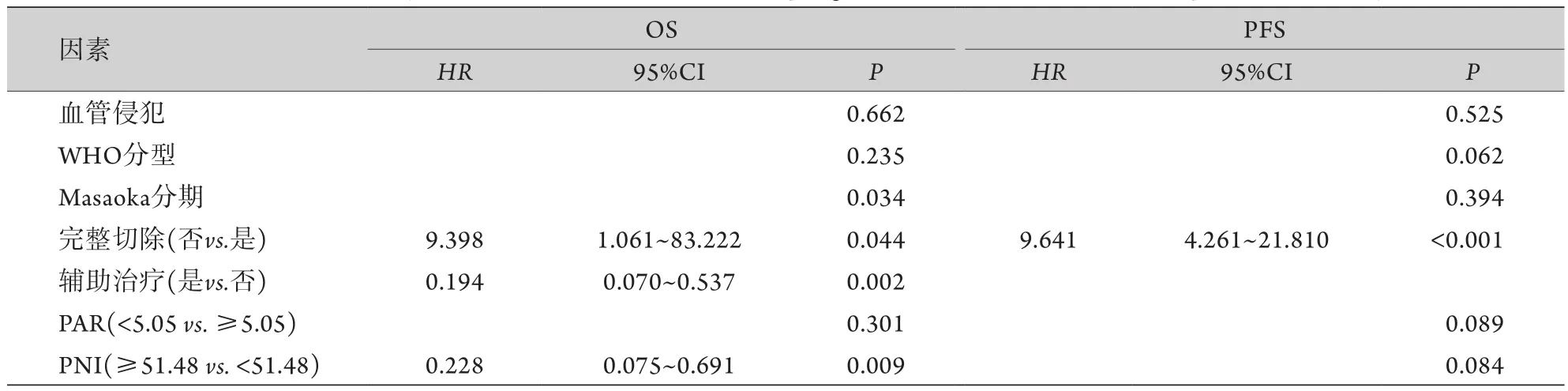
表3 胸腺瘤患者OS和PFS影响因素的多因素分析Tab.3 Multivariate analysis of overall survival (OS) and progression free survival (PFS) in patients with thymoma
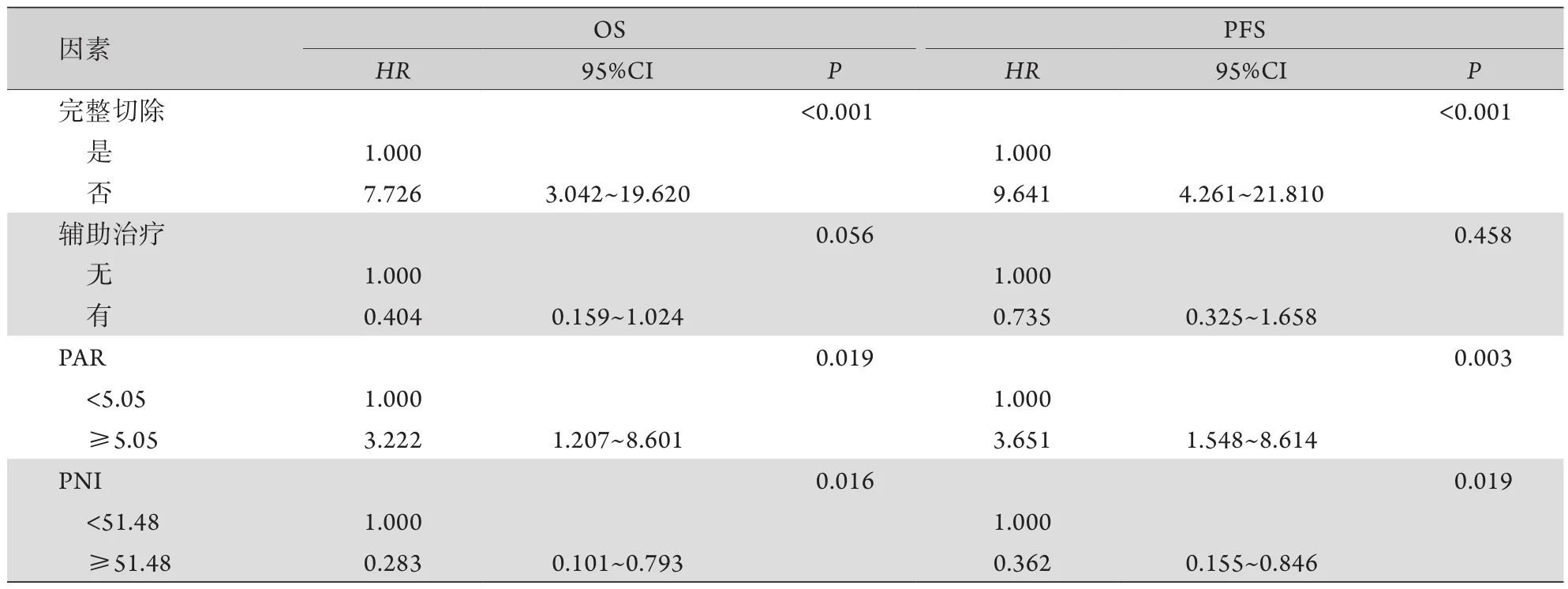
(续 表)
2.4 不同PAR和PNI组胸腺瘤患者的生存分析Kaplan-Meier生存曲线分析显示,PAR和PNI与总生存率和无进展生存率均明显相关(P<0.05,图2)。低PAR组12、36、60个月的累计总生存率和累计无进展生存率高于高PAR组(累计总生存率:95.4%vs.84.0%、89.1%vs.71.5%、89.1%vs.53.6%,P=0.013;累计无进展生存率:92.0%vs.84.0%、90.0%vs.59.6%、82.1%vs.31.8%,P=0.002,图2A)。低PNI组12、36、60个月的累计总生存率和累计无进展生存率低于高PNI组(累计总生存率:85.5%vs.94.4%、69.4%vs.92.5%、69.4%vs.82.2%,P=0.010;累计无进展生存率:83.3%vs.93.1%、63.4%vs.89.7%、57.6%vs.69.5%,P=0.014,图2B)。

图2 不同PAR和PNI组胸腺瘤患者的预后情况Fig.2 Prognosis of thymoma patients in different PAR and PNI groups
3 讨 论
胸腺肿瘤研究共识指出,所有胸腺瘤均应视为恶性肿瘤,因为即使是A型胸腺瘤也存在远处转移及完整切除后复发的可能[5]。长期以来,胸腺瘤的预后相关研究多集中在Masaoka分期、组织学分型和手术是否完整切除等方面[6],然而评估这些因素需要对胸腺瘤进行手术并对术后标本进行病理学检查,此过程存在术者间的差异、手术及标本检查较困难且费用昂贵等问题。因此,积极寻找临床易评估的预后指标对于胸腺瘤患者至关重要。研究发现,肿瘤患者炎症免疫及营养状态的改变与其预后明显相关[8,21],且炎症免疫及营养指标更加经济、客观,在临床工作中更易获取。本研究首次将NLR、PLR、PAR及PNI联合应用于评估胸腺瘤患者的临床特征和预后。
本研究ROC曲线分析显示,相较于PLR和NLR,PAR和PNI与胸腺瘤患者的生存明显相关。高PAR组和低PNI组中B型和C型胸腺瘤占比较低PAR组和高PNI组高,提示高PAR或低PNI患者的组织学类型倾向于B型和C型;而低PNI组中肿瘤血管侵犯的比例较高PNI组高,提示低PNI患者易发生血管侵犯;同时,高PAR组中肿瘤不完整切除的比例较低PAR组高,提示高PAR患者的肿瘤不易完整切除,而低PNI组中较高肿瘤分期的患者比例较高PNI组高,提示低PNI患者更有可能在Masaoka分期较晚的阶段被确诊。以上结果表明,高PAR或低PNI患者的肿瘤更具侵袭性,预后更差。进一步分析发现,PAR和PNI可能均通过术前较高的血小板计数及较低的血清白蛋白和淋巴细胞计数来反映胸腺瘤患者的术前炎症免疫及营养状态。有研究发现,肿瘤确诊时血小板计数增高可导致多种类型实体肿瘤患者的长期存活率降低[22]。其潜在机制可能为:(1)在肿瘤相关炎症反应中,白细胞介素-1(interleukin-1,IL-1)、IL-6、IL-11、IL-23、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、血管内皮生长因子(vascular endothelial growth factor,VEGF)和基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)[23]等细胞因子或生长因子可直接或间接地调控造血干细胞向生成血小板的方向动员,从而导致血小板增多。(2)血小板可能参与肿瘤进展和转移[24]。首先,血小板激活后释放内源性因子如VEGF、血小板衍生生长因子(platelet derived growth factor,PDGF)、转化生长因子-β1(transforming growth factor-β1,TGF-β1)和胰岛素样生长因子-1(insulin like growth factor-1)[23,25]等刺激肿瘤血管生成,从而促进肿瘤进展。其次,血小板包绕循环肿瘤细胞(circulating tumor cells,CTCs),或血小板将正常的主要组织相容性复合体(major histocompatibility complex,MHC)-Ⅰ类分子转移至CTCs表面[26],或血小板产生细胞因子TGF-β而下调NK细胞上NKG2D受体的表达[27],致使NK细胞的抗肿瘤作用受损,进而促进肿瘤转移。(3)血小板和白细胞相互作用,为肿瘤发展和转移提供了至关重要的肿瘤微环境[28]。也有研究发现,肿瘤患者的生存与术前营养和免疫状况等宿主因素有关[29],其可能机制为:(1)对于新陈代谢,血清白蛋白是营养运输的重要元素,而肿瘤患者的营养不良和炎症反应可抑制血清白蛋白的合成[30]。(2)淋巴细胞来源于造血干细胞,是适应性免疫反应的主要细胞[31]。营养不良时,营养状态和免疫细胞代谢间的桥梁瘦素与造血细胞表面瘦素受体(leptin receptor,LepR)的结合减少,从而影响淋巴细胞的成熟和发育[32]。因此,肿瘤患者发生营养不良时会出现低血清白蛋白与淋巴细胞减少,最终影响预后。
既往对肺癌、尿路上皮癌等各种恶性肿瘤的研究发现,术前高PAR患者具有相对较差的预后[33]。本研究首次将术前PAR应用于胸腺瘤患者的预后评估。Cox单因素分析显示,术前PAR与胸腺瘤患者的OS和PFS明显相关;与低PAR组相比,高PAR组胸腺瘤患者的OS和PFS较差。因此术前PAR对胸腺瘤患者的预后具有一定的影响,但其是否为胸腺瘤患者OS和PFS的独立危险因素需要进一步研究。既往对食管癌和骨肉瘤等恶性肿瘤的研究发现,术前PNI较低的患者预后相对较差[11,34]。本研究Cox单因素分析显示,术前PNI与胸腺瘤患者的OS和PFS明显相关;多因素分析显示,低PNI是胸腺瘤患者OS的独立危险因素,与既往研究结果一致[16]。本研究Kaplan-Meier生存曲线分析证实,与高PNI组相比,低PNI组胸腺瘤患者的OS和PFS均较差。以上结果表明,术前高PAR和低PNI对胸腺瘤患者的预后具有不利影响,可能成为评估胸腺瘤患者预后的新指标。此外,本研究中PAR的最佳截断值为5.05,低于既往研究报道的部分更具侵袭性的恶性肿瘤相应值(如尿路上皮癌的6.67、非小细胞肺癌的8.8及胆管癌的7.26等)[14,33,35];PNI最佳截断值为51.48,高于既往研究报道的部分更具侵袭性的恶性肿瘤相应值(如食管癌的45、骨肉瘤的46.7及胃肠道间质瘤的47.5等)[11,34,36],这在一定程度上反映了胸腺瘤相对惰性的生物学行为。
本研究仍存在一定局限性,因其他非胸腺瘤原因直接致死的病例,如术后因外伤和急性中枢神经系统脱髓鞘病等死亡,这部分病例可能影响研究结果的可靠性,后续需要对其关联性进行深入研究;本研究为单中心回顾性研究,随访样本量较小,随访时间较短。因此,PAR、PNI及其他炎症免疫指标能否作为评估患者预后的标准仍需要多中心及大样本量的前瞻性临床研究加以证实。
综上所述,本研究结果表明,术前PAR和PNI与胸腺瘤患者的预后明显相关,可能成为临床指导胸腺瘤诊疗和预后评估的新指标,结合Masaoka分期、组织学分型和手术是否完整切除等指标可进一步推动胸腺瘤患者的个体化诊疗。
