支气管扩张症合并非结核分枝杆菌感染患者血清和肽素、分泌型磷脂酶A2-X及致炎-抑炎因子谱的变化
2022-01-18汝触会陈爱凤何飞鲍志坚丁士标
汝触会,陈爱凤,何飞,鲍志坚,丁士标
浙江大学医学院附属杭州市胸科医院呼吸科,杭州 310003
支气管扩张症(BCS)是由于各种原因造成气道上皮纤毛运动功能障碍,引起黏液聚集、病原菌感染等,导致纤毛结构破损并触发气道炎症,进一步刺激炎性细胞浸润,支气管结构破坏,继而造成支气管管腔持续扩张的一类呼吸系统疾病[1]。BCS患者由于支气管变形且支气管壁肌肉组织受损,极易伴发感染,进一步加重了气道的病理性改变,并影响临床预后[2-3]。非结核分枝杆菌(NTM)是指除结核分枝杆菌(MTB)复合群及麻风分枝杆菌外的其他分枝杆菌,可通过皮肤、胃肠道及呼吸道等侵入人体,常继发于BCS、尘肺病、肺结核病等结构性肺病[4-5]。因此,临床上常见BCS合并NTM感染者。有研究显示,46.2%的NTM感染者合并BCS,二者互为因果,BCS可能是NTM感染的“温床”,而NTM感染可能是BCS恶化的原因[6]。
BCS的发病原因及机制目前尚未完全明确,近年来,炎症损伤相关机制受到了广泛关注。和肽素(CPP)是一种新型生物标志物,常用于判断肺炎、脓毒血症等急性病的预后,可作为炎性指标反映肺炎患者的病情变化[7]。分泌型磷脂酶A2-X(sPLA2-X)也被证实在机体炎症反应中起重要作用,可作用于多种炎性细胞而刺激重要炎性递质的释放,从而加速炎症反应的发生发展[8]。目前尚未见关于BCS合并NTM感染患者血清CPP、sPLA2-X表达情况及致炎-抑炎因子谱变化的报道。本研究检测了BCS合并NTM感染患者血清CPP、sPLA2-X及致炎-抑炎因子谱的变化,以期为BCS合并NTM感染的治疗提供依据。
1 资料与方法
1.1 一般资料 选取2017年1月-2020年6月浙江大学医学院附属杭州市胸科医院呼吸科收治的BCS患者110例。纳入标准:(1) BCS符合《成人支气管扩张症诊治专家共识》[9]中的诊断标准,并经临床症状结合肺部CT检查确诊;(2) NTM感染符合《非结核分枝杆菌病诊断与治疗专家共识》[10]中的诊断标准,并经影像学检查、痰或支气管肺泡灌洗液(BALF)中NTM培养结果结合临床症状确诊;(3) 年龄>18岁,性别不限;(4) 具有完整的临床及实验室检查资料。排除标准:(1) 合并免疫系统疾病或近期使用免疫调节剂;(2) 合并恶性肿瘤;(3) 合并哮喘、慢性阻塞性肺疾病(COPD)、慢性肺脓肿等其他影响本研究结果的疾病;(4) 合并严重心、脑、肝、肾功能障碍或消化系统疾病、血液系统疾病;(5) 合并系统性红斑狼疮、结核病及类风湿关节炎等疾病;(6) 存在认知功能障碍或沟通交流障碍;(7) 妊娠期或哺乳期女性。另选同期在本院健康体检中心接受体检的年龄、性别相匹配的健康志愿者40名为对照组,既往身体健康,无BCS及呼吸系统疾病,近1个月内无呼吸系统感染史,胸部X线片及血、尿、便常规等各项检查均正常。
1.2 方法
1.2.1 问卷调查 采用自行设计的一般资料调查问卷进行调查,内容包括年龄、性别、基础疾病等,测量身高及体重,计算体重指数(BMI)。BMI=体重/身高2(kg/m2)。采用支气管扩张严重程度指数(bronchiectasis severity index,BSI)评价BCS病情的严重程度[11],BSI评价内容包括年龄、BMI、一秒用力呼气容积占预计值百分比(FEV1%)、近2年入院次数、近1年急性加重次数、呼吸困难指数评分系统(MRC)评分、铜绿假单胞菌定植、其他菌定植、影像学受累叶段数共9个方面,总分0~26分,0~4分为轻度,5~8分为中度,≥9分为重度,得分越高表明BCS病情越严重。
1.2.2 影像学检查 用螺旋CT机对受试者进行胸部CT扫描,扫描范围为肺尖至后肋膈角最低平面,分别统计右侧上、中、下及左侧固有上、左舌与左下肺叶的受累情况。BCS影像学诊断标准:(1)胸部X线片检查显示局灶性肺炎或散在不规则性高密度影,可见线性或盘状不张,可伴特征性气道扩张及增厚,呈类环状阴影或具有轨道征;(2)CT示支气管内径大于相邻血管直径[正常值(0.62±0.13) mm],支气管呈囊状或柱状改变,气道壁明显增厚(内径<80%外径)、支气管2 cm长度范围内无管腔变细趋势,可见黏液阻塞、“马赛克征”或“树枝发芽征”等改变[9]。
1.2.3 病原菌检测 采集痰标本、BALF进行NTM培养,采用萋-尼氏抗酸染色法进行抗酸杆菌检测,采用Bactec MGIT 960全自动快速分枝杆菌培养仪及专用培养基分离培养NTM,培养阳性菌株通过涂片抗酸染色排除污染菌,结核/非结核分枝杆菌DNA检测鉴别NTM,按照基因芯片法完成菌种鉴定。采用结核感染T细胞斑点试验(T-SPOT-TB)技术鉴定结核菌感染。NTM鉴定方法与流程参照《非结核分枝杆菌病诊断和治疗专家共识》[10],符合以下任一条件即可诊断:(1) 2份分开送检的痰标本经NTM培养均呈阳性且均为同一致病菌,NTM分子生物学检测亦显示为同一致病菌;(2) 经支气管冲洗液或BALF培养NTM呈阳性和(或)分子生物学检查呈阳性;(3) 经支气管镜等肺活检组织检查显示分枝杆菌病的组织病理学特征性改变,且经活检组织NTM培养和(或)分子生物学检查呈阳性;(4) 经支气管镜等肺活组织检查显示分枝杆菌病的组织病理学特征性改变,且经≥1次痰标本、经支气管冲洗液或BALF培养NTM或分子生物学检查呈阳性。
1.2.4 血液指标检测 对照组于就诊当日晨取空腹静脉血4.0 ml,病例组于就诊当日或次日用药前晨取空腹静脉血4.0 ml,3000 r/min离心10 min分离血清。采用酶联免疫吸附(ELISA)法测定血清CPP、sPLA2-X、肿瘤坏死因子-α(TNF-α)、γ干扰素(IFN-γ)、白细胞介素(IL)-1β、IL-6、IL-4、IL-10及IL-17A水平,均严格按照试剂说明书进行操作。
1.3 统计学处理 采用SPSS 22.0软件进行统计分析。符合正态分布及方差齐性的计量资料以表示,多组间比较采用单因素方差分析,进一步组间两两比较采用LSD-t检验;计数资料以例(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料比较 110例BCS患者均行痰或诱导痰标本NMT培养(阳性31例),57例行痰NTM-DNA检测(阳性17例),41例行BALF标本NTM培养(阳性19例),52例行血T-SPOT-TB检测(阳性2例),10例取BALF液送检二代测序(NGS)(阳性8例),12例行经支气管镜肺活组织检查(均显示肺组织病理学特征性改变)。最终确诊合并NTM感染37例(NTM感染组),其中快速生长型NTM 25例,缓慢生长型NTM 12例;其余73例为单纯BCS组。三组年龄、性别构成及BMI比较差异均无统计学意义(P>0.05)。单纯BCS组与NTM感染组的高血压、糖尿病及支气管扩张>4个肺叶的比例比较差异无统计学意义(P>0.05,表1)。

表1 各组一般资料比较Tab.1 Comparison of general information among the three groups
2.2 各组血清CPP、sPLA2-X水平比较 NTM感染组、单纯BCS组的血清CPP、sPLA2-X水平均高于对照组,且NTM感染组高于单纯BCS组,差异均有统计学意义(P<0.05,表2)。
表2 各组血清CPP、sPLA2-X水平比较()Tab.2 Comparison of serum levels of CPP and sPLA2-X among the three groups ()
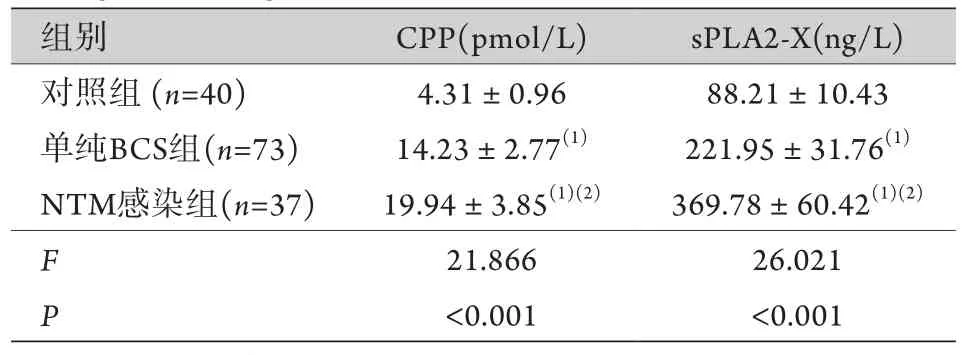
表2 各组血清CPP、sPLA2-X水平比较()Tab.2 Comparison of serum levels of CPP and sPLA2-X among the three groups ()
CPP. 和肽素;sPLA2-X. 分泌型磷脂酶A2-X;与对照组比较,(1)P<0.05;与单纯BCS组比较,(2)P<0.05。
组别 CPP(pmol/L) sPLA2-X(ng/L)对照组 (n=40) 4.31±0.96 88.21±10.43单纯BCS组(n=73) 14.23±2.77(1) 221.95±31.76(1)NTM感染组(n=37) 19.94±3.85(1)(2) 369.78±60.42(1)(2)F 21.866 26.021
2.3 各组血清致炎-抑炎因子水平比较 NTM感染组、单纯BCS组的血清TNF-α、IFN-γ、IL-1β、IL-6、IL-4、IL-10、IL-17A水平均高于对照组,且NTM感染组高于单纯BCS组,差异均有统计学意义(P<0.05,表3)。
表3 各组血清致炎-抑炎因子水平比较(, ng/L)Tab.3 Comparison of serum levels of pro- and anti-inflammatory cytokines among the three groups (, ng/L)
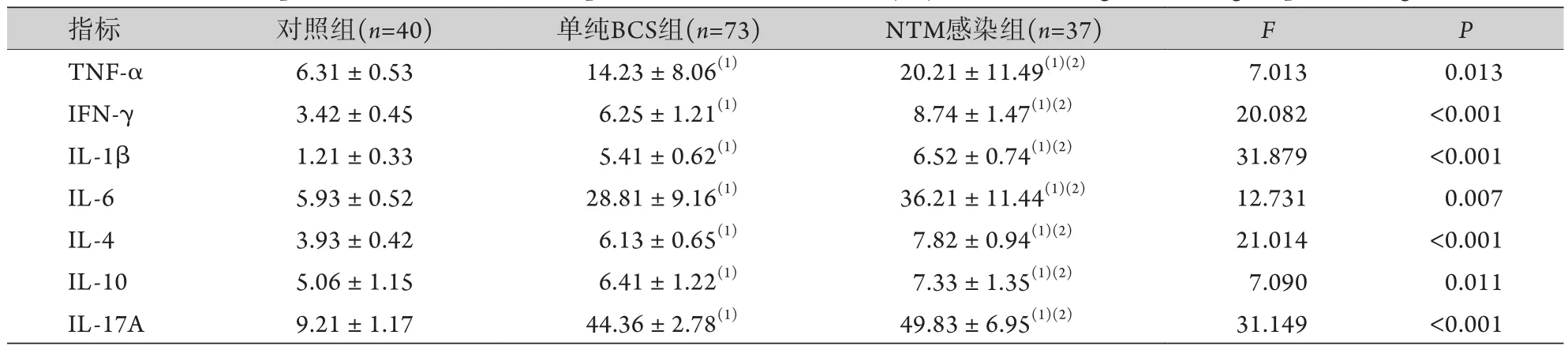
表3 各组血清致炎-抑炎因子水平比较(, ng/L)Tab.3 Comparison of serum levels of pro- and anti-inflammatory cytokines among the three groups (, ng/L)
TNF-α. 肿瘤坏死因子-α;IFN-γ. γ干扰素;IL-1β.白细胞介素-1β;IL-6. 白细胞介素-6;IL-4. 白细胞介素-4;IL-10. 白细胞介素-10;IL-17A. 白细胞介素-17A;与对照组比较,(1)P<0.05;与单纯BCS组比较,(2)P<0.05。
指标 对照组(n=40) 单纯BCS组(n=73) NTM感染组(n=37) F P TNF-α 6.31±0.53 14.23±8.06(1) 20.21±11.49(1)(2) 7.013 0.013 IFN-γ 3.42±0.45 6.25±1.21(1) 8.74±1.47(1)(2) 20.082 <0.001 IL-1β 1.21±0.33 5.41±0.62(1) 6.52±0.74(1)(2) 31.879 <0.001 IL-6 5.93±0.52 28.81±9.16(1) 36.21±11.44(1)(2) 12.731 0.007 IL-4 3.93±0.42 6.13±0.65(1) 7.82±0.94(1)(2) 21.014 <0.001 IL-10 5.06±1.15 6.41±1.22(1) 7.33±1.35(1)(2) 7.090 0.011 IL-17A 9.21±1.17 44.36±2.78(1) 49.83±6.95(1)(2) 31.149 <0.001
2.4 NTM感染组中不同BCS程度患者血清CPP、sPLA2-X水平比较 根据BSI评价结果,37例NTM感染患者中,按BCS病情严重程度分为轻度10例、中度16例、重度11例。随着支气管扩张程度的加重,血清CPP、sPLA2-X水平呈升高趋势,差异有统计学意义(P<0.05,表4)。
表4 NTM感染组中不同BCS程度患者血清CPP、sPLA2-X水平比较 ()Tab.4 Comparison of serum levels of CPP and sPLA2-X in patients of NTM infection group with different degrees of BCS()
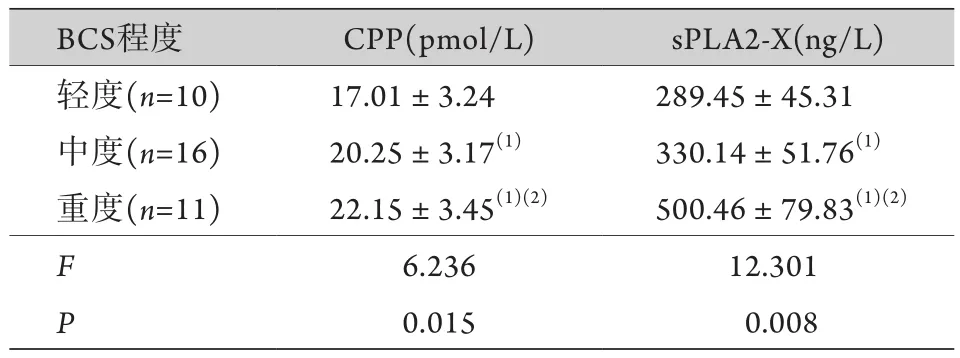
表4 NTM感染组中不同BCS程度患者血清CPP、sPLA2-X水平比较 ()Tab.4 Comparison of serum levels of CPP and sPLA2-X in patients of NTM infection group with different degrees of BCS()
CPP. 和肽素;sPLA2-X. 分泌型磷脂酶A2-X;与轻度比较,(1)P<0.05;与中度比较,(2)P<0.05。
BCS程度 CPP(pmol/L) sPLA2-X(ng/L)轻度(n=10) 17.01±3.24 289.45±45.31中度(n=16) 20.25±3.17(1) 330.14±51.76(1)重度(n=11) 22.15±3.45(1)(2) 500.46±79.83(1)(2)F 6.236 12.301 P 0.015 0.008
2.5 NTM感染组中不同BCS程度患者血清致炎-抑炎因子水平比较 随着支气管扩张程度的加重,血清TNF-α、IFN-γ、IL-1β、IL-6、IL-4、IL-10、IL-17A水平呈升高趋势,重度患者明显高于轻、中度患者,差异有统计学意义(P<0.05),除IL-6和IL-10外,中度患者的其他炎性因子水平高于轻度患者,差异有统计学意义(P<0.05)(表5)。
表5 NTM感染组中不同BCS程度患者血清致炎-抑炎因子水平比较 (, ng/L)Tab.5 Comparison of serum levels of pro- and anti-inflammatory cytokines in patients of NTM infection group with different degrees of BCS (, ng/L)
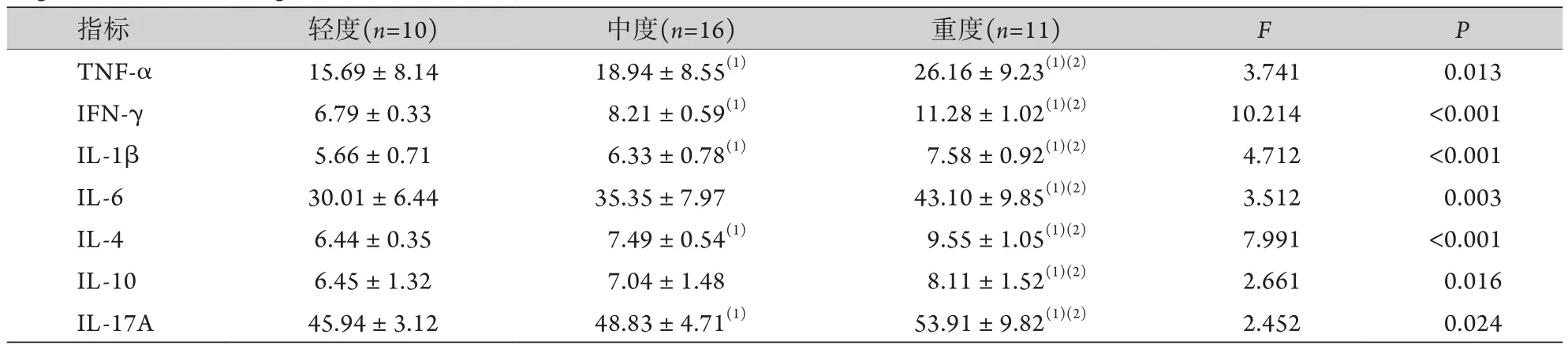
表5 NTM感染组中不同BCS程度患者血清致炎-抑炎因子水平比较 (, ng/L)Tab.5 Comparison of serum levels of pro- and anti-inflammatory cytokines in patients of NTM infection group with different degrees of BCS (, ng/L)
TNF-α. 肿瘤坏死因子-α;IFN-γ.干扰素-γ;IL-1β.白细胞介素-1β;IL-6. 白细胞介素-6;IL-4. 白细胞介素-4;IL-10. 白细胞介素-10;IL-17A. 白细胞介素-17A;与轻度比较,(1)P<0.05;与中度比较,(2)P<0.05。
指标 轻度(n=10) 中度(n=16) 重度(n=11) F P TNF-α 15.69±8.14 18.94±8.55(1) 26.16±9.23(1)(2) 3.741 0.013 IFN-γ 6.79±0.33 8.21±0.59(1) 11.28±1.02(1)(2) 10.214 <0.001 IL-1β 5.66±0.71 6.33±0.78(1) 7.58±0.92(1)(2) 4.712 <0.001 IL-6 30.01±6.44 35.35±7.97 43.10±9.85(1)(2) 3.512 0.003 IL-4 6.44±0.35 7.49±0.54(1) 9.55±1.05(1)(2) 7.991 <0.001 IL-10 6.45±1.32 7.04±1.48 8.11±1.52(1)(2) 2.661 0.016 IL-17A 45.94±3.12 48.83±4.71(1) 53.91±9.82(1)(2) 2.452 0.024
3 讨 论
BCS是一种不可逆的慢性呼吸系统疾病,黏液阻塞、反复感染等因素所致气道持续性炎症反应导致疾病发生发展[11]。NTM属于环境致病菌,同时也是兼性细胞内寄生菌,多继发于有慢性呼吸系统疾病的患者[12]。BCS患者多存在明显的气道病理改变,原有组织被纤维组织取代,气道壁结构发生严重损毁,主要表现为弹性气道组织受损,气道原有屏障作用及抵抗力下降或缺失,气道黏膜的免疫功能受损,为NTM的生长与繁殖提供了有利的微环境[13]。国内外对BCS合并NTM的概率报道不一,60%~80%的稳定期BCS患者气道内存在潜在的定植致病菌,除常见的革兰阴性菌外,NTM比例也较高,多数学者认为BCS是NTM感染的重要因素[14]。现已证实,多种细胞因子参与了BCS的发生及发展过程,而以T细胞免疫为主的细胞免疫及免疫介导的炎症反应在其发病过程中可能起关键性作用[15]。BCS合并NTM是否进一步影响免疫介导的炎症反应目前研究较少。
CPP是一种新型生物标志物,是精氨酸加压素原C-末端的组成部分,主要作用是校正精氨酸加压素(AVP)前体的结构与形成。正常生理状态下,人体内AVP含量极低,但在低血压、感染等情况下可迅速升高,故常用于评估心脑血管疾病的病情及预后。但AVP的半衰期较短且生物活性不稳定,难以体外测定,而CPP具有更长的半衰期,且体外稳定性更好,可直接反映人体AVP的水平[16]。已有研究显示,CPP对下呼吸道感染、肺炎等疾病的预后具有良好的预测价值,尤其是在COPD患者中呈明显升高趋势,且与病情严重程度呈正相关,可能与呼吸道炎性细胞因子刺激有关[17]。本研究结果显示,BCS患者的血清CPP水平较健康对照组明显升高,在合并NMT感染时进一步升高,且随支气管扩张程度的加重呈升高趋势,提示BCS合并NMT感染可能导致病情加重,且CPP水平升高或与病情加重有关。原因可能是病情加重、合并NMT感染时,管腔免疫功能下降,炎症损伤进一步加重,提示CPP有望成为评价BCS病情严重程度及合并NMT感染时病情评估的生物标志物。
关于BCS合并NTM感染的确切机制,目前尚无统一定论,但免疫介导的炎症反应被证实与BCS及NTM感染的发生发展有关。sPLA2-X是磷脂酶A2(PLA2)的亚型之一,具有独立的促炎催化作用,可刺激嗜酸性粒细胞、中性粒细胞、淋巴细胞及气道上皮细胞等释放多种炎性递质,从而促进炎症反应的发生与发展[18]。本研究结果显示,BCS患者的血清sPLA2-X水平高于健康对照组,且BCS合并NTM感染组的血清sPLA2-X水平高于单纯BCS组,提示sPLA2-X过表达与BCS的发生及发展有关,且在合并NMT感染时进一步加重。与此同时,在BCS合并NTM感染患者中,随着BCS严重程度的增加,sPLA2-X水平明显升高,提示监测sPLA2-X水平变化可能有助于评估BCS病情严重程度及NTM感染情况。
Th1与Th2细胞是CD4+T细胞的主要亚群,分别介导细胞免疫与体液免疫,前者可通过释放TNF-α、IFN-γ、IL-1、IL-6等细胞因子而增强机体对病原菌的抵抗能力,尤其是对于细胞内病原体的抵抗能力;Th2细胞则可释放IL-4、IL-10等增强机体对胞外病原体的抵御能力[19]。内源性TNF-α可刺激IL-1β的释放,而IL-1β又可刺激IL-6等炎性细胞因子的释放,并可反过来提高组织细胞对TNF-α的敏感性。为维持机体环境的稳定性,机体在释放多种促炎细胞因子的同时也可分泌部分抑炎细胞因子,两者处于平衡状态[20]。IL-4、IL-10是最强有力的抑炎细胞因子,可抑制嗜酸细胞、中性粒细胞及单核巨噬细胞释放TNF-α、IL-1、IL-6等促炎细胞因子[21-22]。IL-17A是Th17细胞的主要效应因子,也是一种重要的促炎细胞因子,已被证实与呼吸道感染、支气管炎症及BCS有关[23]。本研究结果显示,BCS患者的促炎细胞因子TNF-α、IFN-γ、IL-1β、IL-6、IL-17A均较健康对照组明显升高,且在合并NMT感染者中升高更明显。原因是BCS属于慢性气道疾病,多继发于急慢性呼吸道感染或支气管阻塞后,持续支气管炎症可导致支气管壁的结构受损,引起支气管异常及持久性的扩张,而支气管内病原菌定植可进一步干扰管腔内环境及局部免疫功能,进一步加重管腔结构性破坏及炎症性损伤。
另外,本研究还发现,BCS患者的抑炎因子IL-4、IL-10亦显著高于对照组,且在合并NTM感染者中明显升高。原因是机体的抑炎反应稍晚于促炎反应,故炎症早期表现为促炎细胞因子大量释放,随着炎症的扩大,抑炎细胞因子也可代偿性升高[24]。在发生BCS后,内源性促炎与抑炎介质均增加,而促炎介质的释放多于抑炎介质,导致细胞因子的保护作用转变为自身破坏性模式,不仅导致局部组织细胞受损,而且增加了机会感染。Zhang等[25]发现,支气管炎症患者的血清IL-4等炎性细胞因子水平均较健康人群明显升高,与本研究结果一致。进一步比较不同BCS程度患者的血清促炎与抑炎细胞因子水平发现,随着BCS程度的加重,血清TNF-α、IFN-γ、IL-1β、IL-6、IL-17A、IL-4、IL-10水平均呈升高趋势,以重度患者升高最明显。王月平等[26]发现,BCS患者的血清炎性因子呈明显高表达状态,且随病情加重而逐渐升高。由此可见,监测促炎与抑炎因子水平有助于判断病情的严重程度并指导临床治疗。
综上所述,BCS患者血清CPP、sPLA2-X及促炎因子明显升高,且抑炎因子也可能代偿性升高,BCS合并NTM感染及BCS程度加重时升高更为明显,提示CPP、sPLA2-X及部分炎性因子有助于判断BCS合并NTM感染及BCS病情的严重程度,对临床治疗具有一定的指导意义。但上述因子的分泌与释放可能受多种因素的影响,其对疾病的评估价值有一定局限性,今后还有待进一步行大样本、多中心研究加以验证。
