美拉德反应对蓝蛤酶解产物抗氧化活性的影响
2022-01-18刘瑛楠祝伦伟朱文慧李学鹏励建荣于建洋
步 营,刘瑛楠,于 玲,祝伦伟,朱文慧,李学鹏,励建荣,于建洋
(1.渤海大学 食品科学与工程学院,辽宁锦州 121013;2.山东时进检测服务有限公司,山东荣成 264309;3.荣成泰祥食品股份有限公司,山东威海 264309)
0 引言
蓝蛤(Aloididae aloidi)是一种盛产于我国沿海滩涂的小型低值贝类,富含蛋白质,因个体小而加工困难,主要作为对虾养殖的活饵料使用[1]。由于对虾养殖业萎缩以及饵料的严格控制等原因,导致蓝蛤用量大为减少,因此,蓝蛤等低值贝类资源的高值化利用亟待解决。蓝蛤中含有多种呈味物质,其中呈鲜甜味的氨基酸约占氨基酸总量的50%,是制备海鲜调味料的理想原料[2],可以采用生物酶解技术对其进行水解处理而加以利用。
美 拉 德 反 应(Maillard reaction,MR)是 指羰基类化合物与氨基类化合物之间进行的一系列氧化、环化、脱水和聚合等复杂化学反应的统称,该过程的产物即为美拉德反应产物(Maillard reaction products,MRPs)[3]。在 MR 过程中,生成了具有抗氧化活性的类黑精、还原酮以及挥发性杂环化合物(呋喃、吡咯、噻吩和噻唑)[4]。MRPs的抗氧化机制包含自由基链断裂、清除活性氧、消除过氧化氢和金属离子螯合等[5],其中类黑精的抗氧化性得益于具有较强的消除活性氧能力,而还原酮是通过供氢原子而终止自由基的链式反应。有研究表明,MRPs的抗氧化能力受氨基酸组成、序列和链长的影响[6],肽分子量的大小与MRPs抗氧化活性之间存在关联。徐浩等[7]发现5~10 ku的河蚬酶解液MRPs具有最高的羟基自由基清除率;LIU等[8]研究发现,与对应组(1~5 kDa)相比,木糖 - 大豆肽(<1 kDa)模型体系产生的MRPs具有更强的抗氧化活性。已有研究证明,超高压耦合酶解技术提高了酶的活性,蓝蛤酶解液的水解度和风味得到了提升,经超高压处理后的蓝蛤蛋白质被分解成了更多的小分子物质,酶解液中肽的分子量更低[9],而常压和超高压酶解液经MR反应后抗氧化能力的对比变化规律尚未见报道。
基于此,本文对常压和超高压蓝蛤酶解液进行MR反应,制备MRPs,通过测定其DPPH自由基清除活性、ABTS自由基清除活性、Fe3+还原力、Fe2+螯合活性和羟自由基清除活性5个方面来评价蓝蛤酶解液MR后抗氧化能力的变化,以期得到天然抗氧化物,并进一步应用于实际生产中。
1 材料与方法
1.1 材料与试剂
蓝蛤,购自锦州市林西水产市场;无水乙醇、磷酸二氢钠、磷酸氢二钠,购自福晨(天津)化学试剂有限公司;1,1-二苯基-2-三硝基苯肼、过硫酸钾、三氯乙酸、三氯化铁、氯化亚铁、菲啰嗪、硫酸亚铁、水杨酸,购自上海阿拉丁生化科技股份有限公司;2 ,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐、铁氰化钾,购自北京索莱宝公司;6-羟基-2,5,7,8-四甲基色烷-2羧酸标准品,购自美国Sigma公司。上述试剂均为分析纯。
1.2 仪器与设备
HPP.L2-600/0.6型超高压设备(天津市华泰森淼生物工程技术有限公司);UV-2550型紫外-可见分光光度计(日本岛津公司);HH-4型数显恒温水浴锅(常州国华电器有限公司);PHS-3C型pH计(上海仪电科学仪器股份有限公司);Sorvall Stratos型冷冻高速离心机(美国Thermo公司)。
1.3 试验方法
1.3.1 蓝蛤酶解液的制备
将蓝蛤脱壳取肉,取蓝蛤肉加入去离子水(1:1,w/v)后均质,分别添加风味蛋白酶FlavourzymeTM500MG(0.2%w:v,500 LAPU/g)和 碱 性 蛋 白 酶 NovozymTM11039(0.2% w:v,1.2 AU-A/g),用1.0 mol/L的NaOH溶液调pH值为7.0,分别在 250 MPa条件下高压处理 1 h,后置于50 ℃水浴锅中酶解 4 h,和常压下酶解 4 h,酶解结束后 100℃下灭活 10 min。在 4 ℃以 5 120 g离心作用15 min,将上清液冷冻干燥后得到超高压酶解冻干粉F1,和常压酶解冻干粉F2,并贮存于干燥器中备用。
1.3.2 美拉德反应液的制备
以酶解冻干粉(0.50 g)、D- 木糖(0.20 g)和L-半胱氨酸(0.15 g)为原料,加入试管制备10 mL溶液反应体系。将反应体系pH值调为7.0后密封并转移到油浴中,反应温度为120 ℃,反应时间为1.5 h。将FI和F2的MRPs分别记为MRPF1和MRPF2,未添加D-木糖和L-半胱氨酸的热反应产物作为阴性对照(F1NC和F2NC),未加热反应作为空白对照(F1BC和F2BC)。
1.3.3 DPPH自由基清除活性测定
参照YU等[10]的方法稍作修改。移取10 mL样液和 10 mL DPPH 溶液(0.2 mmol/L,溶于无水乙醇制得),混合均匀后,于室温避光放置30 min,随后在 517 nm 处测定其吸光度(A2);将 10 mL样液和10 mL无水乙醇混合,其他操作同上,记为A1;将 10 mL DPPH 溶液和 10 mL 无水乙醇混合,其他操作同上,记为A0。按照下式计算DPPH自由基清除率。

1.3.4 ABTS自由基清除活性测定
参照杜椅楠等[11]的方法稍作修改。将配制好的ABTS溶液(7 mmol/L)与过硫酸钾溶液(2.4 mmol/L)按 1:1的比例混合后,在 30 ℃避光孵育12 h,制成ABTS自由基储备溶液。用前以pH=7.4的磷酸缓冲溶液(0.2 mol/L)为溶剂稀释ABTS自由基储备溶液至734 nm下吸光度为 0.7±0.02,取 10 μL 样品溶液和 4 mL 的 ABTS工作液,振荡混匀,静置6 min后在734 nm处测定吸光度。同时以 6- 羟基 -2,5,7,8- 四甲基色烷 -2-羧酸(Trolox μmol)做标曲,依据方程y=251.96x+41.516,R2=0.987计算Trolox当量。
1.3.5 还原力测定
参照JIANG等[12]的方法稍作修改。将0.5 mL样品溶液与2.5 mL 磷酸钠缓冲液(pH=6.6,0.2 mol/L)和 2.5 mL 铁氰化钾(1 g/mL,K3{Fe(CN)6})混合,于 50 ℃水浴 20 min。在室温下加入 2.5 mL 的三氯乙酸(TCA,10 g/mL),并在 3 000 g离心作用15 min,收集上清液。取 1 mL 上清液加入 10 mL超纯水和 1 mL FeCl3(0.1 g/mL),充分振荡后静置10 min。使用紫外-可见分光光度计在700 nm处读取混合物的吸光度。吸光度越高则还原力越高。用吸光度表示结果。
1.3.6 Fe2+螯合活性测定
参照杜椅楠等[11]的方法稍作修改。取0.2 mL样品溶液与 0.1 mL FeCl2(2 mmol/L)、4 mL 超纯水室温下混匀,静置5 min后加入0.2 mL菲啰嗪(5 mmol/L)。室温下混匀 5 min 后以 479 g离心作用10 min,取上清液在562 nm处测定吸光度(As)。取超纯水代替样品溶液按上述条件测定吸光度(A0)。计算Fe2+螯合率公式如下:

1.3.7 羟自由基清除活性测定
参照崔燕玲[13]的方法稍作修改。取0.1 mL样品溶液,加入 2 mL 的 FeSO4(9 mmol/L)、2 mL的水杨酸-乙醇溶液(9 mmol/L)和2 mL的H2O2溶液(8.8 mmol/L),混匀后于 37 ℃水浴 30 min,在510 nm处下测得A1;用去离子水代替样品如上述方法测得A;用去离子水代替水杨酸-乙醇溶液测得A0。计算清除率公式如下:

1.3.8 数据分析
每组试验重复3次,数据采用SPSS statistics 19.0软件进行显著性分析,进行单因素ANOVA检验,使用LSD法进行多重比较,P<0.05表明差异显著。数据绘图采用Origin 9软件。
2 结果与分析
2.1 DPPH自由基清除活性分析
DPPH自由基可通过氢的贡献被抗氧化物质清除,目前DPPH自由基清除活性测定已被用作评价物质抗氧化能力的标准。对超高压组和常压组的DPPH自由基清除活性分别进行方差分析,结果如图1所示。F1组BC、NC、MRPs的 DPPH自由基清除活性分别为67.8%、67.2%、83.4%,F2组分别为74.3%、75.1%、81.2%。与BC组相比,MRPs组的DPPH自由基清除率从67.8%~75.8%增加到 81.2~83.4%(P<0.05),其原因可能是由MR中产生的黑色素和低分子量的杂环化合物导致。BENJAKUL等[14]探究添加不同种类、浓度的糖与猪血浆蛋白进行MR后抗氧化活性的变化情况,结果表明添加2%半乳糖制备的MRPs的DPPH自由基清除活性显著高于果糖和葡萄糖,并且清除能力与MRPs添加量呈正相关。超高压酶解冻干粉F1的分子量低于常压酶解冻干粉F2。由图1可知,MRPF1的DPPH自由基清除活性优于MRPF2,这与YU等的研究报道一致,该团队研究发现MR后不同分子量花生肽的DPPH自由基清除活性显著提高,其中分子量<1 kDa的MRPs抗氧化活性最强。与BC组相比,NC组的DPPH自由基清除活性差异不显著(P>0.05),表明只加热对DPPH自由基清除活性的变化无明显影响。综上所述,MR能增强蓝蛤酶解液的DPPH自由基清除活性,且超高压酶解液的MRPs的DPPH自由基清除活性优于常压酶解液。

图1 美拉德反应后酶解液的DPPH自由基清除活性Fig.1 DPPH radical-scavenging activity of enzymatic hydrolysate after Maillard reaction
2.2 ABTS自由基清除活性分析
ABTS自由基清除法是常见的用于评价抗氧化能力的一种方法,其原理是ABTS二铵盐经过硫酸钾氧化后生成稳定的ABTS自由基,该物质呈蓝绿色,当加入具有抗氧化效果的物质后吸光度会降低[15]。从图2可看出,蓝蛤酶解液自身就具有一定的清除ABTS自由基能力(1233.1±55.1 μM Trolox/mL),这是由于酶解过程中,蛋白质被水解成具有抗氧化能力的多肽和氨基酸,使其清除自由基的能力得到增强。组内差异性分析表明,与酶解液相比,热反应产物(F1NC:1 643.3 μM Trolox/mL vs F2NC:1 636.7 μM Trolox/mL)及MRPs(MRPF1:2 253 μM Trolox/mL vs MRPF2:2 226.7 μM Trolox/mL )具有更高的清除活性,这表明加热以及MR均能显著增强蓝蛤酶解液的ABTS自由基清除活性(P<0.05)。该结果与已有研究一致,ZHAO等[16]研究表明MR能提升凤尾鱼蛋白酶解液的ABTS自由基清除活性,原因是反应过程中形成了具有碱性的杂环组分和重排肽或低分子量的芳香族氨基酸。本研究中,MRPF1的ABTS自由基能力优于常压,这与杜椅楠等[11]的研究结果一致,该小组以刺参肠为原料,对其进行酶解,制备MRPs并超滤分组,结果表明分子量<1 kDa的MRPs抗氧化性最强,其中对ABTS自由基的清除能力达到4.56 Trolox当量/μL样品。

图2 美拉德反应后酶解液的ABTS自由基清除活性Fig.2 ABTS radical-scavenging activity of enzymatic hydrolysate after Maillard reaction
2.3 还原力活性分析
MRPs具有将Fe3+还原成Fe2+的能力,并且在700 nm处具有最大吸收波长,其还原力越强时吸光度则越大[17-18]。图3是蓝蛤酶解液加热以及MR后还原力的变化情况。由图可知,酶解液自身同样具有一定的还原力,但还原力较低(F1BC:0.319 vs F2BC:0.195)。热反应后,其对应的加热产物的还原力有所增长但增幅小(F1NC:0.361 vs F2NC:0.299)。MR 反应后,超高压耦合酶解液及常压酶解液的MRPs还原力(MRPF1:0.978 vs MRPF2:0.937)显著增强(P<0.05)。该结果与以往的研究报道一致,卢彬[19]研究发现,金带细鲹蛋白酶解液的还原力随着MR时间的延长而逐渐提升,并且120 ℃下反应6 h产生的MRPs还原力是对应100 ℃的2.16倍;NOOSHKAM等[20]研究壳聚糖与菊粉发生MR后其对应的MRPs的还原力大小,结果表明褐变程度越大的产物表现出越强的还原力,这也证明了还原力大小与类黑精的含量有密切关联。综上表明,超高压处理组的还原力更高,原因可能是产生了更多的游离氨基酸,并且MR能显著提升其还原力。

图3 美拉德反应后酶解液的还原力活性Fig.3 Reducing power of enzymatic hydrolysate after Maillard reaction
2.4 Fe2+螯合活性分析
有研究表明,Fe2+、Cu2+等金属离子对人体中部分酶的活性有所影响,而MRPs能与之螯合形成稳定的螯合物,减少自由基链式反应的进行,表现出一定的抗氧化作用。如图4所示,各组对Fe2+均有一定的螯合能力,但整体螯合能力较弱,其中BC 组的螯合能力最低(F1BC:21.01% vs F2BC:19.59%),其对应的热反应产物的螯合能力有所增强,而MR反应后,对应的MRPs的Fe2+螯合活性(MRPF1:33.56% vs MRPF2:30.09%)显著提升(P<0.05),超高压处理组比常压处理组螯合能力更强。杜椅楠等研究发现分子量<1 kDa的刺参肠MRPs的Fe2+螯合活性最强,达到了20.5%左右;卢彬研究发现,在120 ℃条件下,随着反应时间的延长,其对应的MRPs的Fe2+螯合活性显著降低,当加热6 h后其Fe2+螯合力相比酶解液减少67.37%;GU等[21]研究表明随着MRPs浓度的增加,螯合活性增加(0.5 mg/mL:31.24%,2.0 mg/mL:93.87%),并且高分子量组分表现出较高的金属螯合能力,而低分子量组分则没有活性。
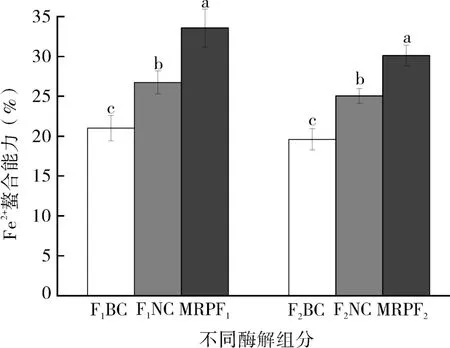
图4 美拉德反应后酶解液的Fe2+螯合活性Fig.4 Fe2+ chelating activity of enzymatic hydrolysate after Maillard reactio
2.5 羟自由基清除活性分析
如图5所示,各组样品对羟自由基均有良好的清除效果,空白对照组、阴性对照组及MRPs各组差异显著(P<0.05),其中空白组的清除效果最 低(F1BC:77.14% vs F2BC:74.61%),阴性对照组产物清除效果稍高(F1NC:80.88% vs F2NC:79.39%),而 MRPs组则最高(MRPF1:85.72% vs MRPF2:83.80%)。
上述结果表明酶解液自身就有较高的羟自由基清除活性,加热对酶解液的羟自由基清除活性也有显著的提升,其中MR对其提升最为显著,超高压处理对其也有一定的增强。ZENG等研究发现MR后花生粕酶解液的羟自由基清除活性显著增强,并且随着MRPs的浓度增大而逐渐增强,当浓度为0.5 mg/mL时,MR前后酶解液对羟基自由基的清除能力基本相同,然而,在浓度为6 mg/mL时,差距增加到15%;卢彬研究发现不同水解度的酶解液的羟自由基清除率不同,呈先增加后减少的趋势,DH=10.8%的酶解液在浓度为3.5 mg/mL清除羟自由能力最强,并且其MRPs的清除活性随着反应时间的延长逐渐降低。
3 结语
蓝蛤常压和超高压酶解液经美拉德反应后,DPPH自由基清除活性、ABTS自由基清除活性、还原力、Fe2+螯合活性和羟自由基清除活性显著提升(P<0.05),且超高压酶解液美拉德反应产物(MRPF1)的抗氧化能力均优于常压的MRPF2。热反应产物与酶解液相比,除DPPH自由基清除活性、还原力外,抗氧化指标间均有显著差异(P<0.05)。综上所述,蓝蛤酶解液经MR后可以显著提高抗氧化性,进一步说明蓝蛤酶解液的MRPs可以作为一种良好的抗氧化剂使用。
