廉价高效氧化硅基CO2吸附剂的制备及性能研究
2022-01-17缪杭锦钟雯诗胡庚申
缪杭锦, 钟雯诗, 姜 伟, 胡庚申
廉价高效氧化硅基CO2吸附剂的制备及性能研究
缪杭锦, 钟雯诗, 姜 伟, 胡庚申
(浙江师范大学 先进催化剂材料教育部重点实验室, 浙江 金华 321004)
为了解决“分子篮”固体吸附剂载体成本高的缺点,以廉价SiO2纳米粒子作为吸附剂的载体,通过浸渍法制备了固体吸附剂。通过扫描电镜、透射电镜、物理吸附、热重分析等对吸附剂进行表征。采用穿透曲线法对吸附剂的CO2吸附性能进行了测试。结果表明,粒径小(6 nm)且比表面积高(321 m2×g-1)的SiO2纳米粒子基吸附剂(50PEHA/6SiO2)比高成本的50PEHA/SBA-15吸附剂表现出有更优的CO2吸附能力,这是由于50PEHA/6SiO2具有开放的结构和较低的传质阻力。50PEHA/6SiO2吸附剂也表现出良好的再生性能。50PEHA/6SiO2吸附剂的低成本和优异的CO2捕获能力展现出良好的实际应用前景。
二氧化碳捕获;二氧化硅纳米粒子(SiO2);开放结构;五乙烯六胺(PEHA)
1 前言
近年来大气中CO2浓度呈现出加速增长的趋势{Bui, 2018 #301},2013年CO2浓度约为400 cm3×m-3,2019年已达415 cm3×m-3[1-4]。因此,急需发展廉价高效的CO2捕获技术以减少CO2排放对全球气候的影响。“分子篮”固体胺吸附剂与胺溶液吸收剂相比,具有腐蚀性小、再生能耗低的优点,被认为是有效的CO2捕获技术。近年来多种介孔氧化硅(SBA-15[5-8]、KIT-6[9]、MCF[10-15]、MCM-41[9,16]、二氧化硅纳米管[17-18]和HMS[19-20]等)已被用作“分子篮”吸附剂的载体,利用其高表面积和大的孔体积提高有机胺的CO2吸附性能。前期研究结果表明,具有较大孔体积和较大孔径的载体有利于提高固体吸附剂的CO2吸附能力[11-12, 18]。
然而介孔氧化硅的成本较高[21-23],且由于目前未进行大规模生产而产量较低,这些因素极大地限制了“分子篮”基CO2吸附剂的应用和推广。因此急需寻找廉价且具有特殊结构的载体[24-25],以降低固体吸附剂的成本,并提高CO2吸附性能。
工业上大规模生产的二氧化硅(SiO2)纳米粒子俗称白炭黑,被广泛用作橡胶、塑料、涂料、黏合剂和密封材料的添加剂,其成本远低于有序介孔二氧化硅。根据市售价格,SiO2纳米粒子的单价仅为SBA-15的1/3000。因此,以白炭黑作为载体,可以极大地降低“分子篮”固体吸附剂的成本。在本研究中,选择2种具有不同粒径的SiO2纳米粒子作为有机胺载体,通过浸渍法制备固体吸附剂,其表现出优异的CO2吸附能力,甚至远高于SBA-15基固体吸附剂。这可能是由于SiO2纳米粒子基吸附剂具有的开放结构有利于减少CO2与有机胺反应的传质阻力,从而提高了固体吸附剂的CO2吸附性能。
2 实验部分
2.1 主要试剂
五乙烯六胺(PEHA)和SBA-15分别由成都科龙化工公司和先丰科技公司提供,2种不同粒径(6和30 nm)的二氧化硅纳米粒子(SiO2)由杭州万晶公司提供,分别命名为6SiO2和30SiO2。
2.2 吸附剂的制备及表征
固体吸附剂通过浸渍法制备。将一定量的PEHA溶解在甲醇中,其后加入载体,搅拌后超声30 min,然后在蒸发皿中炒干。得到固体吸附剂命名为PEHA/SiO2,代表PEHA的理论负载量,代表二氧化硅粒子的平均尺寸。例如,50PEHA/6SiO2表示PEHA负载在粒径为6 nm的SiO2纳米粒子上且理论负载质量为50%。为了比较吸附性能,也通过浸渍法制备了50PEHA/SBA-15吸附剂。
通过扫描电子显微镜(S4800)、透射电子显微镜(JEOL-2100F)、物理吸附仪(Autosorb-1)、红外光谱(iS-50)以及热重分析仪(STA 449C)对吸附剂进行表征。
2.3 吸附性能测试
使用固定床反应器通过穿透曲线法测试吸附剂的CO2吸附性能[11-12, 18]。使用在线质谱仪(Oic-20)检测反应器出口处的CO2含量。选取50PEHA/6SiO2考察循环使用性能,样品首先在N2(20 mL×min-1)中100 ℃预处理1 h,降温至75 ℃,通入CO2体积分数为10%的CO2/N2混合气体 (10 mL×min-1)直至吸附饱和,然后在100 ℃下N2(20 mL×min-1)脱附1 h使得吸附剂再生,重复以上吸附-脱附过程10次。
3 结果与讨论
3.1 固体吸附剂的表征
图1(a)和1(b)分别为6SiO2和50PEHA/6SiO2的扫描电镜(SEM)图,可以看到SiO2粒子非常小,粒子之间有大量的缝隙(即堆积孔),且50PEHA/6SiO2仍然呈现出“干”的状态。图1(c)和1(d)分别为6SiO2和SBA-15的透射电镜(TEM)图。6SiO2载体的粒径较小(6 nm),粒子间有大量空隙,而SBA-15载体为有序的孔道结构,孔径约7 nm。

图1 6SiO2、50PEHA/6SiO2、SBA-15 SEM与TEM图
图2(a)为6SiO2的N2吸脱附等温线,在相对压力/0为0.78~0.99时均具有H3型回滞环[26],表明6SiO2可能具有大量大孔或堆积孔结构[27-28]。图1(c)的TEM图表明6SiO2的粒径非常小,不能存在大孔结构,因此回滞环归因于SiO2纳米粒子之间的堆积孔。如表1所示,6SiO2和30SiO2的孔体积为1.00和0.57 cm3×g-1,这与介孔氧化硅SBA-15明显不同,SBA-15的孔体积主要归因于内部孔。图2(a)还给出了50PEHA/6SiO2和50PEHA/30SiO2的N2吸脱附等温线。50PEHA/6SiO2的N2吸附量远低于6SiO2,表明堆积孔的孔体积显著减小,这是由于PEHA分子在SiO2纳米粒子之间的填充使得堆积孔的孔体积减小。因此,50PEHA/6SiO2的孔体积远小于6SiO2。而50PEHA/30SiO2的N2吸附量也低于50PEHA/6SiO2,表明50PEHA/30SiO2的堆积孔体积低于50PEHA/6SiO2,这是由于30SiO2的堆积孔体积小于6SiO2所引起的。可以看出随着PEHA负载量的增加,复合吸附剂的N2吸附量呈现明显的下降趋势,这表明堆积孔体积随着PEHA负载量的增加而减小。图2(b)是6SiO2、40PEHA/6SiO2、50PEHA/6SiO2、60PEHA/6SiO2和70PEHA/6SiO2的N2吸脱附等温线。可以看出随着PEHA负载量的增加,复合吸附剂的N2吸附量呈现明显的下降趋势,这表明堆积孔体积随着PEHA负载量的增加而减小。

图2 SiO2载体和PEHA/SiO2吸附剂的氮气吸脱附等温线

表1 SiO2和SBA-15负载PEHA前后的结构性质及CO2吸附能力
athe surface area was calculated using the BET method,/0=0.05-0.3.
bpore volume,0=0.99.
cin the presence of moisture.
如表1所示,6SiO2、40PEHA/6SiO2、50PEHA/6SiO2、60PEHA/6SiO2和70PEHA/6SiO2的堆积孔体积pore分别为1.00、0.14、0.11、0.04和0.01 cm3×g-1。PEHA改性前后的6SiO2和30SiO2的比表面积BET分别为321和130 m2×g-1,6SiO2的比表面积远大于30SiO2的比表面积。而负载PEHA后,复合吸附剂的比表面积均明显下降。这是由于液体PEHA的比表面积可以忽略不计,因此负载PEHA后,吸附剂的比表面积急剧减小。6SiO2、40PEHA/6SiO2、50PEHA/6SiO2、60PEHA/6SiO2和70PEHA/6SiO2的比表面积分别为321、46、25、15和4 m2×g-1。这表明随着PEHA负载量的增加,在6SiO2上形成的PEHA膜会更厚,比表面积会更小。50PEHA/6SiO2和50PEHA/30SiO2的比表面积分别为25和7 m2×g-1,表明大比表面积载体负载PEHA后,仍然有较大的比表面积。
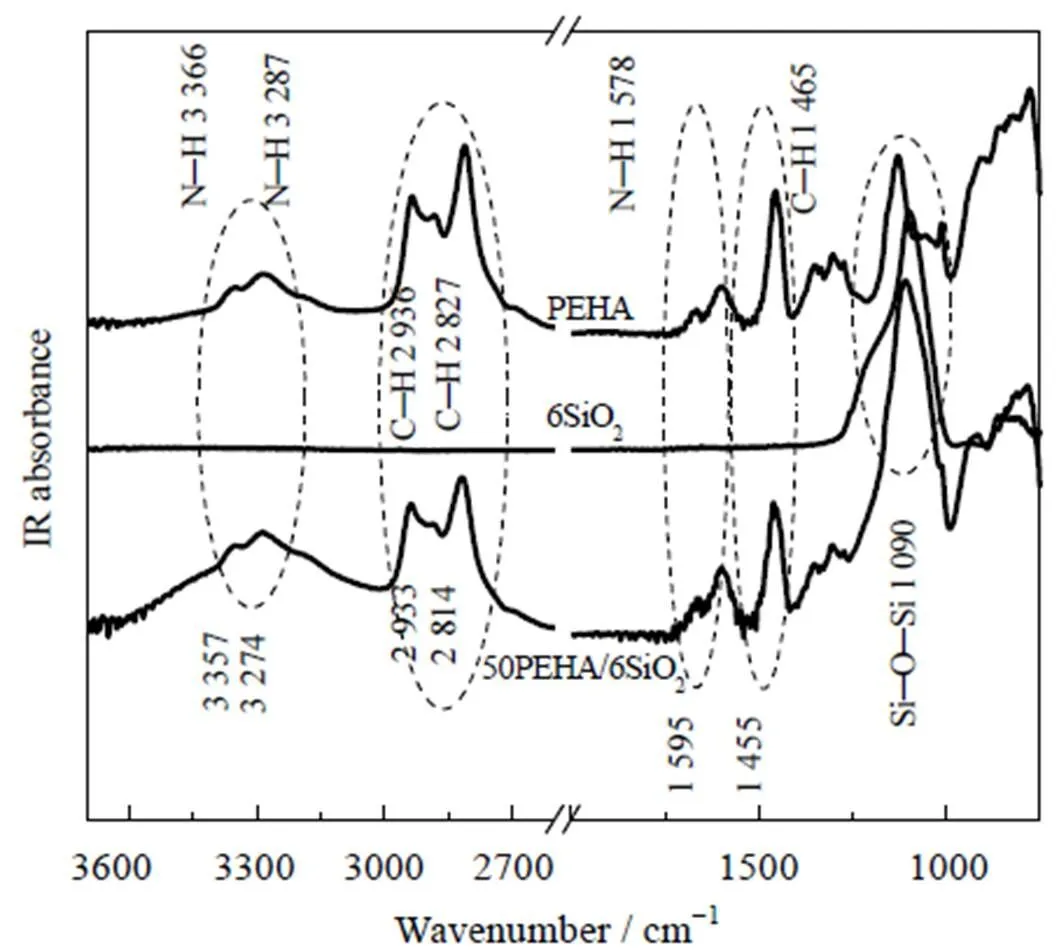
图3 6SiO2,PEHA和50PEHA/6SiO2的红外光谱
图3为6SiO2、PEHA和50PEHA/6SiO2的红外光谱。在PEHA的红外光谱中,可以观察到与N─H,C─H和C─N相关的伸缩振动和变形振动模式。3 357和3 274 cm-1处的峰归因于N─H伸缩振动,1 595 cm-1处的峰归因于N─H弯曲振动,2 933和2 814 cm-1处的峰与C─H伸缩振动相关,1 455 cm-1处的峰值归属为C─H弯曲振动。而载体6SiO2仅在1 090 cm-1处观察到一个归属为Si─O─Si 伸缩振动的强峰。复合吸附剂50PEHA/6SiO2的红外峰明显多于6SiO2的红外峰,表明PEHA已负载在6SiO2表面。此外,负载于6SiO2表面PEHA的红外峰相对纯PEHA的红外峰有一定的蓝移或红移。如N─H 对称伸缩振动蓝移了11 cm-1,而N─H变形振动红移了17 cm-1。这表明PEHA分子与6SiO2表面发生了相互作用,PEHA分子的延展性发生了一定程度的变化。
在本研究中,通过浸渍法将PEHA分子负载在SiO2载体表面,由于在制备过程中的损失,PEHA的实际负载量可能与理论负载量有所差别。本研究通过热分析法测量实际负载量。图4为6SiO2和50PEHA/6SiO2的热重(TG)曲线。6SiO2纳米粒子从室温到600 ℃没有明显的重量损失,表明其较为稳定。50PEHA/6SiO2有2个明显的失重过程。第1个失重过程在室温到125 ℃,失重量约为总重量的11.0%,这归因于吸附剂在空气中吸附的水。第2个失重过程在220到500 ℃,这是由于PEHA在较高温度下的挥发引起的,失重量约为总重量的48.1%,表明PEHA的实际负载量约为48.1%,非常接近50% 的理论负载量。
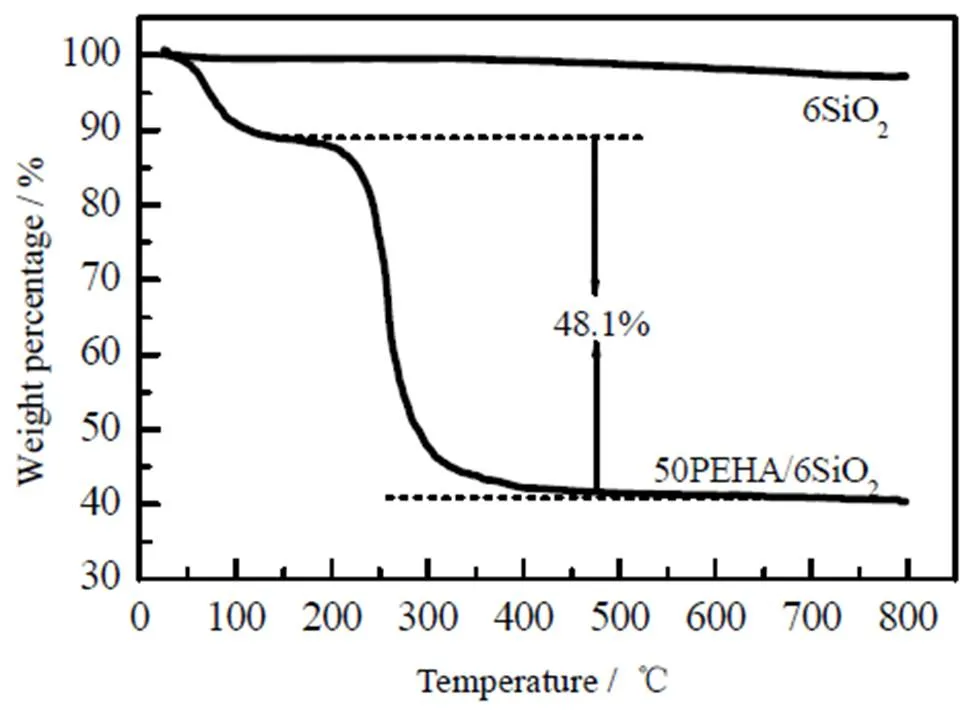
图4 6SiO2和50PEHA/6SiO2热重曲线

图5 吸附温度对CO2吸附性能的影响
3.2 固体吸附剂的CO2吸附性能
图5为30、50、75和90 ℃时50PEHA/6SiO2的CO2穿透曲线。图中/为质荷比,为固定床反应器出口CO2浓度,o为固定床反应器入口CO2浓度。随着吸附温度的升高,CO2穿透点(即质谱仪在固定床反应器的出口处检测到CO2信号)时间先增加后减少。30、50、75和90 ℃时的CO2穿透点时间分别为18.4、20.4、24.5和22.7 min。从图5中可以推断,吸附剂在穿透点之前的CO2吸附量对总的CO2吸附量的贡献最大。因此从穿透点时间即可判断出50PEHA/6SiO2在75 ℃时表现出最佳的CO2吸附性能,故在后续实验中吸附温度均设置为75 ℃。
图6(a)为6SiO2、PEHA以及不同PEHA负载量的PEHA/6SiO2吸附剂的CO2穿透曲线。6SiO2的穿透点仅有1.4 min,这表明SiO2纳米粒子只能吸附极少量的CO2。如表1所示,6SiO2的CO2吸附量仅为0.25 mmol×g-1,这是由于6SiO2的中性表面缺少捕获CO2分子的碱性基团。而纯有机胺PEHA的CO2穿透点也仅为3.1 min,这表明液态PEHA对CO2的吸附也非常有限。根据PEHA分子结构,PEHA的CO2理论最大吸附量为12.93 mmol×g-1,但是其实际CO2吸附量仅为0.89 mmol×g-1。尽管6SiO2和PEHA都表现出较低的CO2吸附性能,但PEHA/6SiO2复合吸附剂却表现出优异的CO2吸附性能。如表1所示,SiO2和PEHA的CO2吸附量分别仅为0.25和0.89 mmol×g-1,而40PEHA/6SiO2、50PEHA/6SiO2、60PEHA/6SiO2和70PEHA/6SiO2的CO2吸附量分别为3.57、4.31、4.56和3.54 mmol×g-1,因此通过将PEHA负载在SiO2载体上可以显著提高PEHA的CO2吸附性能。如图6(b)所示,30SiO2基复合吸附剂的CO2吸附性能也随着PEHA负载量的增加先增加后减少,40PEHA/30SiO2、50PEHA/30SiO2、60PEHA/30SiO2和70PEHA/30SiO2,穿透点分别为6.6、12.5、9.1和5.9 min,总的CO2吸附量分别为2.53、3.08、2.94和2.78 mmol×g-1,明显低于6SiO2基固体吸附剂的吸附量。SBA-15是最早用于固体胺吸附剂的载体之一,SBA-15具有有序孔道以及比6SiO2更大的表面积(578 m2×g-1)。

图6 6SiO2穿透曲线和30SiO2穿透曲线
图7对比了50PEHA/6SiO2、50PEHA/30SiO2和50PEHA/SBA-15的CO2穿透曲线,穿透点分别是24.5、12.5和16.8 min。这表明50PEHA/6SiO2和捕获性能优于50PEHA/SBA-15,而50PEHA/30SiO2的性能却低于50PEHA/SBA-15。众周所知,穿透期间的穿透曲线斜率可以反映传质阻力的大小,较大的斜率表示较低的传质阻力,而较小的斜率表示较大的传质阻力。PEHA膜越厚,传质阻力将越大。因为6SiO2的比表面积远大于30SiO2,6SiO2载体上的PEHA膜较薄,因此50PEHA/6SiO2的CO2吸附性能明显优于50PEHA/30SiO2。

图7 50PEHA/6SiO2、50PEHA/30SiO2和50PEHA/SBA-15吸附剂穿透曲线
6SiO2的表面积(321 m2×g-1)虽然低于SBA-15的表面积(578 m2×g-1),但50PEHA/6SiO2仍然表现出比50PEHA/SBA-15低的传质阻力和较优的CO2吸附性能,这是由于50PEHA/6SiO2具有开放结构(图1(a)~(c)),CO2可以从各个方向与载体表面的PEHA进行充分反应。如图1(d)所示,50PEHA/SBA-15具有有序介孔结构,CO2只能从孔道的两端进入已填充PEHA的孔道,因而具有较大的传质阻力和较低的CO2吸附性能。

图8 水汽对50PEHA/6SiO2吸附CO2性能的影响
图8为水汽(体积分数约为4.0%)对固体吸附剂CO2吸附性能的影响。在干燥气氛中,50PEHA/6SiO2的CO2穿透点为24.5 min,其CO2吸附量为4.31 mmol×g-1,─NH2与CO2以2:1的量比进行反应。在潮湿气氛中,CO2穿透点延长至31.0 min,CO2吸附提高至5.11 mmol×g-1,吸附性能提高了18.6%。这是由于在水汽存在的情况下,H2O分子也参与反应过程,─NH2可与CO2以1:1的量比进行反应。因此,由于H2O分子也参与了反应过程,大大提高了吸附剂的吸附性能。

图9 50PEHA/6SiO2吸附剂循环实验
图9为50PEHA/6SiO2吸附剂循环使用10次的CO2吸附性能。在第1次使用时50PEHA/6SiO2的CO2吸附量为4.31 mmol×g-1。经过10次吸附-脱附循环后,CO2吸附量为4.12 mmol×g-1,保持率为95.6%,这表明50PEHA/6SiO2吸附剂具有优异的稳定性。图4中的TG曲线表明50PEHA/6SiO2在220 ℃以下比较稳定,而吸附剂的再生温度仅为100 ℃,因此50PEHA/6SiO2具有优异的循环稳定性。
4 结论
以廉价的SiO2纳米粒子作为有机胺的载体,通过浸渍法制备了廉价高效的氧化硅基固体吸附剂。通过穿透曲线法对吸附剂的CO2吸附性能进行了测试。研究结果表明,SiO2纳米粒子载体的粒径和表面积大小对吸附剂的CO2吸附性能有重要影响,小的粒径和大的比表面积有利于提高吸附剂CO2吸附性能。其中50PEHA/6SiO2和60PEHA/6SiO2的CO2吸附量分别达到4.31和4.56 mmol×g-1,远高于高成本的50PEHA/SBA-15吸附剂的3.16 mmol×g-1。与50PEHA/SBA-15吸附剂相比,50PEHA/6SiO2具有开放结构,CO2分子可以充分与PEHA发生反应,从而提高吸附剂的CO2吸附性能。此外,50PEHA/6SiO2吸附剂也表现出良好的循环稳定性。
[1] WANG L, YAO M, HU X,. Amine-modified ordered mesoporous silica: The effect of pore size on CO2capture performance [J]. Applied Surface Science, 2015, 324(1): 286-292.
[2] XU X, SONG C, ANDRESEN J M,. Novel polyethylenimine-modified mesoporous molecular sieve of MCM-41 type as high-capacity adsorbent for CO2capture [J]. Energy & Fuels, 2002, 16(6): 1463-1469.
[3] MA X, WANG X, SONG C. "Molecular Basket" sorbents for separation of CO2and H2S from various gas streams [J]. Journal of the American Chemical Society, 2009, 131(16): 5777-5783.
[4] ZHANG R, WANG X, LIU S,. Discovering inherent characteristics of polyethylenimine-functionalized porous materials for CO2capture [J]. ACS Applied Materials & Interfaces, 2019, 11(40): 36515-36524.
[5] SANZ R, CALLEJA G, ARENCIBIA A,. CO2adsorption on branched polyethyleneimine-impregnated mesoporous silica SBA-15 [J]. Applied Surface Science, 2010, 256(17): 5323-5328.
[6] YAN X L, ZHANG L, ZHANG Y,. Amine-modified SBA-15: Effect of pore structure on the performance for CO2capture [J]. Industrial & Engineering Chemistry Research, 2011, 50(6): 3220-3226.
[7] YUE M B, SUN L B, CAO Y,. Promoting the CO2adsorption in the amine-containing SBA-15 by hydroxyl group [J]. Microporous and Mesoporous Materials, 2008, 114(1/2/3): 74-81.
[8] ZHENG F, TRAN D N, BUSCHE B J,. Ethylenediamine-modified SBA-15 as regenerable CO2sorbent [J]. Industrial & Engineering Chemistry Research, 2005, 44(9): 3099-3105.
[9] SON W J, CHOI J S, AHN W S. Adsorptive removal of carbon dioxide using polyethyleneimine-loaded mesoporous silica materials [J]. Microporous and Mesoporous Materials, 2008, 113(1/2/3): 31-40.
[10] SUBAGYONO D J N, LIANG Z, KNOWLES G P,. Amine modified mesocellular siliceous foam (MCF) as a sorbent for CO2[J]. Chemical Engineering Research and Design, 2011, 89(9): 1647-1657.
[11] YAO M, DONG Y, FENG X,. The effect of post-processing conditions on aminosilane functionalizaiton of mesocellular silica foam for post-combustion CO2capture [J]. Fuel, 2014, 123(1): 66-72.
[12] FENG X, HU G, HU X,. Tetraethylenepentamine-modified siliceous mesocellular foam (MCF) for CO2capture [J]. Industrial & Engineering Chemistry Research, 2013, 52(11): 4221-4228.
[13] ZHAO J Q, SIMEON F, WANG Y J,. Polyethylenimine-impregnated siliceous mesocellular foam particles as high capacity CO2adsorbents [J]. RSC Advances, 2012, 2(16): 6509-6519.
[14] QI G, FU L, CHOI B H,. Efficient CO2sorbents based on silica foam with ultra-large mesopores [J]. Energy & Environmental Science, 2012, 5(6): 7368-7375.
[15] YAN X, ZHANG L, ZHANG Y,. Amine-modified mesocellular silica foams for CO2capture [J]. Chemical Engineering Journal, 2011, 168(2): 918-924.
[16] BELMABKHOUT Y, SERNA-GUERRERO R, SAYARI A. Adsorption of CO2-containing gas mixtures over amine-bearing pore-expanded MCM-41 silica: Application for gas purification [J]. Industrial & Engineering Chemistry Research, 2010, 49(1): 359-365.
[17] LIU L, CHEN J, TAO L,. Aminopolymer confined in ethane-silica nanotubes for CO2capture from ambient air [J]. ChemNanoMat, 2020, 6(7): 1096-1103.
[18] YAO M, DONG Y, HU X,. Tetraethylenepentamine-modified silica nanotubes for low-temperature CO2capture [J]. Energy & Fuels, 2013, 27(12): 7673-7680.
[19] KNOWLES G P, DELANEY S W, CHAFFEE A L. Diethylenetriamine[propyl(silyl)]-functionalized (DT) mesoporous silicas as CO2adsorbents [J]. Industrial & Engineering Chemistry Research, 2006, 45(8): 2626-2633.
[20] KNOWLES G P, GRAHAM J V, DELANEY S W,. Aminopropyl-functionalized mesoporous silicas as CO2adsorbents [J]. Fuel Processing Technology, 2005, 86(14/15): 1435-1448.
[21] JIANG K, FERON P, COUSINS A,. Achieving zero/negative-emissions coal-fired power plants using amine-based postcombustion CO2capture technology and biomass cocombustion [J]. Environmental Science & Technology, 2020, 54(4): 2429-2438.
[22] BAKER R W, FREEMAN B, KNIEP J,. CO2capture from cement plants and steel mills using membranes [J]. Industrial & Engineering Chemistry Research, 2018, 57(47): 15963-15970.
[23] KIM Y H, KIM J J, LEE C H. Adsorptive cyclic purification process for CO2mixtures captured from coal power plants [J]. AIChE Journal, 2017, 63(3): 1051-1063.
[24] CHANG J, HOU C, WAN D,. Enhanced CO2adsorption capacity of bi-amine co-tethered flue gas desulfurization gypsum with water of hydration [J]. Journal of CO2Utilization, 2020, 35: 115-125.
[25] HOSSAIN M M, I. DE LASA H. Chemical-looping combustion (CLC) for inherent CO2separations-A review [J]. Chemical Engineering Science, 2008, 63(18): 4433-4451.
[26] YANG S, LIN X, LEWIS W,. A partially interpenetrated metal-organic framework for selective hysteretic sorption of carbon dioxide [J]. Nature Materials, 2012, 11(8): 710-716.
[27] YANG Z Z, HE L N, GAO J,. Carbon dioxide utilization with C-N bond formation: carbon dioxide capture and subsequent conversion [J]. Energy & Environmental Science, 2012, 5(5): 6602-6639.
[28] WANG Q, LUO J, ZHONG Z,. CO2capture by solid adsorbents and their applications: Current status and new trends [J]. Energy & Environmental Science, 2011, 4(1): 42-55.
Preparation and properties of cheap-efficient silica based CO2sorbents
MIAO Hang-jin, ZHONG Wen-shi, JIANG Wei, HU Geng-shen
(Key Laboratory of the Ministry of Education for Advanced Catalysis Materials, Zhejiang Normal University, Jinhua 321004, China)
In order to overcome high costs of supports for "molecular basket" solid sorbents, cheap SiO2nanoparticles were used as the support to prepare solid sorbents through wet-impregnation. The sorbents were characterized by scanning electron microscopy, transmission electron microscopy, physical adsorption and thermogravimetric analysis. CO2sorption performance was tested using breakthrough curves. The results show that the sorbent (50PEHA/6SiO2) based on the SiO2nanoparticles with smaller size (6 nm) and higher surface area (321 m2·g-1) shows better CO2adsorption capacity than the expensive 50PEHA/SBA-15 sorbent, which is due to the open structure and lower mass transfer resistance of 50PEHA/6SiO2. 50PEHA/6SiO2also showed good regeneration performance. 50PEHA/6SiO2sorbents show good practical application prospects due to low cost and excellent CO2capture capability.
CO2capture; SiO2nanoparticles; open structure; pentaethylenehexamine(PEHA)
1003-9015(2021)06-0994-07
O 647.32
A
10.3969/j.issn.1003-9015.2021.06.006
2020-11-11;
2021-01-12;
浙江省自然科学基金(LY21G010005);国家自然科学基金(21203167);浙江师范大学实验技术开发项目(SJ202111)。
缪杭锦(1995-),男,浙江衢州人,浙江师范大学硕士生。
胡庚申,E-mail:gshu@zjnu.edu.cn
