胺法碳捕集胺的降解与抑制方式的研究进展
2022-01-17雷轩邈朱先会袁金良
雷轩邈, 王 甫, 朱先会, 袁金良
胺法碳捕集胺的降解与抑制方式的研究进展
雷轩邈, 王 甫, 朱先会, 袁金良
(宁波大学 海运学院, 浙江 宁波 315000)
以胺为吸收剂的碳捕集作为一种最接近商业化的CO2脱除技术,在捕集电厂烟气CO2方面有着广阔的市场前景。但胺易发生降解的固有缺陷,已成为制约推广应用的主要瓶颈之一。基于此,首先分析了胺的降解机理、降解影响因素及降解产物的形成路径。重点回顾了烟气中杂质组分以及吸收剂中的金属离子对氧化降解的作用机理和影响效果,影响热降解速率的因素及其作用效果,阐述了降低胺降解的方法和策略。最后对胺在碳捕集技术中的应用前景进行了展望,指出从物理、化学和热力学性质、降解机制等方面对胺进行研究,确定多边环境协同作用下胺降解的产物及其形成机制是未来研究的重点。
二氧化碳捕集;化学吸收剂;胺;氧化降解;热降解;抑制方法
1 前言
进入新世纪以来,CO2的过量排放所引起的气候变化异常已成为困扰人类生存与发展的全球性环境问题,削减CO2排放已成为世界各国共同的议题。CO2捕集与封存(CCS)是世界各国应对全球气候变化的重要技术选择之一。我国作为一个以煤为主要能源的国家,CO2排放的45% 左右来自燃煤电厂[1],电厂烟气中二氧化碳的减排已刻不容缓。
燃烧后化学吸收法作为一种最接近商业化的CO2脱除技术,在捕集电厂烟气CO2方面,有着广阔的市场前景,其中以胺为吸收剂的吸收法在美国、欧洲等地已开展示范和小规模应用,优点是气体吸收速率快、脱除效果好、化学稳定性好[2]。与其他技术相比,胺吸收法在体积流量大、二氧化碳浓度低的电厂烟气方面表现出了良好的效果,被视为电厂碳捕集最可行的方法[3]。
然而,由于烟气中含有氧气和其他杂质气体(SO和NO等),在吸收过程中胺类吸收剂易于与氧气和其他杂质气体发生氧化反应,生成热稳定性盐,造成吸收剂的损失;同时,胺类吸收剂热稳定性较差,在一定的温度条件下(尤其是解吸过程)易发生热降解。中试试验中一乙醇胺(MEA)的损失量达到了每吨CO2损失MEA 1.4 kg,有的甚至更高[4]。胺类吸收剂的这些固有缺陷,严重阻碍了在碳捕集应用中的进程。胺的降解将导致溶液浓度降低,影响后续吸收效果,并且胺的降解产物具有腐蚀性[5],影响反应器的使用寿命。因此,研究胺在碳捕集过程中的降解对于碳捕集工艺的改进以及降低捕集成本至关重要。近年来,包括清华大学、里贾纳大学、德克萨斯大学、挪威科技大学等国内外研究机构在理论分析与实验室条件下研究了胺吸收剂降解的反应机理、影响因素、降解速率以及抑制降解的方法等,为胺法碳捕集技术的操作参数选择及运行控制提供了非常有效的措施[6-10]。因此,本文综述了胺法CO2捕集过程中胺的降解研究进展及抑制措施的应用情况。
2 胺降解的形成机制
胺的降解方式主要有2种:氧化降解和热降解。另外还有化学催化降解,化学催化降解常常伴随发生在氧化降解和热降解过程中,例如SO和NO在氧化降解中与氧气的协同作用促进或抑制氧化降解,CO2在热降解中的催化作用等[11]。如图1所示描述了碳捕集循环系统中胺的降解方式及发生的位置。

图1 CO2捕集过程胺的降解示意图
2.1 氧化降解机制
氧化降解是指胺与O2在活性基团的作用下发生的氧化还原反应,主要发生在二氧化碳的吸收过程。有机酸是MEA降解的主要产物,有研究者提出了氧化降解过程中有机酸的形成机制。Rooney等[12]的研究表明,MEA氧化降解产生乙烯醇并且释放出氨,另外MEA分子降解形成热稳定盐,如醋酸盐、甲酸盐和草酸盐等。基于反应产物分子结构的表征,Rooney等[12]提出了MEA的降解反应机理,如图2所示。一方面,MEA分子首先分解为氨和乙烯醇,乙烯醇不稳定,会自动生成乙醛,乙醛在氧气作用下进一步反应生成乙酸;另一方面,MEA经过氧化反应生成氨基乙醛,氨基乙醛既可以与水反应生成甲酸和甲胺,又可分解成中间产物氨基乙酸,并进一步生成乙醛酸和草酸。
与此同时,Chi等[13]提出了MEA氧化降解反应的另一种途径,如图3所示,此反应机制称为MEA降解的单电子提取机制。此外,胺的氧化降解还有一种质子提取机制。研究人员能够确定叔胺的氧化降解是以电子提取为主,同时也发现了质子的提取机制。他们测试了一种伯胺,即苄胺,发现降解的胺有73% 是通过从-碳中提取质子来进行的[14-15]。然而在醇胺降解过程中哪一种作用机制占主导还有待进一步研究。

图2 MEA在产酸过程中的降解机制[12]
通过第一性原理、密度泛函以及分子动力学等计算化学手段可以实现对胺降解过程反应路径的预测。Vevelstad等[16]通过测定反应的吉布斯自由能和焓来研究降解的稳定性,以探究MEA的降解机制。已发现具有负吉布斯自由能的氧化降解产物有甲酸、甲醛、甲酰胺、乙酸、乙烯醇、乙醛、甘氨酸、乙醇酸、羟基乙醛、草酸、草酰胺、N-(2-羟乙基)-乙酰胺(HEA)、硝酸、亚硝酸、二甲基乙醇胺(DMEA)、氧化乙烯和氨等。有些降解产物已有文献报道,有些则在MEA的氧化降解实验的产物中被验证[17-20]。

图3 MEA降解的单电子提取机制[13]
2.2 热降解机制
热降解反应主要是吸收了CO2的富胺溶液,在解吸塔、换热器等高温装置中发生的一系列降解反应。目前胺的热降解主要存在2种理论,一是有二氧化碳存在时,主要通过生成氨基甲酸(MEACOOH)发生脱水聚合反应;另一则是无二氧化碳存在时,主要发生脱烷基化作用、二聚作用以及环化作用[7,21-23]。
氨基甲酸酯聚合的MEA热降解机制已被大多数研究者证实。Davis[24]报道了MEA通过氨基甲酸酯聚化降解生成2-噁唑烷酮(OZD)。OZD对亲核反应非常敏感,与另一个MEA分子会进一步反应形成N-(2-羟乙基)乙二胺(HEEDA),而HEEDA与CO2进一步发生反应。通过氨基甲酸酯聚合途径降解形成环状尿素或咪唑酮,环状尿素的形成类似于OZD的形成,它只在二氧化碳存在的情况下发生。在两个一级或二级氨基功能之间有2个或3个碳原子的胺,主要通过Davis[24]报道的路径降解,如图4(a)~(e)所示。Lepaumier等[25]指出在没有CO2的情况下,胺的降解途径如图5所示,主要发生脱烷基化、二聚化和环化反应。
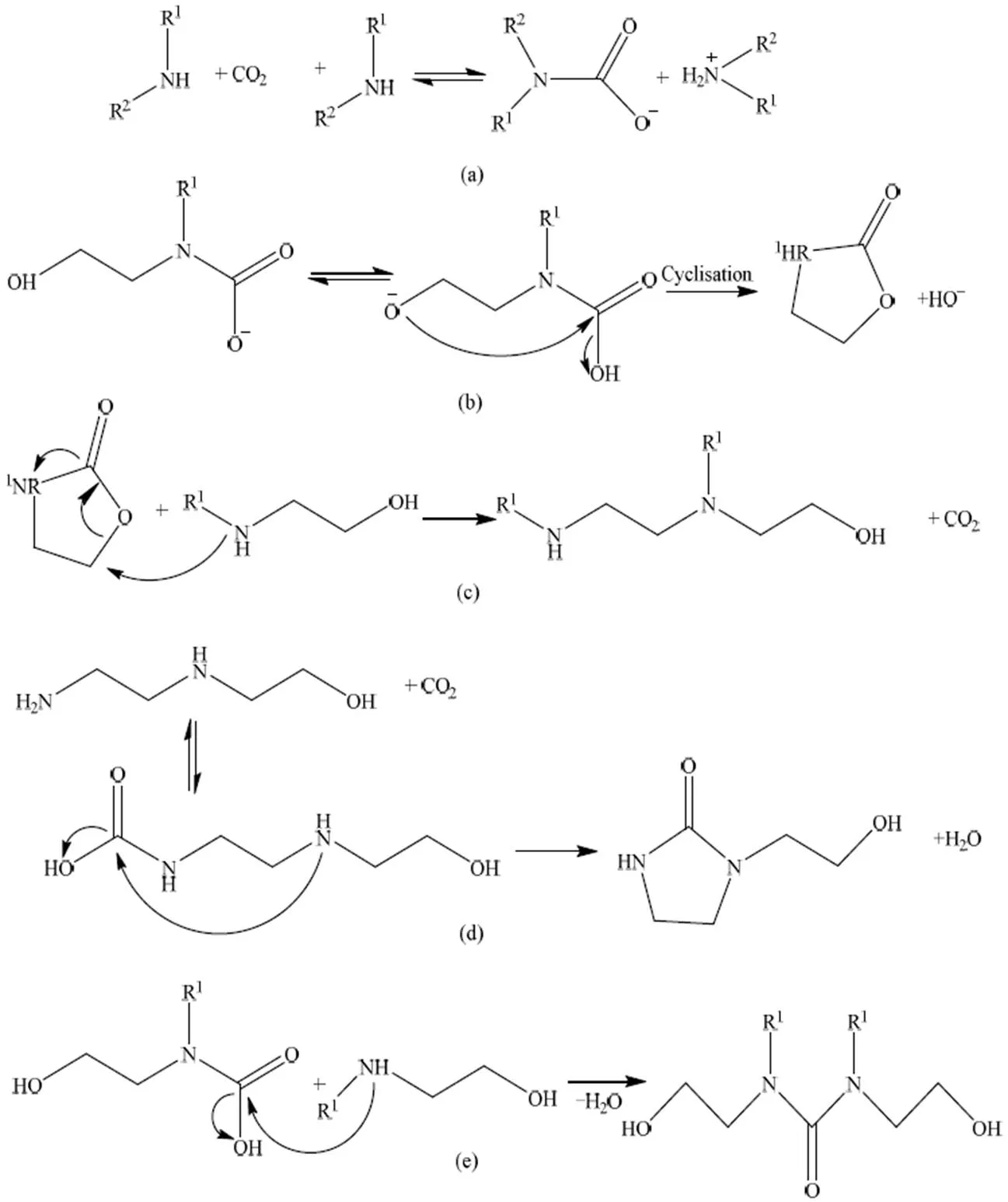
图4 Davis报道的热降解途径[24]

图5 烷基化、二聚化和环化降解途径[25]
在分子动力学层面上,Gupta等[26]通过计算吉布斯自由能和焓等,验证了前述提及的MEA热降解机制,即OZD是MEA在CO2存在下的主要热降解产物,同时还发现CO2的存在对MEA热降解有促进作用。Yoon等[27]提出了基于从头计算的分子动力学模拟,提出了分子机制下的多边环境热降解机制。据预测,MEA通过MEACOOH脱水生成异氰酸酯的可能性非常大,而且比与OZD竞争性的环化-脱水反应更具有动力学势。如图6所示为Yoon等[27]所做的氨基甲酸环化脱水生成OZD的分子动力学模拟研究结果,图中N-H为N原子到H原子之间的距离,C-O为C原子到O原子之间的距离,O-HW为O原子到水分子中H原子之间的距离,D为活化能。

图6 MEA热降解分子动力学模拟[27]
3 胺降解的影响因素与作用效果
电厂烟气成分复杂,含有除CO2以外的其他酸性气体,如SO2、SO3、NO等,同时还含有Hg、Cl等微量杂质。烟气中的SO2、SO3、NO比CO2具有更强的反应活性,与胺发生不可逆的反应,生成热稳定性盐(HSS)[25],造成胺的损失。热降解则主要受温度影响,但单纯的热降解导致的降解率较小,CO2是热降解反应的催化剂,富液中CO2的负载会加快热降解速率。表1列出了胺降解的影响因素。

表1 胺降解影响因素
3.1 氧浓度对氧化降解的影响
烟气中的氧浓度对MEA氧化降解具有直接的影响。有学者根据实验数据提出了氧气浓度对MEA降解速率影响的数学表达式[28],以评估O2浓度和温度对胺降解的影响。式(1)可以预测MEA-O2系统的降解速率,模型假设MEA和CO2在体系中过量存在,其对降解动力学的影响与它们的浓度无关。

Supap等[29]在式(1)模型基础上加入了MEA的浓度,提出了式(2)所示的MEA降解速率模型,可以更好地阐述各影响因素对MEA降解的影响以及影响程度。

式中:MEA为MEA的降解速率(mol×m-3×h-1);为通用气体常数(8.314 J×mol-1×K-1);为热力学温度(K);(MEA)、(O2)分别为MEA和O2的浓度(mol×m-3);ln0=12.428±4.899,活化能a=7 972±1 521,=1.05±0.18,=1.51±1.27。
NH3是MEA氧化降解的典型产物,研究表明NH3的排放与烟气中O2浓度正相关。Goff等[30]指出MEA降解的形成是溶解的O2与MEA反应所致,即MEA的氧化降解速率既依赖于从烟道气体到吸收溶液的O2传质速率,也依赖于O2与胺相互作用的动力学速率。为了将各种降解产物的形成速率与O2吸附速率联系起来,George等建立了NH3生成速率与O2的吸附速率的关系式,如式(3)所示。该研究还表明NH3的排放速率受MEA浓度的控制,当(MEA)>7 mol×L-1时,速率是O2传质控制;当(MEA)<2 mol×L-1时,溶液是动力学控制;当2 mol×L-1≤(MEA)≤7 mol×L-1同时表现出动力学和O2传质的影响。

3.2 烟气中酸性气体组分对胺降解的影响
由于SO2、NO等酸性气体组分与CO2相比具有更低的解离常数(pKa),所以更易与胺发生反应,与CO2形成竞争。当烟气中存在SO2、NO2时,可能发生如下反应:




反应产物HSO3-、SO32-、SO42-、NO3-均可与胺类吸收剂发生反应并生成HSS,包括甲酸盐、醋酸盐、羟乙酸盐、草酸盐、硫酸盐、硝酸盐等。HSS的存在降低了系统的碳捕集能力,同时还会引起腐蚀。表2列出了胺降解过程中的中间产物酸与胺反应生成HSS的反应过程,表中Am表示1个胺分子参与反应。
国内外大量文献从定性分析与定量测定等方面研究了SO2对胺降解的影响。Uyanga等[32]在半连续性高温高压反应釜中研究了SO2和O2对MEA吸收剂降解的影响,发现SO2和O2均会影响MEA的降解。在O2存在的条件下,SO2会加快MEA的降解速率,且SO2浓度越高,降解速率越大。基于实验数据,拟合出了MEA降解速率的数学模型:

表2 胺与酸反应生成HSS[31]


Supap等[17]研究发现在氧气体积分数(O2)=6% 的情况下,(SO2)从6×10-6升高到196×10-6时,MEA的降解率增加了0.9%。高巨宝等[33]的研究则表明,SO2的存在会降低CO2的脱除率,并且随着溶剂内SO2的累积,CO2的脱除率呈现连续下降趋势。在实验工况下,反应430 h后,CO2脱除率下降了27%。
然而,与Uyanga等[32]和高巨宝等[33]的结果相比,有些文献却得出了截然相反的结论。孙晨辰[34]在氧化降解实验中,研究了通入(SO2)=0~150×10-6的SO2对MEA降解的影响,发现通入SO2后,MEA的氧化降解程度有所降低。在引入(SO2)=60×10-6的SO2和不引入SO2的情况下,MEA的存留比分别为87% 和82% 左右,可能是SO2对MEA的降解作用是复杂的,在不同的(SO2)条件下可能会产生不同的影响。Zhou等[35]的实验研究也表明,SO2的存在抑制了MEA的氧化降解。实验中采用液相色谱仪对降解产物进行了测定,发现不含SO2实验的样品有明显的降解产物,而在(SO2)=60×10-6的SO2实验的样品中没有检测到相应降解产物,同时随着(SO2)的增加,样品中降解产物的浓度明显降低。一些研究者报道了亚硫酸盐可以通过清除氧化自由基来抑制MEA的氧化降解[17,36],SO2气体进入溶液后转化为亚硫酸盐和硫酸盐,因此,SO2对MEA降解的影响取决于SO2进入溶液后转化成亚硫酸盐和硫酸盐的比例,定量分析有待研究者进一步明确。周珊等[36]的研究虽然揭示了低浓度SO2会抑制MEA的氧化降解,高浓度SO2则其抑制作用得不到增强,反而有可能会增加溶液中硫酸根离子的浓度,与胺生成热稳定性盐,加速降解,但其中涉及的作用机制以及SO2浓度的阈值还有待明确。
烟气中NO的吸收研究主要集中在对NO2的自由基吸收上。亚硫酸盐、亚硫酸氢盐和硫化物都能直接吸附NO2,胺也会吸收NO,其中叔胺对NO的吸收率最高。在碱性条件下,氮氧化物被吸收到胺溶液中会形成亚硝胺[37]。Challis等[38]认为,在低NO浓度和低胺浓度下,更有可能通过自由基吸收NO2,然后发生NO的胺自由基反应而发生亚硝化,如图7所示。亚硝胺类具有致癌性,被认为是一类危害健康的物质[37],在胺法碳捕集中控制亚硝胺的排放意义重大。
Wang等[40-41]的研究发现新鲜的MEA在高浓度的NO2和O2的协同作用下会生成亚硝胺和硝胺,并且吸收液中溶解的Cu2+会促进亚硝胺和硝胺的形成[32]。当解吸塔温度升高到130 ℃时,硝胺才开始分解。Xiang等[42]的研究指出,NO3-在胺法碳捕集中具有较强的腐蚀性,其存在会大大缩短设备的使用寿命。Rao等[43]则认为SO2对胺法碳捕集的影响大于NO,主要原因是烟气中绝大多数NO以NO的形式存在,而NO对胺的影响目前还未见相关报道。表3总结了酸性气体影响MEA降解的相关研究结果。

图7 生成亚硝胺的反应[38]

表3 酸性气体影响MEA降解研究汇总
3.3 金属离子对氧化降解的影响
胺法碳捕集中金属离子主要来源于吸收剂中添加的腐蚀抑制剂、吸收过程中胺及其中间物质对反应器和管道发生腐蚀的产物,其对胺的降解产生促进或抑制作用。Lee等[44]研究CuCO3、CuSO4和Na2SO3等缓蚀剂对MEA氧化降解的影响,发现CuCO3和CuSO4会促进MEA的氧化降解,而Na2SO3则略微抑制了MEA的氧化降解。通过对降解产物的表征得出,CuCO3和CuSO4影响了羧酸(甲酸、乙酸和草酸)的形成,但不影响氮产物(亚硝酸盐和硝酸盐)的形成。胺降解产物会腐蚀不锈钢,产生大量的Fe2+和Fe3+离子,加剧MEA的降解[45]。Fe2+,Fe3+会通过单电子将胺氧化,生成氨基酸自由基,氨基酸自由基会进一步被另一个铁离子氧化为羟基化合物[42]。Sexton等[46]给出了在不同Fe2+浓度下的影响规律,当吸收液中Fe2+浓度低于0.2 mmol×L-1时,MEA降解速率随Fe2+浓度增加而迅速加快;而当Fe2+浓度超过0.2 mmol×L-1后,MEA降解速率则会受到O2传质的限制,变化较小。李世霞[47]在实验中添加Fe3+溶液后,MEA的降解率增加了一倍多。
Voice等[48]指出锰对MEA氧化降解的催化作用比铜更强。70 ℃条件下,在(MEA)=7 mol×L-1溶液中加入(Cu2+)=1 mol×L-1的添加剂,氧化降解生成氨的速率为6.6 mmol×(kg×h)-1,而在同样的溶液中加入(Mn2+)=0.01 mol×L-1的添加剂,氨的产生速率达到8.6 mmol×(kg×h)-1,如(Mn2+)增至1 mol×L-1,氨产生速率会升高到12.6 mmol×(kg×h)-1。表4列出了金属离子催化MEA氧化降解的研究汇总。

表4 金属离子催化MEA氧化降解研究汇总表
3.4 温度和负载对热降解的影响
根据热降解的机理分析可知,温度是影响热降解的决定性因素,同时CO2负载对热降解也具有促进作用。李世霞[47]在温度为120 ℃、压力为2.0 MPa的条件下进行了质量分数为30% 的MEA水溶液的强制降解实验。经过10 d后,MEA降解率仅为2.3%,说明纯热降解MEA损失很少。孙晨辰[34]使用强制对流烘箱,在有CO2负载、恒温、无氧的条件下考察了MEA的热降解,在120 ℃的恒定温度下,两周后MEA的存留率为91%。Saeed等[49]考察了质量分数为30% 的二乙醇胺(DEA)吸收剂在135 ℃、有/无CO2负载条件下的热降解,采用气相色谱-质谱联用技术(GC-MS)测定了降解产物的浓度。结果表明,在没有溶解CO2的情况下,DEA表现较为稳定,降解率仅为3%;而在每摩尔DEA中含0.5 mol CO2的条件下,DEA变得非常不稳定,4周后降解了9.45%,表明CO2负载极大地促进了DEA的热降解。汪铁林等[50]同样在对2-氨基-2-甲基-1-丙醇(AMP)的热降解研究中指出,在实验条件下,仅仅由温度引起的热降解可以忽略,但CO2能催化AMP热降解,其热降解速率随CO2负载量的提高而加快。Davis等[51]使用不锈钢圆筒,在对流烘箱中,研究了每摩尔MEA中含0.4 mol CO2的富液在120至150℃的温度下MEA热降解情况。结果表明,在120、135和150 ℃下,经过8周的热降解,MEA含量下降了2.5%、10% 和65%。如表5所示为热降解定量研究结果的总结。

表5 热降解研究汇总
Haugmo等[52]测试了MEA、AMP、N-(2-羟乙基)-乙二胺(AEEA)、DMEA、DEA等胺类吸收剂的热稳定性。将这些胺分别在带和不带玻璃管的不锈钢钢瓶、每摩尔胺中含0.5 mol CO2和不含CO2以及135℃的条件下放置5周并测量其热降解速率。结果表明,除了DMEA在不锈钢钢瓶中降解较多外,金属或玻璃对其他胺的热降解影响不大。但是,CO2负载会显著增加所有胺的热降解率,其中DEA、DMEA和AEEA的降解率较高,DEA约有56% 的降解损失。相比较而言,AMP则表现出较好的抗热降解性。此外,实验结果还表明MEA在没有CO2负载下的热降解损失是微不足道的。周珊[36]通过实验在恒温、无氧的条件下对各类胺溶液的热降解进行了对比,得到了热降解速率由高到低排列顺序依次为DEA、MEA、DMEA、PZ与AMP复合型溶液。
4 抑制胺降解及回收处理的措施
为降低氧化降解和热降解产物对胺法碳捕集的影响,胺法碳捕集技术一方面会采用添加抑制剂等方式来降低胺的降解,例如添加钒酸钠[53];另一方面在工艺流程上进行改进,富液在解吸塔内解吸后经泵送入胺液回收处理单元,对胺液进行处理后再进入吸收塔内,以减少新鲜胺液的补充。常用的回收处理方法有中和法、蒸馏法、离子交换树脂、电渗析法等。中和法是利用NaOH、KOH的强碱性将胺液中的H+中和,还原吸收剂,保持吸收剂的捕集能力。蒸馏法通常在汽提塔再沸器中进行,在取料之前提取因中和作用后从HSS中释放的胺,从而达到回收胺的目的。在蒸馏操作条件方面,DEA和DMEA溶液需要在真空条件下进行蒸馏操作,而MEA的蒸馏操作压力可以与解吸塔内压力保持一致。蒸馏法处理回收的成本高、能耗大是它最大的缺陷。离子交换树脂通常用于除去MEA -水混合物中的离子污染物,如氧化形成的有机阴离子或与酸性气体反应形成的硫酸盐和硝酸盐等。然而,它们不能去除不带电的污染物,如那些由热降解产生的污染物。如图8所示,离子交换树脂结构由树脂骨架、活性基团、固定离子、活动离子组成,树脂床由一系列装填有离子交换树脂的柱或塔构成,带有阴阳离子杂质的废胺液由下而上流经树脂床,带正电的金属离子和钠离子等污染物与质子交换,阴离子产物如氯、硫氰酸盐、醋酸、甲酸盐、硫代硫酸盐等与氢氧根离子交换,达到去除带电离子的目的,经过吸附过滤后的溶液从上部排走回收利用,树脂床通过适当的酸或碱周期性的冲洗可再生,循环使用。电渗析最早是一种脱盐技术,后来被用于胺法碳捕集中胺的回收处理,如图9所示,该技术涉及选择性去除带电物质,被污染的胺溶液通过一堆交替带正电荷和负电荷的离子交换膜。电极层夹在两个电极之间,外加的电势驱动离子通过带相反电荷的膜,未带电荷的和较大的乙醇胺被保留,纯化的乙醇胺溶液通过中央通道流出回收。Ludovic等[54]详细综述了这些回收处理方法。

图8 树脂结构和离子交换树脂床原理图

图9 电渗析装置
Fig 9 Schematic diagram of electrodialysis device
减少热降解最有效的方法就是降低再生温度,Mcgurk等[55]提出了微波再生胺技术,并通过实验证明了富胺溶液在微波辐射下低温(70~90 ℃)即可快速再生。对比传统的汽提再生方式,微波再生呈现出一种“非热效应”,大大降低了再生胺的温度,减少了胺的热降解。值得一提的是,微波辐射释放的CO2是传统汽提再生的两倍多,而且释放速度更快。
Shoukat等[56]在研究中发现2-(二乙胺)-乙醇(DEEA)和3-(二乙胺)-1,2-丙二醇(DEM-1,2-PD)在胺-水和胺-水-乙二醇溶液中均表现出较低的腐蚀性和较高的热稳定性。Lai等[57]借助拉曼光谱和傅里叶变换红外光谱等对乙醇(EtOH)在胺类吸收剂中的作用机制进行了探讨。如图10所示,EtOH在EtOH-MEA-H2O中可以通过形成C2H5OCO2-来改变反应路径,降低解吸过程所需的能垒,从而将解吸温度控制得更低,可以有效防止胺的热降解。实验结果表明:EtOH添加剂的加入使得再生温度可降低至70~90 ℃。此外,研究还发现在乙醇胺水溶液中加入一定量的EtOH可以显著提升CO2的解吸速率和循环能力,加入EtOH后解吸速率提高了36倍左右。各种抑制胺降解及回收处理的技术方案的对比见表6。
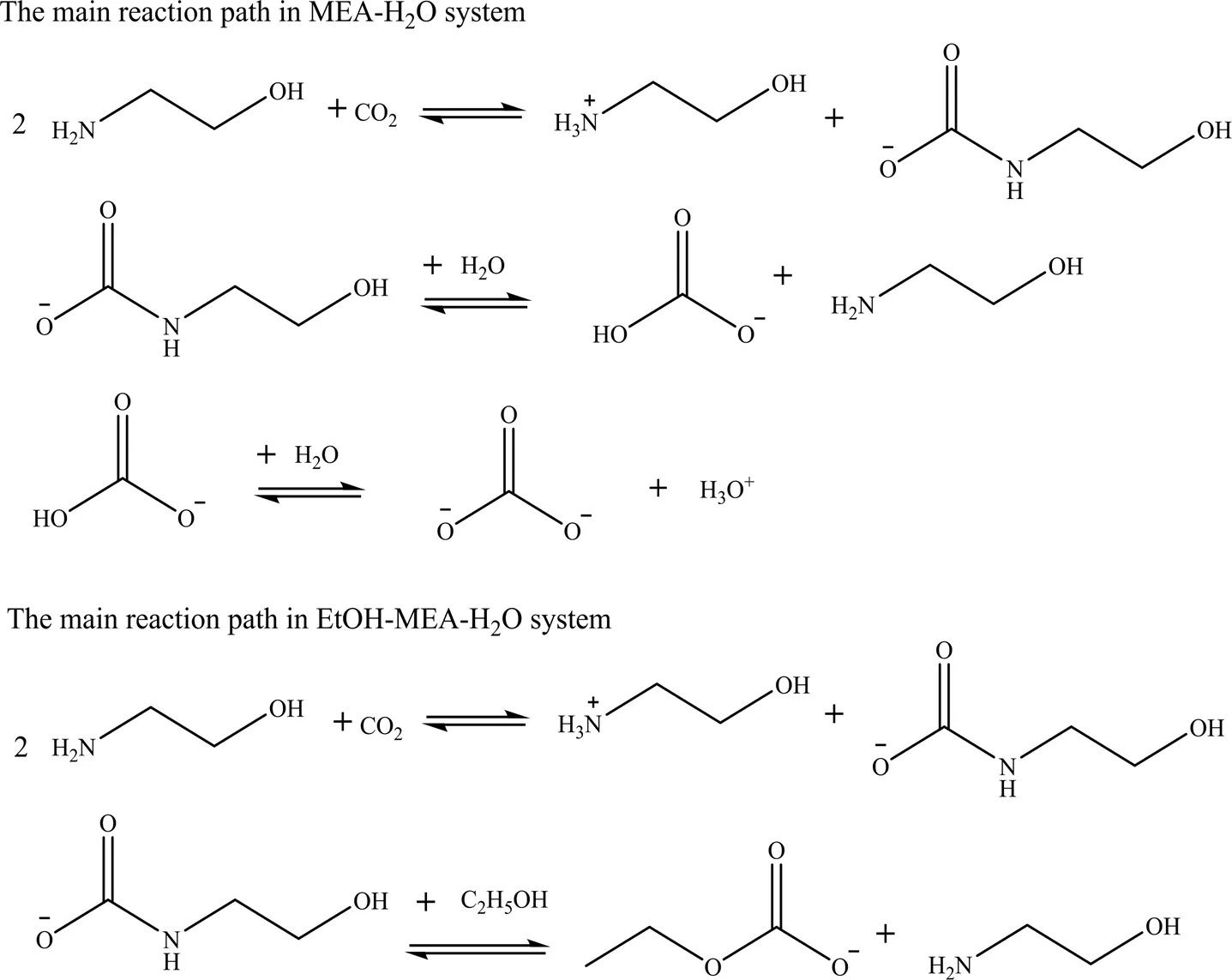
图10 EtOH-MEA-H2O体系与MEA-H2O体系的反应路径对比

表6 技术方案比较
5 结语
在碳中和的背景下,碳捕集技术逐渐成为研究的热点,其中胺法捕碳技术是目前最成熟、最接近商业化的技术,但胺的降解是限制此技术发展的关键因素之一。胺降解不仅增加碳捕集成本,降解产物也带来了二次污染,增加了对工艺设备的腐蚀,造成积垢,最终使工艺效率低下。
目前对胺降解的研究有了很大的进展,但仍存在一些有待解决的问题和挑战:胺降解的机理比较复杂,单一因素影响的降解机理还未完全统一,多种因素的共同作用机理还有待进一步研究;虽然有一些降解产物已经被测定,但降解产物多种多样,测量分析手段较复杂,还需借助先进的测试与表征手段精确地分析与测定降解产物的分子结构与各组分含量;不同降解类型之间存在交叉反应,进一步加速降解,各反应之间存在的竞争反应机制还有待明晰;降解产物对金属具有一定的腐蚀性,对于何种降解起主导作用,系统腐蚀部位的精准把握还需经过长期的运行监测确定;虽然众多胺回收处理方法以及抑制降解措施被提出,但单一方法的效果以及经济性还有待进一步分析与比较。总之,未来迫切需要从物理、化学和热力学性质等方面确定多边环境影响对胺降解产物及其形成机制的作用规律。
[1] 张建宇, 潘荔, 杨帆, 等. 中国燃煤电厂大气污染物控制现状分析[J]. 环境工程技术学报, 2011, 1(5): 185-196.
ZHANG J Y, PAN L, YANG F,. Study on current status of air pollution control for coal-fired power plants in china [J]. Journal of Environmental Engineering Technology, 2011, 1(5): 185-196.
[2] 林海周, 杨辉, 罗海中, 等. 烟气二氧化碳捕集胺类吸收剂研究进展 [J]. 南方能源建设, 2019, 6(1): 16-21.
LIN H Z, YANG H, LUO H Z,. Research progress on amine absorbent for CO2capture from flue gas [J]. Southern Energy Construction, 2019, 6(1): 16-21.
[3] 贺鹏, 郑伯红, 龚凯. 醇胺法碳捕集再生能耗影响因素研究 [J]. 现代化工, 2016, 36(9): 171-174.
HE P, ZHENG B H, GONG K. The factors affecting energy consumption of MEA carbon capture [J]. Modern Chemical Industry, 2016, 36(9): 171-174.
[4] RAO A B, RUBIN E S, KEITH D W. Evaluation of potential cost reductions from improved amine-based CO2capture systems [J]. Energy Policy, 2006, 34(18): 3765-3772.
[5] 贺三, 高超洋, 张岭. MEA捕集CO2腐蚀研究进展[J]. 腐蚀科学与防护技术, 2018, 30(4): 454-458.
HE S, GAO C Y, ZHANG L. Research progress on corrosion of carbon steel during process of capture CO2with monoethanolamine solution [J]. Corrosion Science and Protection Technology, 2018, 30(4): 454-458.
[6] CHAPEL D G, MARIZ C L. ERNEST J. Recovery of CO2from flue gases: Commercial Trends [R]. Saskatoon, Canada: Canadian Society of Chemical Engineers Annual Meeting, 1999.
[7] SUDA T, FUJII M, YOSHIDA K,. Development of flue gas carbon dioxide recovery technology [J]. Energy Conversion and Management, 1992, 33(5/6/7/8): 317-324.
[8] FAROOQ S, PANS M A, SUN C G. Oxy-fuel combustion study of biomass fuels in a 20 kWthfluidized bed combustor [J]. Fuel, 2018, 215: 778-786.
[9] MIMURA T, NOJO T, IIJIMA M,. Recent developments on flue gas CO2recovery technology greenhouse gas control technologies: 6th International Conference [C]. Kyoto: Elsevier, 2003.
[10] Cost and Performance Baseline for Fossil energy plants. Vol. 1: Bituminous coal and natural gas to electricity [M]. Washington, DC: National Energy Technology Laboratory, 2010.
[11] 方梦祥, 狄闻韬, 易宁彤, 等. CO2化学吸收系统污染物排放与控制研究进展 [J/OL]. 洁净煤技术, 2020 [2020-10-15]. http://kns.cnki.net/kcms/detail/11.3676.TD.20200610.0922.002.html.
FANG M X, DI W T, YI N T,. Research progress on pollutant emission and control from CO2chemical absorption system [J/OL]. Clean Coal Technology, 2020 [2020-10-15]. http://kns.cnki.net/kcms/detail/11.3676.TD.20200610.0922.002.html.
[12] ROONEY P, DUPART M, BACON T. Oxygen’s role in alkanolamine degradation [J]. Hydrocarbon Processing, 1998, 77(7): 109-113.
[13] CHI S, ROCHELLE G T. Oxidative degradation of monoethanolamine [J].Industrial and Engineering Chemistry Research, 2002, 41(17): 4178-4186.
[14] STRAZISAR B R, ANDERSON R R, WHITE C M. Degradation of monoethanolamineused in CO2capture from flue gas of a coal-fired electric power generating station [J]. Journal of Energy and Environmental Research, 2001, 1: 32-39.
[15] SEXTON A J, ROCHELLE G T. Reaction products from the oxidative degradation of monoethanolamine [J]. Industrial and Engineering Chemistry Research, 2011, 50(2): 667-673.
[16] VEVELSTAD S J, EIDE-HAUGMO I, DA SILVA E F,. Degradation of MEA: A theoretical study [J]. Energy Procedia, 2011, 4: 1608-1615.
[17] SUPAP T, IDEM R, TONTIWACHWUTHIKUL P,. Kinetics of sulfur dioxide- and oxygen-induced degradation of aqueous monoethanolamine solution during CO2absorption from power plant flue gas streams [J]. Greenhouse Gas Control, 2009, 3(2): 133-142.
[18] WILLIAMS H K R. Oxidations of amines. II. Substituent effects in chlorine dioxide oxidations [J]. Journal of the American Chemical Society, 1967, 191(4): 1158-1163.
[19] BUTTON J K, GUBBINS K E, TANAKA H,. Molecular dynamics simulation of hydrogen bonding in monoethanolamine [J]. Fluid Phase Equilibria, 1996, 116(1/2): 320-325.
[20] SEXTON A J. Amine oxidation in CO2capture processes [D]. Austin: University of Texas, 2008.
[21] CHAKAM A, MEHROTRO A K N B. Comparision of chemical solvents for mitigating CO2emissions from coal-fired power plants [J]. Heat Recovery Systems and CHP, 1995, 15(2): 231-240.
[22] QIU G Q. Testing of flue gas emissions of a biomass pellet boiler and abatement of particle emissions [J]. Renewable Energy, 2013, 50: 94-102.
[23] LEPAUMIER H, SILVA E F, EINBU A,. Comparison of MEA degradation in pilot-scale with labscale experiments [J]. Energy Procedia , 2011, 4: 1652-1659.
[24] DAVIS J D. Thermal degradation of aqueous amines used for carbon dioxide capture [D]. Austin: University of Texas, 2009.
[25] LEPAUMIER H, PICQ D, CARRETTE P L. New amines for CO2capture. I: Mechanisms of amine degradation in the presence of CO2[J]. Industrial and Engineering Chemistry Research, 2009, 48(20): 9061-9067.
[26] GUPTA M, VEVELSTAD S J, SVENDSEN H F. Mechanisms and reaction pathways in MEA degradation: A computational study [J]. Energy Procedia, 2014, 63: 1115-1121.
[27] YOON B, STOWE H M, HWANG G S. Molecular mechanisms for thermal degradation of CO2-loaded aqueous monoethanolamine solution: A first-principles study [J]. Physical Chemistry Chemical Physics, 2019, 21(39): 22132-22139.
[28] LEONARD G, TOYE D, HEYEN G. Experimental study and kinetic model of monoethanolamine oxidative and thermal degradation for post combustion CO2capture [J]. International Journal of Greenhouse Gas Control, 2014, 30: 171-178.
[29] SUPAP T, IDEM R, VEAWAB A,. Kinetics of the oxidative degradation of aqueous monoethanolamine in flue gases treating unit [J]. Industrial and Engineering Chemistry Research, 2001, 40(16): 3445-3450.
[30] GOFF G S, ROCHELLE G T. Monoethanolamine degradation: O2mass transfer effects under CO2capture conditions [J]. Industrial and Engineering Chemistry Research, 2004, 43(20): 6400-6408.
[31] CUMMINGS A L, SMITH G D. Better alkanolamine system operations through chemical analysis: Laurance Reid Gas Conditioning Conference [C]. Los Angeles: Vail Corporation, 2010.
[32] UYANGA I J, IDEM R O. Studies of SO2and O2induced degradation of aqueous MEA during CO2capture from power plant flue gas streams [J]. Industrial and Engineering Chemistry Research, 2007, 46(8): 2558-2566.
[33] 高巨宝, 王淑娟, 周姗, 等. SO2对碳捕集过程影响的实验研究[J]. 中国机电工程学报, 2011, 31(5): 52-57.
GAO J B, WANG S J, ZHOU S,. Experimental study on the influence of SO2on the CO2capture process [J]. Proceedings of the CSEE, 2011, 31(5): 52-57.
[34] 孙晨辰. 碳捕集过程中SO2对乙醇胺降解的影响[D]. 北京: 清华大学, 2013.
SUN C C. Effect of SO2in flue gas on degradation of MEA in CO2capture [D]. Beijing: Tsinghua University, 2013.
[35] ZHOU S, WANG S, SUN C. SO2effect on degradation of MEA and some other amines [J]. Energy Procedia, 2013, 37: 896-904.
[36] 周姗, 王淑娟, ROCHELLE G T, 等. CO2捕集过程中有机胺热降解的实验研究 [J]. 清华大学学报(自然科学版), 2012, 52(1): 37-39.
ZHOU S, WANG S J, ROCHELLE G T,. Experiment research on amine thermal degradation during CO2capture [J]. Journal of Tsinghua University (Science and Technology),2012, 52(1): 81-86.
[37] 张媛媛, 许嘉钰, 张建, 等. 有机胺类碳捕集药剂降解产物亚硝胺的健康风险评价[J]. 油气田环境保护, 2016, 26(6): 5-7.
ZHANG Y Y, XU J Y, ZHANG J,. Heath risk assessment of nitrosamine degraded from organic amine carbon capture agent [J]. Environmental Protection of Oil and Gas Fields, 2016, 26(6): 5-7.
[38] CHALLIS B C, KYRTOPOULOS S A. Nitrosation under alkaline conditions [J]. Chemical Communications, 1976, 21: 877-878.
[39] FINEA N A, ROCHELLEA G T. Absorption of nitrogen oxides in aqueous amines [J].Energy Procedia, 2014, 63: 830- 847.
[40] WANG Z M, ZHANG Z, MITCH W A. Role of absorber and desorber units and operational conditions for N-nitrosamine formation during amine-based carbon capture [J]. Water Research, 2020, 107: 115299.
[41] WANG Z M, MITCH W A. Influence of dissolved metals on n-nitrosamine formation under amine-based CO2capture conditions [J]. Environmental Science and Technology, 2015, 49(19): 1-36.
[42] XIANG Y, XIE W, NI S,. Comparative study of A106 steel corrosion in fresh and dirty MEA solutions during the CO2capture process: Effect of NO3−[J]. Corrosion Science, 2020, 167: 108521.
[43] RAO A B, RUBIN E S. A technical, economic, and environmental assessment of amine-based CO2capture technology for power plant greenhouse gas control [J]. Environmental Science and Technology, 2002, 36(20): 4467-4475.
[44] LEE I Y, LEE J H, KIM J H,. Effect of corrosion inhibitors on oxidative degradation of MEA in carbon dioxide capture [J]. Journal of Chemical Engineering of Japan, 2011, 44(4): 273-277.
[45] LEPAUMIER H, PICQ D, CARRETTE P L. New amines for CO2capture.II: Mechanisms of amine degradation in the presence of CO2[J]. Industrial and Engineering Chemistry Research, 2009, 48(20): 9068-9075.
[46] SEXTON A J, ROCHELLE G T. Catalysts and inhibitors for oxidative degradation of monoethanolamine [J]. International Journal of Greenhouse Gas Control, 2009, 3(6): 704-711.
[47] 李世霞. CO2吸收剂降解分析与实验研究[D]. 青岛: 中国石油大学(华东), 2017.
LI S X. Experimental study and degradation analysis of CO2absorbent [D]. Qingdao: China University of Petroleum, 2017.
[48] VOICE A K, ROCHELLE G T. Products and process variables in oxidation of monoethanolamine for CO2capture [J]. International Journal of Greenhouse Gas Control, 2013, 12: 472-477.
[49] SAEED I M, ALI B S, JAN B M. Thermal degradation of diethanolamine at stripper condition for CO2capture: Product types and reaction mechanisms [J]. Chinese Journal of Chemical Engineering, 2019, 27(12): 2900-2908.
[50] 汪铁林, 延斯·克劳斯. 二氧化碳捕集中2-氨基-2-甲基-1-丙醇溶剂的热降解[J]. 武汉工程大学学报, 2013, 35(10): 1-5.
WANG T L, JENS K J. Thermal degradation of 2-amino-2-methyl-1-propanol solvent for carbon dioxide capture [J]. Journal of Wuhan Institute of Technology, 2013, 35(10): 1-5.
[51] DAVIS J, ROCHELLE G T. Thermal degradation of monoethanolamine at stripperconditions [J]. Energy Procedia, 2009, 1(1): 327-333.
[52] HAUGMO I , LEPAUMIER H, EINBU A,. Chemical stability and biodegradability of new solvents for CO2capture [J]. Energy Procedia, 2011, 4: 1631-1636.
[53] BELLO A, IDEM R O. Comprehensive study of the kinetics of the oxidativedegradation of CO2loaded and concentrated aqueous monoethanolamine (MEA) with and without sodium metavanadate during CO2absorption from flue gases [J]. Industrial and Engineering Chemistry Research, 2006, 45(8): 2569-2579.
[54] LUDOVIC D, COLIN S, GEOFF S,. Purification of aqueous amine solvents used in post combustion CO2capture: A review [J]. International Journal of Greenhouse Gas Control, 2012, 10: 443-455.
[55] MCGURK S J, MARTÍN C F, BRANDANI S,. Microwave swing regeneration of aqueous monoethanolamine for post-combustion CO2capture [J]. Applied Energy, 2017, 192: 126-133.
[56] SHOUKAT U, BAUMEISTER E, PINTO D D,. Thermal stability and corrosion of tertiary amines in aqueous amine and amine-glycol-water solutions for combined acid gas and water removal [J]. Journal of Natural Gas Science and Engineering, 2019, 62: 26-37.
[57] LAI Q, KONG L, GONG W,. Low-energy-consumption and environmentally friendly CO2capture via blending alcohols into amine solution [J]. Applied Energy, 2019, 254: 113696.
Review on degradation and inhibition of amine from amine carbon capture processes
LEI Xuan-miao, WANG Fu, ZHU Xian-hui, YUAN Jin-liang
(Faculty of Maritime and Transportation, Ningbo University, Ningbo 315000 , China)
Carbon capture using amine absorbents is one of the most commercialized CO2separation technologies, which has broad market prospects in power plants. However, the inherent properties of amine degradation have become the main obstacles limiting their promotion and application. The degradation mechanism, influencing factors and formation paths of amine degradation products were discussed. Effects of impurities in flue gases and metal ions in absorbents on oxidation degradation mechanism and thermal degradation rates were reviewed, and strategies to reduce amine degradation were described. Finally, application prospects of amines in carbon capture were prospected. Studies on physical, chemical, thermodynamic properties and degradation mechanism are suggested, and the determination of products and formation mechanism of amine degradation under multilateral environments should be focused in future research.
CO2capture; chemical absorbent; amine; oxidative degradation; thermal degradation; inhibiting methods
1003-9015(2021)06-0966-13
X511
A
10.3969/j.issn.1003-9015.2021.06.003
2020-10-17;
2021-02-05。
国家自然科学基金(51706112);浙江省自然科学基金(LY20E060001);宁波市自然科学基金(202003N4151);宁波大学科研创新基金(IF2021145)。
雷轩邈(1997-),男,湖北荆州人,宁波大学硕士生。
王甫,E-mail:wangfu@nbu.edu.cn
