山西种猪场CSFV、PRRSV、PRV、PCV2免疫与感染情况调研
2022-01-17樊振华刘文俊韩一超米瑞娟薛翼鹏
樊振华,孟 帆,吴 忻,张 娟,刘文俊,韩一超,米瑞娟,薛翼鹏,赵 岳
(1.山西农业大学动物医学学院,山西 晋中 030801 ; 2.山西省动物疫病预防控制中心,山西 太原 030027)
猪瘟(CSF)、猪繁殖与呼吸综合征(PRRS)、猪伪狂犬病(PR)和猪圆环病毒2型(PCV2)感染四大疫病可破坏猪的生殖、呼吸、消化和免疫系统。其具有传播快、病死率高、流行范围广、传播途径多等特点,并且常常混合感染,严重危害我国养猪业的发展。2010年以来,CSF疫情出现了反弹现象,以亚临床隐性感染为主,持续向外排毒、妊娠母猪带毒综合征、仔猪先天性感染和免疫耐受;2010年以PRRS为主的流产风暴侵入山西,造成母猪繁殖障碍、仔猪呼吸系统损伤,一些猪场暴发高热高死亡率。2012年我国南方地区一些猪场即使在猪伪狂犬病免疫抗体比较高的情况下,也发生母猪流产,1周龄乳猪有神经症状、口吐白沫、死亡现象,并被实验室确诊为猪伪狂犬病[1-5]。PCV2可引起断奶后仔猪多系统衰弱综合征,急性暴发时,病死率可达30%以上,且严重危害猪生长发育。随着山西养猪业向集约化、规模化发展,由于监测检测滞后,接种疫苗不科学、生物安全措施不到位等存在的问题造成这些疫病的流行,也成为制约养猪业发展的瓶颈。2013年以来,本项目组深入山西省11个地市70多个规模化种猪场,进行了猪主要疫病流行情况调查,同时对采集的血样和病料进行了抗体和病原检测,初步查明了山西省猪群猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪伪狂犬病毒(PRV)、PCV2免疫与感染情况,为有效防控这些疫病的流行提供数据支持。
1 材料与方法
1.1 血样和病料的采集与处理 严格按照动物疫病实验室病料样品采集方法的相关规定,随机从各猪场存栏的母猪、公猪以及不同日龄仔猪的耳静脉,或前腔静脉抽取血液,分离血清,然后于-70 ℃保存备用。从病死猪中采集血、肺、肝、脾、肾、淋巴结等脏器组织,经过处理后于-70 ℃低温冰箱冷冻保存备用。
1.2 ELISA方法血清抗体检测
1.2.1 CSFV免疫抗体检测 采用武汉科前动物生物制品有限责任公司生产的ELISA诊断试剂盒,对待检血清进行相应的抗体检测。判定标准:OD630 nm≥0.35为CSFV抗体阳性,OD630 nm<0.35 为CSFV抗体阴性。
1.2.2 PRRSV感染抗体检测 采用美国IDEXX 公司生产的PRRSV抗体检测试剂盒,对待检血清进行相应的ELISA抗体检测。血清抗体判定标准:S/P≥0.4 为阳性,S/P<0.4 为阴性。
1.2.3 PRV感染抗体检测 采用美国IDEXX 公司生产的PRV gE 鉴别ELISA 诊断试剂盒,对待检血清进行检测,可诊断猪群是否感染PRV野毒株。判定标准:S/N≤0.6为阳性,S/N>0.7 为阴性,0.6
1.2.4 PRV免疫抗体检测 采用美国IDEXX 公司生产的PRV gB抗体检测试剂盒,对待检猪血清进行检测,可诊断猪群免疫PRV疫苗后的抗体水平。判定标准:S/N≤0.6为阳性,S/N>0.7 为阴性,0.6
1.2.5 PCV2病毒感染抗体检测 采用武汉科前动物生物制品有限责任公司生产的PCV2型ELISA抗体检测试剂盒对待检血清进行检测。抗体判定标准:样品OD630 nm>0.42,判为阳性;样品OD630 nm值介于0.38~0.42,判为可疑;样品OD630 nm<0.38,判为阴性。
1.3 PCR方法病原检测 对待检血清及病料上清物进行病原检测,CSFV核酸扩增检测试剂盒,由北京索奥生物技术有限公司提供;PRRSV鉴别RT-PCR检测试剂盒,由青岛易邦生物工程有限公司提供;PRV PCR检测试剂盒和PCV2 PCR检测试剂盒,均由北京世纪元亨动物防疫技术有限公司提供。检测方法与判定标准按各试剂盒使用说明书进行。
2 结果与讨论
2.1 CSFV、PRV免疫抗体检测 2013—2018年,采用ELISA抗体检测试剂盒对山西省11地市70多个种猪场检测母猪公猪CSFV抗体血样902份,合格率为76.61%;检测仔猪血样3 133份,合格率为55.89%。检测母猪公猪PRV gB抗体血样661份,合格率为90.02%,检测仔猪PRV gB抗体血样3 892份, 合格率为88.26%,见图1。从图1可以看出,母猪公猪CSFV免疫抗体合格率,2013—2016年略呈逐年持续上升趋势,2016—2017年呈明显下降趋势,2017—2018年呈上升趋势,2018年恢复至2013—2015年平均水平。仔猪CSFV免疫抗体合格率,2013—2016年略呈逐年持续上升趋势,2016—2017年呈明显下降趋势,2017—2018年呈上升趋势,可见除2017年较其他几年低外,2013—2018年间猪瘟免疫效果总体水平相当,这可能由于2017年猪瘟退出政府强制免疫后,猪场对猪瘟的防控放松所致,与陈丽燕[6]对福建省龙岩市规模化猪场猪瘟免疫抗体情况调查和周恒等[7]对湖南省宜昌市夷陵区猪瘟免疫抗体监测分析研究结果一致。母猪公猪PRV免疫抗体合格率2013—2015年呈逐年持续上升趋势,2015—2016年呈下降趋势,2016—2017年呈上升趋势,2017—2018年呈下降趋势;仔猪PRV免疫抗体合格率,2013—2014年略呈上升趋势,2014—2015年略呈下降趋势,2015—2016年呈明显上升趋势,2016—2017年略呈下降趋势,2017—2018年略呈上升趋势,总的来看,2013—2018年整体呈上升趋势;猪伪狂犬免疫效果总体水平较为理想。但自2012年以来,调查发现即使免疫抗体效价和合格率较高,有些仔猪也会出现口吐白沫,伴有神经症状等,导致死亡,猪PR病原检测为阳性猪,这可能与PR病原发生变异有关[8-15]。同时对太原、晋中3个猪场不同日龄猪群的CSFV、PRV gB抗体消长情况进行了检测,结果发现,PRV gB抗体合格率从70日龄开始呈明显持续下降趋势,120日龄降至最低;CSFV抗体合格率从30日龄开始呈明显下降趋势,40、50日龄和60日龄降至最低,只有32%左右,比王娟萍等[16]报道的保育猪抗体阳性率平均为40.57%还低,为此应调整CSF免疫程序与方法,强化仔猪的免疫,70日龄开始上升,100日龄又开始降低(图2)。
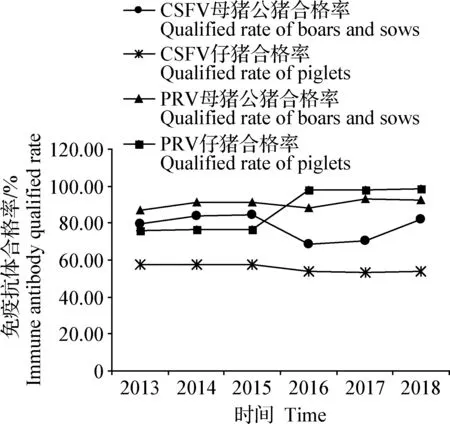
图1 CSFV、PRV免疫抗体合格率Fig.1 Qualified rates of immune antibody to CSFV and PRV

图2 CSFV、PRV gB免疫抗体消长情况Fig.2 Fluctuation of immune antibody to CSFV and PRV gB
2.2 PRRSV、PCV2、PRV gE感染抗体检测 应用ELISA抗体检测试剂盒检测PRRSV非免疫猪群母猪公猪血样602份,感染抗体阳性率为64.45%、仔猪血样2 800份,阳性率为51.11%;检测PCV2非免疫猪群母猪公猪血样651份,阳性率为62.06%;仔猪血样4 001份,阳性率为59.16%;检测PRV gE血样3 892份,阳性率为38.28%,见图3。从图3可以看出,随着时间的变化,PRRSV母猪公猪感染抗体阳性率整体呈上升趋势,除2016—2017年略呈下降趋势外,其他年份都呈逐年持续上升的趋势,尤其2016—2018年比2013—2015年明显上升;PRRSV仔猪感染抗体阳性率整体呈上升趋势,除2013—2014年略呈下降趋势外,2014—2018年都呈逐年持续上升趋势,尤其2016—2018年比2013—2015年明显上升;PCV2母猪公猪感染抗体阳性率2013—2014年呈下降趋势,2014—2015年呈上升趋势,2015—2016年明显呈下降趋势,2016—2018年明显呈逐年持续上升趋势;PCV2仔猪感染抗体阳性率,2013—2014年呈上升趋势,2014—2016年呈逐年持续下降趋势,2016—2018年明显呈逐年持续上升趋势,证实山西猪群普遍感染PRRSV和PCV2[17]。PRV感染抗体阳性率,2013—2015年呈逐年持续下降趋势,2015—2016年呈上升趋势,2016—2017年呈下降趋势,2017—2018年呈上升趋势,可见山西猪群PRV gE抗体阳性率虽然起伏不定,没有暴发流行,但2013—2018年整体呈上升趋势,预示着随时可能暴发伪狂犬病,预防及净化工作刻不容缓。这与高许雷等[18]2012—2017 年我国部分地区规模化猪场PRV 野毒感染状况血清流行病学调查情况相一致。
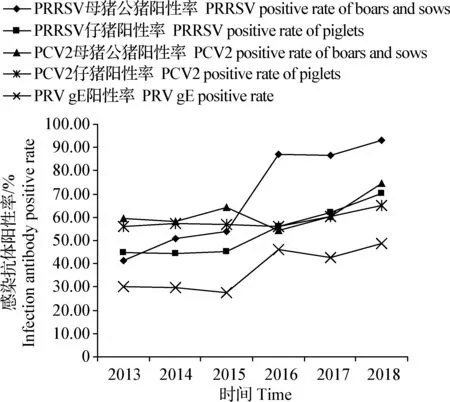
图3 PRRSV、PCV2、PRV gE感染抗体检测结果Fig.3 Detection results of PRRSV,PCV2 and PRV gE infection antibodies
2.3 CSF、PRRS、PR、PCV2感染病原检测 应用PCR和RT-PCR检测试剂盒检测病料616份,CSFV阳性率为12.66%,PRRSV阳性率为4.38%,高致病性猪繁殖与呼吸综合征病毒(HP-PRRSV)阳性率为22.40%,PRV阳性率为7.14%,PCV2阳性率为28.57%,见图4。从图4可以看出,CSFV阳性率2010—2011年呈上升趋势,2011—2016年呈逐年持续下降趋势,2016—2017年呈上升趋势,2017—2018年呈下降趋势,2010—2012年明显高于其他年份,2010—2018年整体呈下降趋势,可能因为国家2007年开始将猪瘟免疫纳入重大动物疫病强制免疫的范畴后,使得猪瘟的免疫进入规模化、科学化的轨道,这在一定程度使猪瘟得到了控制。PRRSV阳性率2010—2014年呈逐年持续下降趋势,2014—2016年呈逐年持续上升趋势,2016—2018年呈逐年持续下降趋势,阳性检出率起伏不定;HP-PRRSV阳性率2010—2014年呈逐年持续上升趋势,2014—2015年呈下降趋势,2015—2017年呈逐年持续上升趋势,2017—2018年呈下降趋势,2017—2018年明显高于其他年份,整体呈上升趋势,这与刘建奎等[19]2009—2017年对福建省PRRSV分子流行病学调查的情况相一致,可见PRRS的防控形势依然严峻。PRV阳性率2010—2011年呈下降趋势,2011—2013年呈逐年持续上升趋势,2013—2015年呈逐年持续下降趋势,2015—2018年呈逐年持续上升趋势,阳性检出率起伏不定,但2013年最高,可能与PRV发生变异有关[8-15]。PCV2阳性率2010—2015年呈逐年持续上升趋势,2015—2017年呈逐年持续下降趋势,2017—2018年呈上升趋势,2015年明显高于其他年份,阳性检出率最高。学者宋玉慧[20]于2014—2015年对河南省18个地市进行PCV2病原核酸检测,PCV2的核酸阳性率为28.08%;李海全等[21]于2015—2017年在四川省7个市县地区进行PCV2病原核酸检测,PCV2的核酸阳性率为49.20%,这些都表明,PCV2在全国都存在比较严重的感染。
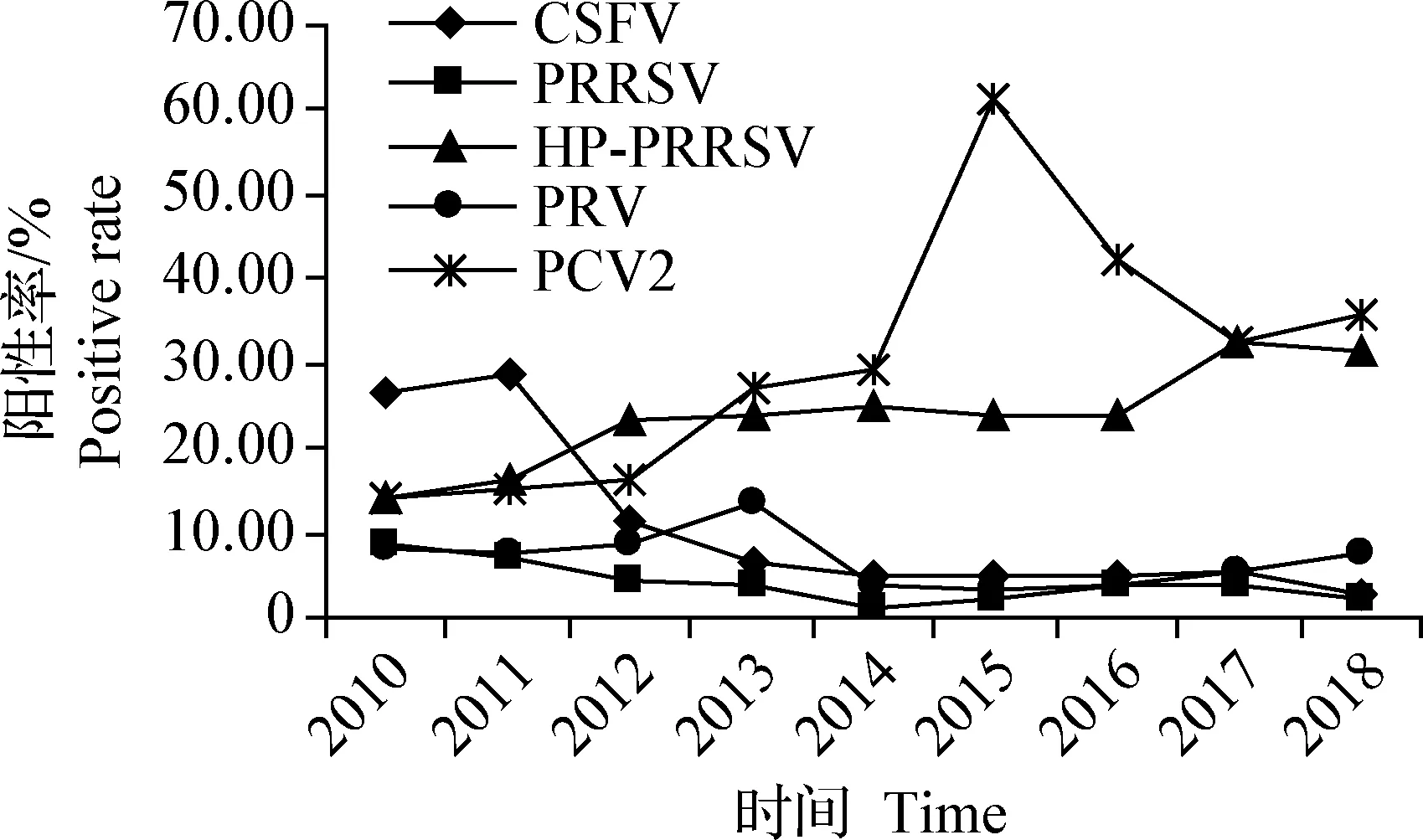
图4 CSFV、PRRSV、HP-PRRSV、PRV和PCV2 gE病原检测结果Fig.4 Detection results of pathogen for CSFV, PRRSV,HP-PRRSV, PRV and PCV2 gE
2.4 CSF、PRRS、PR、PCV2感染病原混合感染 对616份病料同时检测CSFV、PRRSV、PRV、PCV2,证明PCV2和其他4种疫病的混合感染达到16.23%。同时发现PCV2和HP-PRRSV共感染率最高,达8.12%,这与当前我国猪群较为普遍感染模式仍是混合感染,病毒性混合感染中,PRRSV和PCV2混感仍为最主要的混合感染模式相一致。PCV2和PRV共感染率次之,达3.08%,其次为PCV2和PRRSV共感染及HP-PRRSV和PRRSV共感染,然后为PCV2和CSFV共感染,再次为CSFV和HP-PRRSV共感染,CSFV和PRV共感染及PRV和PRRSV共感染率最低(图5),这也可能是PCV2在猪场的存在对猪群免疫系统产生抑制作用,致使对其他疫病免疫应答反应下降的原因之一[22]。
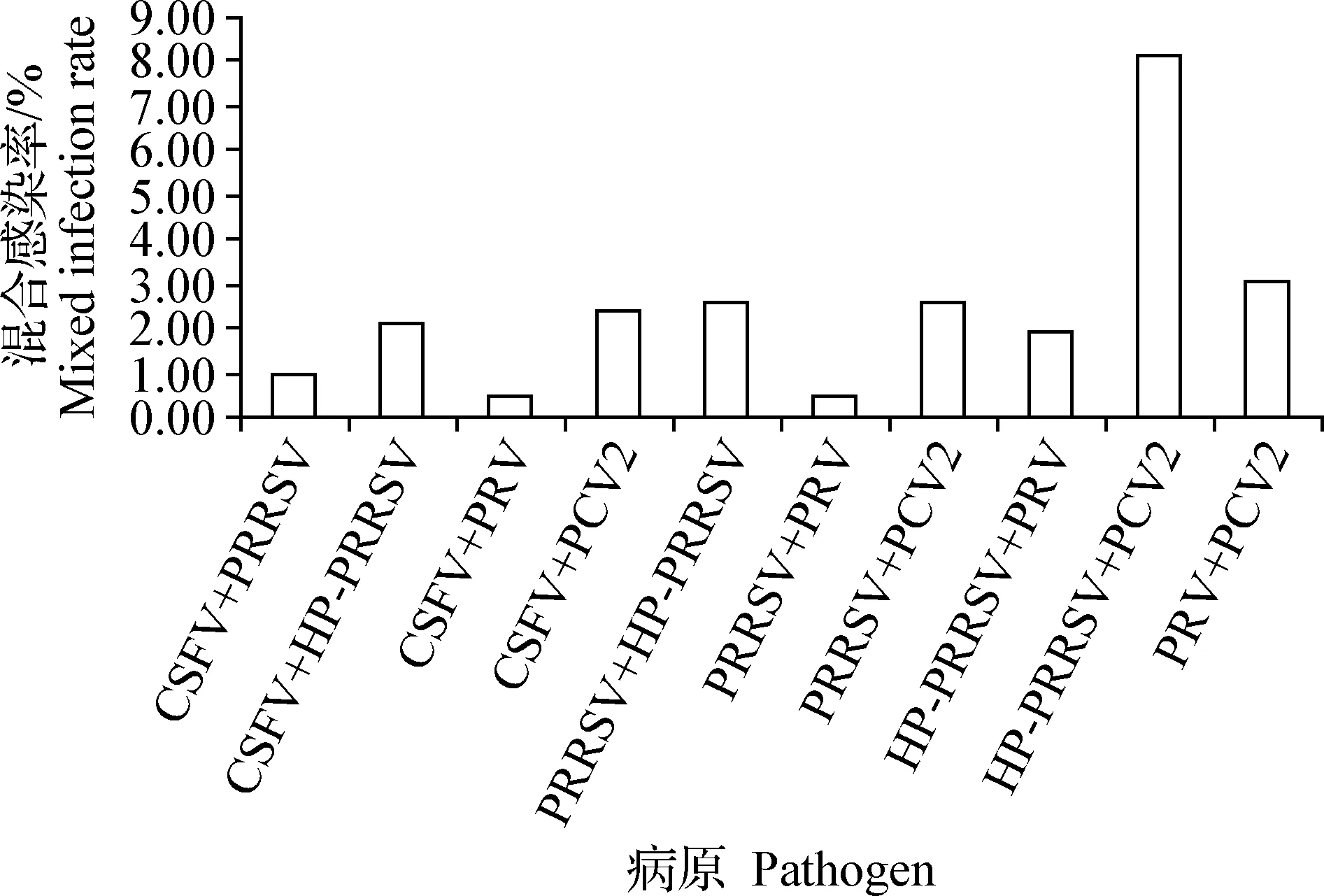
图5 CSFV、PRRSV、HP-PRRSV、PRV和PCV2混合感染病原检测Fig.5 Detection results of mixed infection pathogen for CSFV,PRRSV,HP-PRRSV,PCV2 and PRV
综上所述,通过对山西省猪群CSFV和PRV 免疫抗体,PRRSV、PCV2和PRV感染抗体及CSFV、PRRSV、HP-PRRSV、PCV2和PRV病原的抽查检测,基本掌握了山西省猪群免疫情况、感染情况以及流行动态,为免疫程序的调整和采取针对性防控措施提供了依据。
