猪塞内卡谷病毒和圆环病毒2型嵌合病毒样颗粒疫苗的制备与抗体检测
2022-01-17何至远吴冬荀张贺楠吴珊珊刘昕泽
何至远,吴冬荀,张贺楠,王 飞,吴珊珊,刘昕泽,肖 进
(1. 中牧实业股份有限公司,北京 丰台 100070 ; 2. 中国农业大学动物科学技术学院,北京 海淀 100193)
塞内卡谷病毒(Seneca valley virus,SVV)是单股正链RNA病毒,是小RNA病毒科塞内卡病毒属的唯一成员[1]。不同年龄和品种的猪均易感,母猪发病率高,可达70%~90%,但是感染猪的死亡率很低。2014年底以来,SVV在美国、巴西等国家猪群暴发,同时在北美周边地区也发现SVV所致水疱病[2-3]。我国于2015年首次检测到SVV感染母猪出现水疱病临床症状,感染仔猪出现急性死亡,之后在我国多个省份陆续检出SVV,对养猪业的生产和经济效益具有较大威胁[4]。疫苗免疫接种被认为是防控塞内卡谷病毒流行的有效手段,当前还没有市售的SVV商品化疫苗。
猪圆环病毒2型(Porcine circovirus type 2,PCV2)是断乳仔猪多系统衰竭综合征(Postweaning multisystemic wasting syndrome, PMWS)的主要病原,自1991年PMWS在北美发现以来,已在世界范围内流行[5]。由于PCV2经常与多种病原混合感染,典型性临床症状为消瘦、皮肤苍白、腹泻、呼吸障碍及轻度黄疸[6]。
杆状病毒表达系统是真核细胞表达系统,其具有独特的生物学特性,培养及操作较简便,因此被广泛用于生产基因工程产品[7]。病毒样颗粒(Virus-like particles)是含有某种病毒的一个或多个结构蛋白的空心颗粒,没有病毒核酸,不能自主复制,在形态上与真正病毒粒子相同或相似,表现出与天然病毒更相似的构象表位,能够有效刺激机体产生体液免疫和细胞免疫应答,由于其不含病毒核酸而无法复制,不具有感染性,是较为安全的候选疫苗[8]。随着分子生物学技术的飞速发展,利用杆状病毒表达系统研制基因工程亚单位疫苗受到了追捧。
我国首次于2015年从广东地区暴发圆环疫情猪群中检测到猪塞内卡谷病毒[9],在实际生产中,猪塞内卡谷病毒与猪圆环病毒混合感染时有发生。本试验旨在通过杆状病毒表达系统表达猪塞内卡谷病毒、圆环病毒2型嵌合病毒样颗粒,制备相应的嵌合病毒样颗粒疫苗。该疫苗经济实用,为国内养殖企业防控两种疾病提供了一种新的方法。
1 材料与方法
1.1 菌株、毒株、细胞及实验动物 大肠杆菌E.coliDH5α/ DH10Bac菌种由本实验室保存;昆虫细胞系sf9 细胞、质粒pFBDM、塞内卡谷病毒(CH-FJZZ-2017,CGMCC No.12160),均由本实验室保存;70~80日龄SPF猪,均购自北京大学实验动物中心。
1.2 主要仪器和试剂 限制性内切酶、同源重组酶、胶回收试剂盒和分子筛,均购自北京中原生物科技有限公司;质粒快速提取试剂盒,购自北京艾德莱生物有限公司;SVV高免血清、PCV2单克隆抗体,均由本实验室保存;转染试剂Cellfectin,购自Invitrogen贸易有限公司;SFM培养基,购自Lonza贸易有限公司;HRP标记山羊抗小鼠IgG,购自北京鼎国昌盛生物技术有限责任公司;细胞培养板(瓶),购自美国Costar公司;ISA206佐剂,购自法国赛彼克贸易有限公司;PCV2-dCap-ELISA 检测试剂盒“锐捷”,购自瑞普生物药业有限公司。大型冷冻离心机,购自Eppendorf贸易有限公司;大型双层恒温摇床,购自武汉汇诚生物科技有限公司。
1.3 猪塞内卡谷病毒和圆环病毒2型嵌合质粒的构建
1.3.1 猪塞内卡谷病毒P1基因克隆 参照已发表的猪塞内卡谷病毒基因序列(GenBank:KY747510.1)设计引物(表1),引物由北京擎科生物科技有限公司合成。以提取猪塞内卡谷病毒总RNA为模板,经MLV-反转录酶合成cDNA第1链后,以P1、P2为引物,PCR扩增VP0基因;PCR反应体系为50 μL,PCR反应条件:95 ℃预变性5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 1.5 min,30个循环;72 ℃ 10 min,16 ℃ 10 min。将PCR产物连接于pFBDM载体,为pFB-VP0质粒;VP1片段,以P3、P4为引物,cDNA为模板扩增,PCR反应体系为50 μL,PCR反应条件:95 ℃预变性5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 10 min,16 ℃ 10 min。分别双酶切(XhoI/NheI)PCR产物和质粒pFB-VP0,用T4连接酶连接后为pFB-VP0/VP1;VP3片段,以P5、P6为引物,以cDNA为模板,PCR反应体系为50 μL,PCR反应条件:95 ℃预变性5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 10 min,16 ℃ 10 min。连接于pFBDM载体,为pFB-VP3质粒;最后双酶切(XhoI/XbaI)pFB-VP0/VP1质粒回收小片段,与酶切pFB-VP3质粒大片段连接,经筛选获得含有猪塞内卡谷病毒P1基因完整编码区序列阳性质粒pFB-P1。

表1 PCR引物Table 1 PCR primers
1.3.2 猪塞内卡谷病毒VP3、圆环病毒2抗原表位嵌合基因克隆 通过基因序列合成方法实现部分VP3序列替换为猪圆环病毒2型ORF2基因C端部分抗原表位序列,将替换后序列连接pFBDM载体上(含GFP报告基因),筛选和测序后获得具有替换后序列的阳性质粒pFB-GFP-VP3-PCV2。
1.3.3 猪塞内卡谷病毒和圆环病毒2抗原表位嵌合基因克隆 设计同源序列P7、P8,用PCR方法以pFB-GFP-VP3-PCV2为模板扩增目的片段GFP-VP3-PCV2,PCR反应体系为50 μL,PCR反应条件:95 ℃预变性5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 2 min 30 s, 30个循环;72 ℃ 10 min,16 ℃ 10 min。XhoI和NheI双酶切法线性化pFB-P1载体,同源重组酶连接目的片段和线性化载体,转化入DH5α感受态细胞,获得pFB-GFP-P1-PCV2阳性质粒。
1.4 rFB-P1-PCV2重组杆粒构建与提取 将pFB-GFP-P1-PCV2重组质粒转化入DH10Bac感受态细胞中,37 ℃培养4 h后涂布于含卡那霉素(50 μg/mL)、四环素(10 μg/mL)、庆大霉素(7 μg/mL)、X-Gal(100 μg/mL)、IPTG(40 μg/mL)的LB蓝白斑筛选平板上,经培养后挑取白色菌落进行PCR鉴定,获得rFB-P1-PCV2重组载体,扩大培养,采用异丙醇沉淀法抽提重组杆粒,立即使用或置于-20 ℃保存备用。
1.5 嵌合重组杆状病毒的获得及鉴定 利用脂质体转染法将rFB-P1-PCV2转染sf9细胞,放置于28 ℃培养,48~72 h后细胞变圆、变大,内部出现大量颗粒体,能检测到大量GFP荧光信号,随即细胞大量死亡;阴性对照组细胞正常生长,说明重组杆状病毒组装成功。收获培养物后于1 500 g离心5~10 min收取上清,即为F1代病毒液;再用F1代病毒液感染空白sf9细胞,待产生细胞病变达到80%以上时,收获培养物上清,即为F2代病毒液。依照该方法,将重组杆状病毒传至F4代,所有收获的重组杆状病毒置于-80 ℃保存备用。
将收获的嵌合重组杆状病毒F4代毒种接种于悬浮培养的sf9细胞中,接毒72 h后收获细胞培养上清。利用分子筛纯化后采用SDS-PAGE方法检测纯化效果,然后分别用SVV高免血清和PCV2单克隆抗体进行Western Blot检测。同时,将纯化后嵌合重组蛋白经过负染后,在透射电镜下观察病毒样颗粒结构。
1.6 嵌合病毒样颗粒疫苗的制备和评价 将纯化得到的上述嵌合重组病毒样颗粒与ISA206佐剂按照质量比1∶1混匀后制成疫苗。为了评价该疫苗在猪上的安全性,将70~80日龄SPF级中大猪8头随机分为2个组,每组4头。免疫组每头肌内注射2 mL疫苗,对照组为PBS对照组。在免疫前后观察每头猪只体温变化,观察是否有发热、厌食等现象。为了进一步评价疫苗对猪的免疫效力,分别于免疫后7、21、28 d和35 d进行前腔静脉采血,分离血清后利用中和试验测定SVV的中和抗体,利用ELISA方法检测PCV2特异性IgG抗体。
2 结果
2.1 嵌合重组杆状病毒的获得及鉴定 将rFB-P1-PCV2转染sf9细胞,sf9细胞产生细胞病变后,收获培养物上清,并以此感染空白sf9细胞。依照该方法,将重组杆状病毒传至F4代,并对杆状病毒进行荧光检测,如图1所示,结果证明成功获得猪塞内卡谷病毒和圆环病毒2型嵌合重组杆状病毒。

图1 嵌合重组杆状病毒荧光检测(40×)Fig.1 Fluorescence of chimeric recombinant baculovirus (40×)A:对照sf9细胞白光检测; B:F1代杆状病毒白光检测; C:F4代杆状病毒白光检测; D:对照sf9细胞荧光检测; E:F1代杆状病毒荧光检测; F:F4代杆状病毒荧光检测A:White light of control sf9; B:White light of F1 baculovirus; C:White light of F4 baculovirus; D:Fluorescence of control sf9; E:Fluorescence of F1 baculovirus; F:Fluorescence of F4 baculovirus
2.2 嵌合病毒样颗粒抗原蛋白的表达 利用分子筛纯化杆状病毒细胞培养上清液,进行SDS-PAGE检测,结果如图2A所示,结果表明得到了较纯的SVV嵌合病毒样颗粒抗原蛋白。为了进一步验证抗原的免疫原性,采用Western Blot检测抗原蛋白的表达,结果如图2B~2C所示,分别采用SVV高免血清(图2B)和PCV2单克隆抗体(图2C)进行检测,结果表明,在试验组目的大小处均可以观察到抗原蛋白特异性条带,大小约为70 kDa,而阴性对照无对应条带。结果表明试验获得的嵌合病毒样颗粒抗原蛋白得到了良好地表达,并且可以被相应的抗体所识别。

图2 SDS-PAGE和Western Blot检测嵌合病毒感染细胞后培养上清Fig.2 SDS-PAGE and Western Blot detections of cell supernatant post chimeric recombinant baculovirus infectionA:SDS-PAGE结果(M:蛋白标准分子质量; 1:阴性对照; 2:纯化前细胞上清; 3:纯化后细胞上清); B、C:Western Bolt结果(1~2:纯化后细胞上清:3:纯化前细胞上清)A:SDS-PAGE results(M:Protein marker; 1:Negative control; 2:Cell supernatant of pre-purification; 3:Purified cell supernatant); B,C:Western Bolt results(1-2:Purified cell supernatant; 3:Cell supernatant of pre-purification)
2.3 嵌合病毒样颗粒电镜观察 将嵌合重组蛋白经过负染后,在透射电镜下观察结构。SVV病毒颗粒大小为27~30 nm,预估改造后病毒样颗粒大小为30 nm,结果如图3所示,证明嵌合重组蛋白成功形成了病毒样颗粒结构。

图3 猪塞内卡谷病毒样颗粒电镜图(100 000×)Fig.3 Electron micrograph of chimeric virus like particles (100 000×)A:野生型病毒样颗粒; B:嵌合病毒样颗粒A:Wild-type virus like particles; B:Chimeric virus like particles
2.4 嵌合病毒样颗粒疫苗在猪体内安全性评价 检测结果见表2,观察期内免疫猪和对照猪的健康状况良好,未出现发热或其他不良反应,表明该疫苗在猪体内的安全性良好。
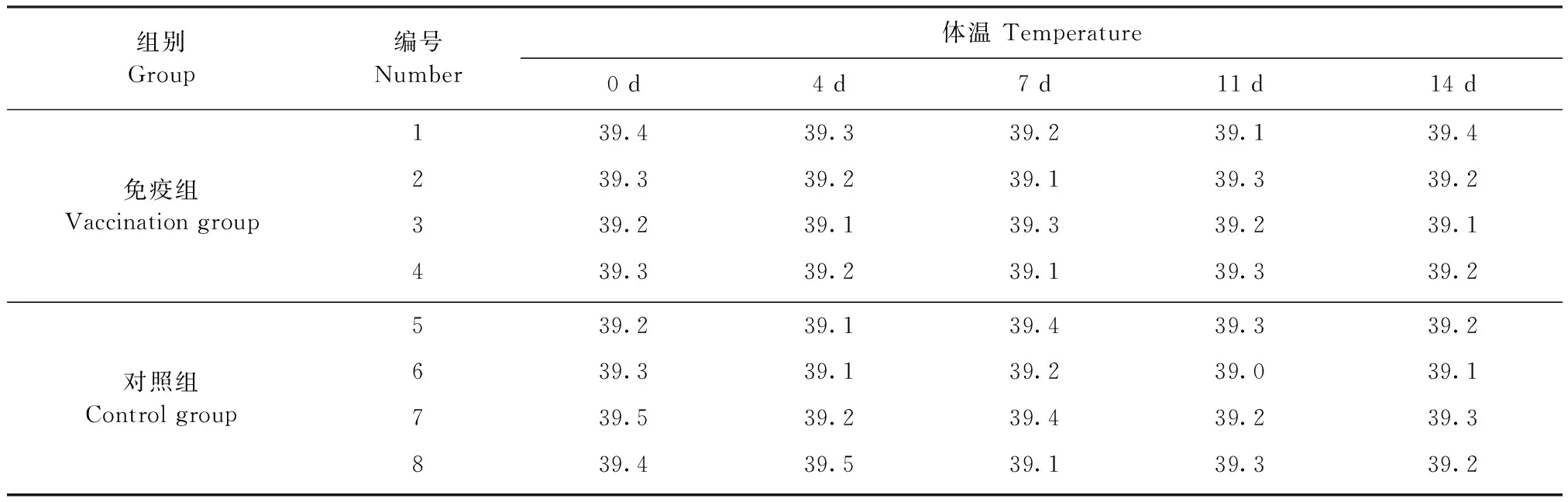
表2 疫苗免疫后猪只体温Table 2 Changes of body temperature in pigs post vaccination (℃,n=8)
2.5 嵌合病毒样颗粒疫苗在猪体内抗体水平检测 SVV中和抗体检测结果见表3,该疫苗具有良好的免疫原性,能够激发机体产生高水平的SVV特异性中和抗体,免疫组中有3头猪只免疫后7 d效价均达到1∶64以上,并且在免疫后35 d仍然维持较高的抗体水平。PCV2的ELISA检测结果如图4所示,相较于对照组,该疫苗能刺激机体产生较高水平的PCV2血清抗体。
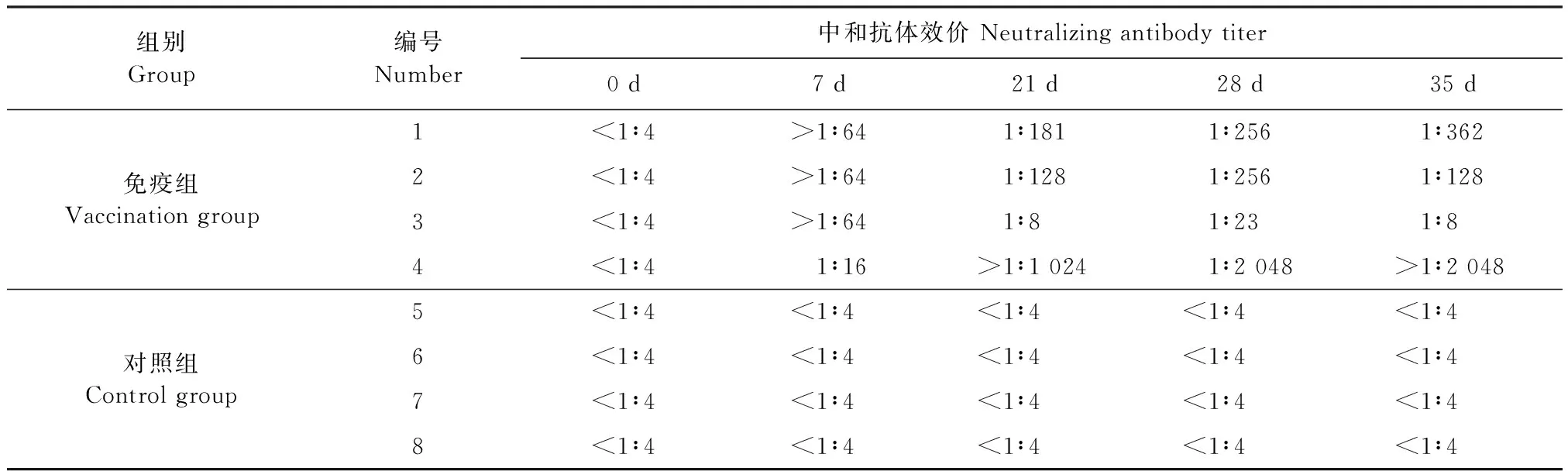
表3 疫苗免疫后猪只SVV抗体情况Table 3 Antibody againgt SVV in pigs post vaccination
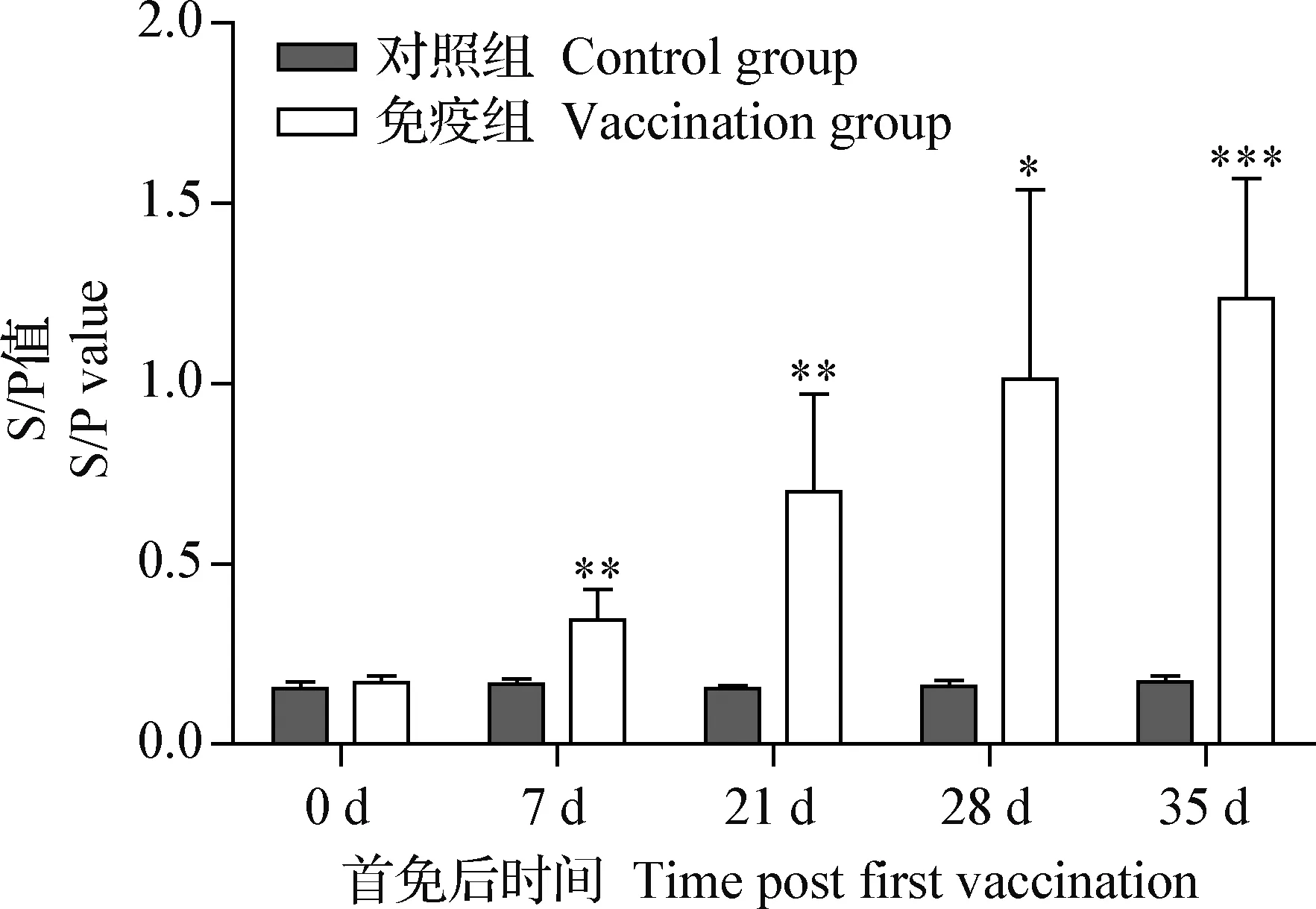
图4 ELISA方法检测PCV2特异性IgG抗体水平Fig.4 Detection of specific IgG antibody against PCV2 by ELISA与对照组相比,*:P<0.05, **:P<0.01, ***:P<0.001Compare to control group, *:P<0.05,**:P<0.01, ***:P<0.001
3 讨论
杆状病毒表达系统安全高效,本试验所表达嵌合病毒样颗粒的抗原成分单一、安全性高,空间结构和功能与天然病毒粒子接近,能够最大程度保留其免疫原性;相较于单价苗或全病毒疫苗,嵌合病毒样颗粒疫苗可以在抗原成分上减少免疫引起的副反应,同时也可以减少疫苗免疫次数,减少人工成本,尽量避免猪免疫过程中的应激反应。
由于SVV VP3蛋白位于病毒核衣壳表面,其蛋白表面具有众多优势抗原表位,因此在本试验中优选VP3蛋白的部分氨基酸序列作为靶序列。与此同时,利用分子生物学预测软件优选获得PCV2 Cap蛋白的B细胞表位,将其用于上述VP3序列的替换,替换完成后经过Pymol软件分析,替换后序列并不会改变VP3蛋白原有的空间结构,因此,在本试验中采取这一方法进行嵌合病毒颗粒的构建。另外,本实验室前期的研究表明,通过杆状病毒表达系统表达SVV病毒的VP0、VP1和VP3蛋白在自然状态下为分泌型蛋白,体外培养条件下可以很好地组装成病毒样颗粒,这一点在本试验中也得到了验证(图3)。
研究表明,体液免疫在机体早期清除猪塞内卡谷病毒过程中起到重要作用[10],而本试验获得的猪塞内卡谷病毒和猪圆环病毒2型嵌合病毒样颗粒疫苗安全性好,且具有良好的免疫原性,可以激活体内产生高水平的中和抗体,效价在免疫后7 d均达到1∶64以上(表3)。另外,该疫苗还可以有效激活产生高水平猪圆环病毒2型特异性IgG抗体,其中免疫后21 d开始IgG抗体维持较高水平(图4)。但在本试验中只是检测了针对2种病毒特异性抗体的表达情况,仍然需要进一步进行攻毒保护试验,从而更好地评价其有效性。另外,在本试验中,动物样本量有限,为了更加准确地评估该嵌合病毒样颗粒疫苗的免疫保护效果,仍然需要扩大免疫动物样本量和疫苗的免疫次数。当前我国猪塞内卡谷病毒疫情呈现点状散发状态,往往和猪圆环病毒病混发,该疫苗的研发为猪塞内卡谷病毒和猪圆环病毒2型的防控提供新的思路。
