牛腺病毒7型、牛支原体和细菌混合感染致外购肉牛呼吸系统疾病的确诊
2022-01-17朱来萍詹建举余桃樱郑碧妞谢佳芮王生奎杨仕标
李 月,朱来萍,陶 松,詹建举,余桃樱,岩 锐,郑碧妞,高 林, 谢佳芮,王生奎,杨仕标,姚 俊
(1.云南农业大学动物医学院,云南 昆明 650201 ; 2.云南省怒江州贡山县动物疫病预防与控制中心,云南 贡山 673500 ; 3.云南省普洱市孟连县农业和科学技术局,云南 孟连 665800 ; 4.云南省怒江州泸水市动物疫病预防与控制中心, 云南 泸水 673199 ; 5.云南省畜牧兽医科学院 云南省热带亚热带动物病毒病重点实验室,云南 昆明 650224)
2017年8月,云南省昆明市寻甸县某养殖户从山东郓城购进30头西门塔尔杂交肉牛,在购进1周后陆续发生以呼吸系统症状为主要特征的疾病。临床症状主要有呼吸急促、浅表,喘息,伴有啰音,偶有咳嗽,眼、鼻脓性分泌物增多,低热(体温39.5~40 ℃),精神委顿,喜卧,食欲减退,反刍停止等,部分牛只伴有腹泻。病理剖检可见患牛气管内有大量灰黄色黏稠分泌物,肺脏严重出血、肉变。发病牛群经抗生素、磺胺类药物、板蓝根及鱼腥草注射液肌注治疗,疗效不佳,随着病程发展开始出现死亡,截至9月末,共死亡25头,仅有5头自然耐过康复,病死率高达83.33%(25/30)。为了尽快查出病因,本试验采集病死牛内脏组织病料进行牛腺病毒7型(BAdV-7)、3型(BAdV-3),牛支原体(M.bovis),牛呼吸道合胞体病毒(BRSV)、牛传染性鼻气管炎病毒(IBRV)、牛流行热病毒(BEFV)、牛副流感3型(BPIV3)及多杀性巴氏杆菌病原检测及序列分析,同时进行了牛支原体和细菌的分离鉴定,以期确诊结果能为将来的防控和治疗提供参考。
1 材料与方法
1.1 材料
1.1.1 样品 病死肉牛的肺门淋巴结、肺脏、脾脏及气管分泌物。
1.1.2 主要仪器和试剂 病毒DNA/RNA提取试剂盒、细菌基因组DNA提取试剂盒、2×Plus Taq酶、DNA Marker DL2 000,均购自天根生化科技(北京)有限公司;生物安全柜为ESCO/CLASS II TYPE A2;PCR 仪Gene Amp PCR System 9700、实时荧光定量PCR仪 7500 FAST SYSTEM及牛传染性鼻气管炎病毒检测商品化试剂盒(VetMAXTMIBR/BHV-1 Reagents),均购自美国应用生物系统公司(Applied Biosystems Inc.);一步法RT-PCR试剂盒,购自宝生物工程(大连)有限公司;支原体筛选培养基(OXOID),购自英国OXOID(Fisher)公司;法国梅里埃细菌生化及药敏鉴定系统(ATB系统)、细菌生化鉴定试条ID 32GN及药敏试条ATB VET,均购自法国生物梅里埃(BioMerieux)生物技术公司;营养琼脂培养基、支原体肉汤培养基、革兰染色液、瑞氏染色液,均购自杭州滨和微生物试剂有限公司;Gibco新生犊牛血清,购自美国赛默飞世尔科技公司(Thermo Fisher Scientific)。
1.1.3 引物 牛支原体16S rRNA基因特异性引物由云南省热带亚热带动物病毒病重点实验室自行设计,委托生工生物工程(上海)技术服务有限公司合成。M.bovis套式引物(P1、P2、P3、P4)、BAdV-7、BAdV-3、BRSV、IBRV、BEFV、BPIV3及多杀巴氏杆菌的检测引物及探针参考文献[1-8]合成(表1),以上引物及探针均分别委托英潍捷基(上海)生物技术有限公司和昆明硕擎生物科技有限公司合成。
1.1.4 实验动物 24只昆明小鼠,购自昆明医科大学实验动物中心;4头5月龄荷斯坦公犊牛,购自昆明市晋宁区某奶牛养殖农民专业合作社。
1.2 方法
1.2.1 样品预处理 取适量病死肉牛病变明显的肺脏、肺门淋巴结及脾脏组织剪碎后加入适量生理盐水充分研磨,移入离心管中反复冻融3次,置于-80 ℃备用;采集病死肉牛气管分泌物装入50 mL离心管中,加入适量生理盐水稀释后充分震荡,反复冻融3次,置于-80 ℃备用。
1.2.2 样品核酸提取 取1.2.1中处理的组织病料匀浆经5 000 g离心10 min后,取上清按照试剂盒说明书进行病毒DNA/RNA提取,取上述上清1.5 mL,11 000 g离心10 min后弃上清,保留离心管底沉淀物按照说明书进行细菌基因组DNA提取,所提取的核酸置于-80 ℃保存。

表1 引物和探针信息Table 1 Primers and probes information
1.2.3M.bovis、BAdV-7、BAdV-3、BRSV、IBRV、BEFV、BPIV3及多杀性巴氏杆菌的PCR检测M.bovis套式PCR及BAdV-7、BAdV-3、BRSV、BEFV、BPIV3、多杀巴氏杆菌的PCR检测方法均参考文献[10-16]中的操作方法进行检测。IBRV检测采用美国Applied Biosystems(AB)公司的VetMAXTMIBR/BHV-1 Reagents商品化试剂盒进行,具体操作方法按照试剂盒说明书进行。
1.2.4 细菌的分离培养、鉴定及昆明小鼠致病性试验 用接种针穿刺病死肉牛的内脏组织(肺脏、淋巴结、脾脏)病料及用接种环挑取气管内分泌物,分别划线接种于血清琼脂平板,于37 ℃含有5% CO2培养箱内倒置培养72 h,每日观察生长情况,如有菌落生长,挑取单个菌落进行纯化培养,纯化后进行革兰染色,并进行生化试验和药敏试验。细菌生化鉴定和药敏试验采用法国梅里埃生化鉴定试纸条ID 32GN和ATB VET。纯化、鉴定出的菌株分别以9.8×108个CFU/只的接种量腹腔接种10只昆明小鼠作为试验组,同时以同等剂量的无菌生理盐水分别接种2只昆明小鼠作为对照组。饲养观察7 d,每天观察记录小鼠的饮食欲和精神状态,以及发病死亡情况。同时剖检病死小鼠,观察记录其内脏组织器官病理变化,并进行接种菌株的回收试验。
1.2.5M.bovis的分离培养及鉴定 用接种环穿刺病料中的肺脏组织及挑取气管分泌物,分别划线接种于支原体固体筛选培养基平板,置于37 ℃含5% CO2培养箱,培养3 d,每日观察菌落生长情况。待菌落长出后挑取单个菌落,划线于固体筛选培养基平板继续进行纯化培养。将牛支原体固体筛选培养基平板上长出的菌落置于光学显微镜下观察其形态,并对菌落进行瑞氏染色镜检、生化鉴定、PCR鉴定和系列分析。牛支原体16S rRNA基因序列扩增25 μL PCR反应体系:2倍PCR预混液2×Plus Taq PCR Master Mix 12.5 μL,上下游引物16S rRNA-MB1697-F、R(10 μmol/L)各1 μL,模板DNA 1 μL,用ddH2O将反应体系补足为25 μL。反应程序:95 ℃ 5 min,95 ℃ 1 min、55 ℃ 1 min、72 ℃ 2 min运行40个循环,72 ℃ 延伸10 min。扩增产物经1.25%琼脂糖凝胶电泳检测。将扩增出目的条带的PCR产物送至昆明硕擎生物科技有限公司进行测序,采用双向测序法测通,将所得到的测序结果通过DNASTAR软件进行校对、拼接,将拼接的结果在NCBI GenBank中进行BLAST比对,同时进行同源性和进化树构建分析。
1.2.6M.bovis本动物回归试验 将分离到的牛支原体菌株液体培养物间隔7 d喷鼻感染2头荷斯坦奶公牛,每次每头牛喷鼻5 mL,连续喷鼻感染4次,同时在0、14 d和45 d行胸腔注射,每次5 mL,接种完后继续饲养观察2个月,每天早晚各测量体温1次,并观察牛只的精神状态和饮食欲情况。同时采用无菌生理盐水以同样的方法喷鼻及胸腔注射接种2头奶公牛作为阴性对照。接种感染试验结束后采集试验组及阴性对照组牛只血清样品检测牛支原体抗体转阳情况。
2 结果
2.1M.bovis、BAdV-7、BAdV-3、BRSV、IBRV、BEFV、BPIV3及多杀性巴氏杆菌的PCR检测 病死犊牛内脏组织(肺门淋巴、肺)和气管分泌物样品的BAdV-3、BRSV、BPIV3、IBRV及多杀性巴氏杆菌PCR检测结果均为阴性。牛支原体巢式PCR外侧引物M.bovis-net-P1、M.bovis-net-P2,内侧引物M.bovis-net-P3、M.bovis-net-P4 PCR分别扩增出约1 912 bp和442 bp大小的特异性条带。同时样品还成功扩增出约775 bp大小的BAdV-7特异性目的条带(图1)。分别将上述PCR产物送测序公司测序,所得序列在NCBI GenBank中进行BLAST比对。结果显示,所得BAdV-7特异目的片段序列与NCBI GenBank中的牛腺病毒7型(登录号:X53989)蛋白酶基因同源性达99%(核苷酸同源性:784/749)。所得牛支原体特异目的片段序列与NCBI GenBank中的Ningxia-1株(登录号:CP023663)、08M株(登录号:CP019639)的同源性达到100%(核苷酸同源性:286/286)。

图1 M.bovis和BAdV-7的PCR检测结果Fig.1 PCR detection results of M.bovis and BAdV-7A:牛支原体引物M.bovis-net-P1、P2扩增结果(N: 阴性对照; P: 阳性对照; S1: 肺脏组织; S2:气管分泌物; M: DNA Marker DL2 000); B:牛支原体引物M.bovis-net-P3、P4扩增结果(N: 阴性对照; P: 阳性对照; S1: 肺脏组织; S2: 气管分泌物; M: DNA Marker DL2 000); C:牛腺病毒7型蛋白酶基因扩增结果(M: DNA Marker DL2 000; N: 阴性对照; S1: 肺脏组织; S2: 牛舌烂斑组织; S3: 气管分泌物)A: PCR results of M.bovis-net-P1/P2 primers(N: Negative control; P: Positive control; S1: Lung tissue; S2: Trachea secretions; M: DNA Marker DL2 000); B: PCR results of M.bovis-net-P3/P4 primers(N: Negative control; P: Positive control; S1: Lung tissue; S2: Trachea secretions; M: DNA Marker DL2 000); C: PCR results of BAdV-7(M: DNA Marker DL2 000; N: Negative control; S1: Lung tissue; S2: Lesions of the tongue; S3: Trachea secretions)
2.2 细菌分离培养及鉴定
2.2.1 细菌分离培养 划线接种肺脏和淋巴结样品的血清琼脂平板,置于37 ℃ 5% CO2培养箱培养24 h后,观察到有2株菌落生长,2株菌株的菌落表面均光滑、湿润,颜色均呈灰黄色但存在一定色差,革兰染色形态观察1株菌体较大(图2A),另1株菌体较小(图2B)。分离到的2株菌革兰染色均为革兰阴性短杆菌(图2)。
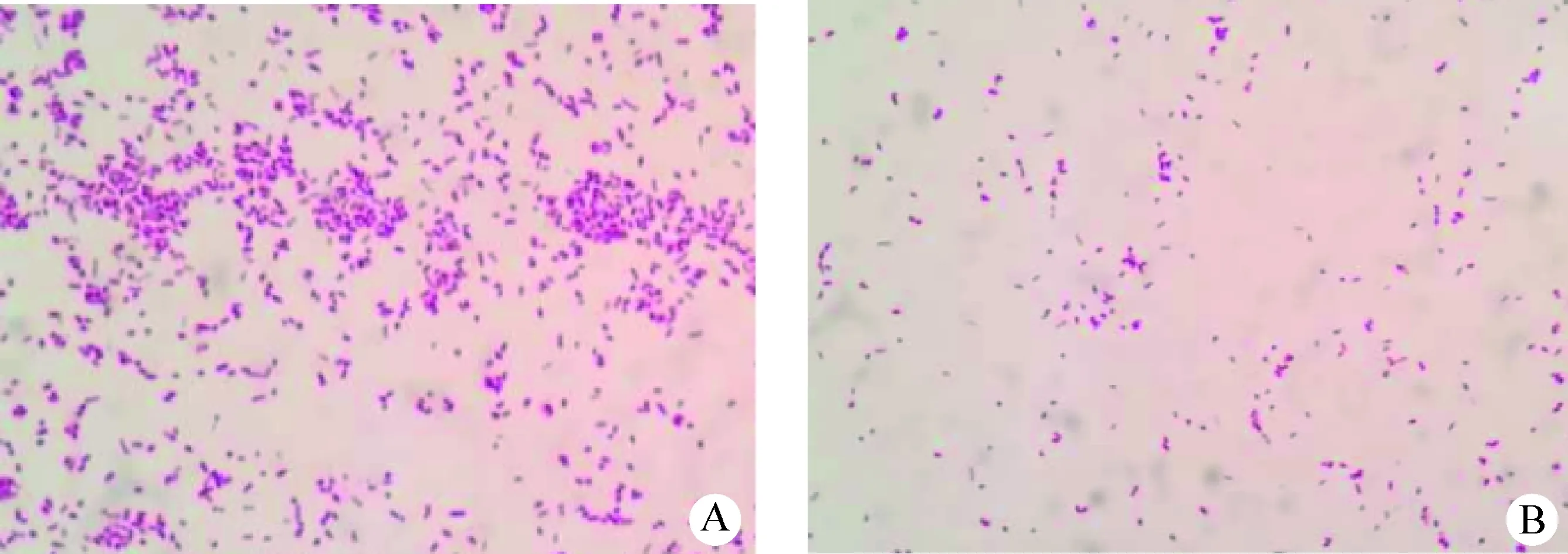
图2 分离菌株革兰染色结果(1 000×)Fig.2 Gram staining results of the isolated bacterial strains(1 000×)A:大菌落菌体形态; B:小菌落菌体形态A: Gram staining of the macrocolony; B: Gram staining of the microcolony

2.2.3 昆明小鼠致病性试验 弗格森埃希菌和克吕沃尔菌属菌株试验组各有2只小鼠于接种36 h内发病死亡,其余8只小鼠在接种6 h后出现精神沉郁、食欲减退和挤堆现象,但72 h后逐渐康复。2个对照组的小鼠精神状态、饮食欲均无异常表现。剖检2只病死昆明小鼠,可观察到心脏出血、肺脏充血出血,胃肠道充血出血及黏膜脱落,肝脏、肾脏及脾脏略微肿大。同时从心血及肝脏组织内回收培养出接种细菌。
2.3 牛支原体分离培养与鉴定
2.3.1 牛支原体分离培养 肉眼可观察到培养基平板上有针尖大小、半透明菌落生长,菌落表面稍干燥、凸起、边缘整齐呈圆形(图3)。将菌落置于正置显微镜下放大观察,可观察到菌落形态为典型的“油煎蛋状”(图4)。

图3 牛支原体分离培养菌落Fig.3 The colonies of M.bovis

图4 牛支原体菌落形态(400×)Fig.4 The colonial morphology of M.bovis(400×)
2.3.2 牛支原体的生化鉴定 挑取支原体固体筛选培养基上纯化培养的牛支原体菌落,接种于细菌微量生化反应管中,培养5 d后,结果显示该菌株不分解葡萄糖、乳糖、甘露醇、精氨酸、二磷酶,不液化明胶,尿素酶阴性,符合牛支原体的基本生化特性,并将该牛支原体云南分离株命名为XDJY-YN-2017株。
2.3.3 牛支原体云南分离株XDJY-YN-2017株的PCR鉴定 刮取菌落提取细菌基因组DNA,用牛支原体引物M.bovis-net-P1、P2,P3、P4 进行套式PCR检测,均扩增出特异目的条带(图5)。

图5 支原体菌落巢式PCR检测结果Fig.5 The nest-PCR results of theM.bovis colonies 1~4:引物M.bovis-net-P3、P4扩增结果; 5~8:引物 M.bovis-net-P1、P2扩增结果; M:DNA Marker DL2 000; 4、8:阴性对照; 1、5:阳性对照; 2、3、6、7:菌落样品 1-4: PCR results with primers M.bovis-net-P3/P4; 5-8: PCR results with primersM.bovis-net-P1/P2; M: DNA Marker DL2 000; 4,8: Negative control; 1,5: Positive control; 2,3,6,7: Colonial samples
2.3.4 牛支原体16S rRNA基因序列PCR扩增 牛支原体云南分离株XDJY-YN-2017株经牛支原体16S rRNA基因序列引物PCR扩增,成功扩增出约1 697 bp大小的特异目的条带(图6)。

图6 牛支原体16S rRNA基因序列PCR鉴定结果Fig.6 The PCR identification result for M.bovis 16S rRNA gene sequenceN:阴性对照; P:阳性对照; S1:气管分泌物; S2:肺脏组织; M: DNA Marker DL2 000N: Negative control; P: Positive control; S1: Trachea secretions; S2: Lung; M: DNA Marker DL2 000
2.3.5 牛支原体16S rRNA基因序列分析及进化树构建 牛支原体16S rRNA核苷酸序列比对分析结果显示,云南分离株XDJY-YN-2017株与以色列2010年的72242株、中国2011年的Ningxia-1株、2010年的HB0801株、2009年的CQ-W70株、2008年的08M株同处于一个进化分支(图7),其16S rRNA序列的1 520个核苷酸完全一致,而模式菌株(Type strain)Donetta株单独处于一个进化分支(图7)。我国2008年的Hubei-1株和2012年的NM2012株同处于一个进化分支(图7)。
所比对的13个菌株16S rRNA核苷酸序列的同源性结果显示,云南分离株XDJY-YN-2017株与以色列2010年的72242株、中国2011年的Ningxia-1株、2010年的HB0801株、2009年的CQ-W70株、2008年的08M株的1 520个核苷酸完全一致,同源性为100%,而与其余菌株的同源性也均在99.7%以上(图8)。Donetta株与其他菌株相比在第2核苷酸位置处有1个碱基A的缺失(图9)。
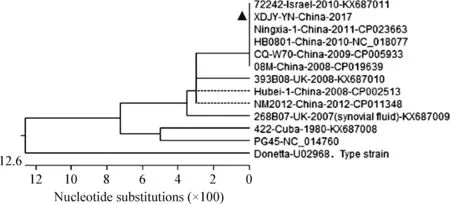
图7 系统发育树Fig.7 Phylogenetic tree▲:牛支原体云南分离株XDJY-YN-2017株;下同 ▲:M.bovis strain XDJY-YN-2017. The same as below

图8 16S rRNA核苷酸同源性Fig.8 16S rRNA nucleotide identity

图9 16S rRNA核苷酸序列比对Fig.9 16S rRNA nucleotide sequence alignment
2.3.6 牛支原体动物回归试验 试验过程中,试验组及对照组牛只临床均无发热现象,也无咳喘等呼吸系统症状,饮食欲正常。最后1次人工感染2个月后,采集血清样品检测牛支原体抗体,结果显示抗体均转阳,而2头阴性对照牛只的牛支原体抗体仍然保持阴性。
3 讨论
牛支原体又称为牛霉形体,是导致牛发生感染的主要病原之一,主要引起牛的呼吸系统疾病,肺脏损伤等,还可引起乳房炎、关节炎和结膜炎[9]。1961年Hale在美国首次从患乳腺炎的病牛牛乳中分离到牛支原体[10],此后该病在多国均有报道,并给畜牧业造成重大经济损失。2008年,石磊等首次在我国湖北从患病犊牛中分离到牛支原体[11],随后国内多地均有报道该病的发生和流行。牛支原体通过呼吸道飞沫传播,也可通过接触乳头、生殖道分泌物或吮乳传播,人工授精和配种也可导致该病的传播、扩散。该病分为最急性型、急性型和慢性型。通常发病牛只精神沉郁,咳嗽,采食量下降,体温升高至40~42 ℃,有脓性分泌物从眼鼻流出,呼吸频率加快,表现为呼吸急促,呼吸困难,胸部听诊有箫笛样啰音[12]。本试验从病死犊牛肺脏组织病料及气管黏性分泌物中检测出牛支原体核酸阳性,并从上述2种病料中成功分离出牛支原体,提示牛支原体均大量存在于肺脏组织及气管分泌物,并可通过呼吸系统分泌物向外扩散传播。为了弄清楚XDJY-YN-2017株的致病性,本试验还开展了本动物回归试验。因肉牛和奶牛对牛支原体最易感,本次试验选用牛支原体抗体阴性的5月龄荷斯坦公犊牛作为试验动物,结果显示,喷鼻和胸腔注射能够让试验犊牛的牛支原体抗体转阳,但试验期间未出现明显的临床症状,提示牛支原体为条件性致病性病原体。
牛腺病毒属腺病毒科哺乳动物腺病毒属,国际病毒分类学委员会确认腺病毒有10个血清型,即BAdV-1~BAdV-10[13],主要引起犊牛的肺炎和肠炎,其中BAdV-7的致病性最强,感染牛出现40 ℃以上的稽留热、肺炎和严重下痢[4]。这10个血清型在不同的国家已被分离到[14],目前,牛腺病毒已呈世界性分布,给很多国家造成严重的经济损失。BAdV-7的原型株Fukuroi株在1768年被日本的Inabay等从发热、腹泻和气喘的母牛血液中分离到[4],在国外BAdV-7已被列为引起犊牛肺炎和肠炎重要病原之一[4]。BAdV-7的发病牛和隐性感染牛都是该病的传染源,1~4周龄犊牛感染本病表现为结膜炎、肺炎、肠炎、腹泻和多发性关节炎。病犊牛体温升高,食欲减退或废绝,呼吸加快。发病率达70%~80%,死亡率低,与其他病原混合感染时会加大死亡率。成年牛感染无临床症状。本病主要经呼吸道和消化道感染,病毒在体内主要侵害血管,引起呼吸道和消化道为主的疾病。牛腺病毒在室温可存活1~4个月,对干燥和冻融有抵抗力,对乙醚、氯仿、去氧胆酸钠有抵抗力,可耐受pH 3~9,pH 2及以下病毒失活,70 ℃ 1 min可被灭活[15]。截止到2017年,我国还没有关于牛腺病毒7型的分离报道,本试验从有严重呼吸道症状的犊牛气管分泌物和内脏组织(肺、淋巴结、脾)中检测出腺病毒7型,说明该病毒在我国牛群是存在的。牛腺病毒7型在10个血清型中致病性最强,近年来,我国养牛业不断发展,疾病传播的可能性也不断加大,所以必须要高度重视腺病毒7型对养牛业的危害,在育种时一定要优选优育,从国外或国内其他省份购买牛时,也要高度重视该病的流行及自然感染带毒情况。本试验虽然尝试了牛腺病毒7型的分离、培养,但可能由于病料采集时机不佳,病料中活病毒含量太低或者病毒对培养细胞不够敏感等原因,导致病毒分离培养失败。
牛群一旦感染牛支原体后就很难被清除,感染牛支原体的病牛会长时间带菌,并向外界环境排放支原体,感染牛支原体后牛的机体免疫力和抵抗力会急剧下降,容易增强继发感染或混合感染的病原菌毒力[16]。国外报道,牛支原体易与溶血性巴氏杆菌、副流感病毒、呼吸道合胞体病毒、牛传染性鼻气管炎病毒等发生混合感染,国内发病牛易与泰勒虫发生混合感染,本试验检测出牛支原体与腺病毒7型混合感染,提示能与牛支原体混合感染的病原体还有很多。本试验对云南部分地区的牛支原体血清抗体进行初步调查,无临床症状的牛群中牛支原体血清抗体阳性率达9.52%,提示牛支原体在无临床症状的牛群中还是存在的。很多感染牛支原体的牛只并未表现出明显临床症状,仅是偶尔咳嗽,饮食欲、精神状态及体温均正常,但牛支原体会破坏机体的免疫系统,携带牛支原体的牛群在应激状态下很容易被其他病原攻破机体的免疫防线,造成疾病的发生。感染牛不断向外界排放牛支原体,很多刚出生的犊牛就容易被感染,如果有其他应激原的存在或其他疫病侵袭,就会造成犊牛大规模发病,甚至发生死亡。虽然牛支原体致病力不强,但其在牛群中的危害不可小觑,当牛群中出现感染牛支原体的病牛时,应及时将其隔离,并做好消毒工作,防止扩散。此外,本试验采集的5份寻甸病牛血清,牛支原体抗体检测均为阳性,说明该养殖户的病牛确实感染了牛支原体,且在长途运输应激下,导致免疫力低下继发感染牛腺病毒7型,最终导致了本次疫情的发生。
为了了解细菌致病及继发感染情况,本试验同时也开展了细菌的分离培养工作,成功分离、鉴定出弗格森埃希菌及克吕沃尔菌属各1株。昆明小鼠的致病性试验结果显示,2株分离菌株具备较弱的致病力,推断为继发感染菌株。
随着我国养牛业的不断发展壮大,经常跨地区、跨国界引进牛群,这不仅会引入许多外来动物传染病,同时由于长途运输应激,牛群免疫力下降,更易发生常见牛传染病的混合感染。有研究发现,牛支原体在混合感染的病原中起主导作用,长途运输、环境条件和饲草饲料等应激因素的改变是牛支原体感染发病的诱因。该养殖户从山东购进的犊牛大量发病死亡,推断极有可能是牛群存在牛支原体及牛腺病毒7型的原发感染,加上长途运输、气候、饲养环境及饲草饲料改变等应激,牛群免疫力下降,最终导致混合感染多种病原体后发病死亡。所以,从异地引进牛群时,要重视牛群的健康状况,在运输及饲养过程中尽量减少应激,方能提高外购牛只的成活率。
