不同大豆品种根瘤菌AFLP分析
2022-01-17姚玉波马春梅龚振平柴永山
姚玉波 马春梅 龚振平 柴永山
(1.黑龙江省农业科学院博士后科研工作站, 哈尔滨 150086;2.黑龙江省农业科学院经济作物研究所, 哈尔滨 150086;3.东北农业大学 农学院, 哈尔滨 150030;4.黑龙江省农业科学院, 哈尔滨 150086)
大豆原产于中国,我国种植大豆已有4 700多年的历史.大豆作为重要的粮食作物和油料作物,是我国重要的战略物资.黑龙江省是我国最主要的春大豆产区,是我国重要的大豆生产和供给基地,2019年种植面积达到6 419万亩,占全国种植面积的45.9%,种植面积和产量均居我国首位.
根瘤菌(Rhizobium)是一类栖生于土壤中的革兰氏阴性细菌,通过侵染大豆根系形成共生结构-根瘤,进而进行生物固氮作用,把空气中的游离氮固定转化为含氮化合物,为大豆提供氮素营养,起到培肥地力,提高产量和改善品质的作用[1-2],是重要的农业资源之一.我国复杂的生态环境孕育了丰富的根瘤菌资源,学者从20世纪30年代开始研究大豆根瘤菌,根瘤菌除了与大豆共生发挥固氮作用,已经有越来越多的其他重要功能被逐渐发现和利用[3-4],如产生B 族维生素[5]、降解环境中的有机污染物[6]等,根瘤菌被认为是重要的资源微生物.
豆科植物与根瘤菌的共生固氮作用是己知固氮量最高的生物固氮体系,能够提供生物固氮总量的一半以上[7],而且具有效率高、低能耗、绿色、无污染等优点.生物固氮作用是仅次于光合作用的重要生物化学反应,在自然界氮素循环中具有极其重要的作用,是生物生存和繁衍不可或缺和可持续供应的还原态氮化物的源泉[8].
利用传统方法研究微生物主要是对目标样品进行分离培养,获得单菌株,但由于很多微生物是不能够被分离和培养的[9-10],因此传统方法分析微生物的多样性具有一定的局限性.随着根瘤菌属和种数量的不断增加,说明与大豆共生的根瘤菌也不例外.而不经过传统方法培养,直接从样品中提取总DNA,以此为研究对象进行目标片段的PCR 扩增,分析和鉴定产物组成的多态性,可以更准确地反映微生物的原始组成情况和群落特点[11].扩增片段长度多态性(amplified fragment length polymorphism,AFLP)在检测DNA 多态性方面,具有可靠性和高效性的优点,成为分类和遗传多样性研究中的有力工具[12-15].因此,本研究以根瘤菌总DNA 为研究对象,以4 个大豆品种为试验材料,利用AFLP 技术探究不同生育时期与大豆共生根瘤菌的多样性差异,为进一步开展大豆根瘤菌的研究提供参考.
1 材料与方法
1.1 供试材料
选用4个大豆品种,包括在哈尔滨生育期不同的3个品种:黑河41(HH41)、绥农14(SN14)和黑农40(HN40),及1个饲料大豆品种:秣食豆(MSD).
1.2 试验设置
以适合田间生产为前提,土壤为黑土,采取框栽种植方式,基础肥力见表1.

表1 土壤基础肥力
框栽材料和规格:硬化塑料材质的无底圆框,直径38 cm,深30 cm,每框装土质量约35 kg,埋土深度27 cm,露出地表3 cm.圆框采取两框并排排列,两行间无间距,在两侧各设两框做为保护行.
施肥处理:施肥量与哈尔滨地区生产上采用的施肥量保持一致,氮肥150 kg/hm2,磷肥150 kg/hm2,钾肥90 kg/hm2.按每框的面积换算施肥量,以种肥的形式施入.氮肥:硫酸铵(N:21%)每框1.70 g,磷肥:重过磷酸钙(P2O5:46%)每框1.70 g,钾肥:硫酸钾(K2O:50%)每框1.02 g.
播种:采用穴播方式,每穴播3粒种子,播后覆土3~4 cm,齐苗后定苗.每框保苗3株.
取样时间:苗期(V4),盛花期(R2),鼓粒期(R6).
取样方法:将根系尽量完整取出,用蒸馏水冲净,摘下根瘤,并保证根瘤完整,用锡纸包裹放入液氮中冷冻,于—80℃冰箱中保存,待提取根瘤菌DNA.
1.3 试验方法
1.3.1 根瘤菌DNA 的提取
根瘤表面灭菌,用蒸馏水冲洗干净,放入1.5 m L的离心管中,具体方法参照陈强等方法直接从根瘤中提取根瘤菌DNA[16].
1.3.2 扩增片段长度多态性(AFLP)分析
限制性酶切、连接,预扩增和选择性扩增等过程所需的限制性核酸内切酶、T4 DNA 连接酶、接头、引物等均来自Invitrogen 试剂盒(AFLP Analysis System for Microorganisms AFLP Microorganism Primer Kit Cat.Nos.11352-010 and 11353-018 Invitrogen).具体方法参照试剂盒说明书进行.
6%变性聚丙烯酰胺凝胶垂直电泳(DYCZ-28D),电泳板厚1.0 mm.将10×TBE 缓冲液稀释至1×,电压200 V,预电泳20 min,上样量20μL,电泳至2/3处.100 bp DNA Ladder Marker(TaRa Ka).电泳结束后,采用银染方法进行染色:取完整胶,在摇床上操作,蒸馏水清洗3次,每次5 min;250 m L 固定液,轻摇15 min,再用蒸馏水清洗2次;250 m L 银染液,轻摇15 min,再用蒸馏水清洗2次;250 m L 显色液,直至可见清晰的条带.染色后,利用Champ Gel 6000凝胶成像分析系统成像,获得AFLP图谱照片.
1.4 数据处理与分析
根据图谱照片,针对每对引物扩增结果,有条带的记为“1”,无条带的记为“0”,构建初始数据矩阵.利用软件(NTSYSpc 2.1)计算遗传相似系数,计算公式为:Cij=2a/(2a+b+c)(其中a是i个体和j个体所共有的位点数目,b和c分别为i个体和j个体分别具有的位点数目),平均连锁法(UPGMA)聚类分析,获得聚类图谱.
2 结果与分析
2.1 DNA提取检测
琼脂糖凝胶电泳检测(0.8%)表明,提取得到的DNA 条带清晰,没有出现降解现象,无RNA 污染,OD260/OD280的检测值1.8左右,可见提取的DNA纯度和浓度均较高,符合AFLP 分子标记的要求,可用于进一步的酶切和连接试验(如图1所示).
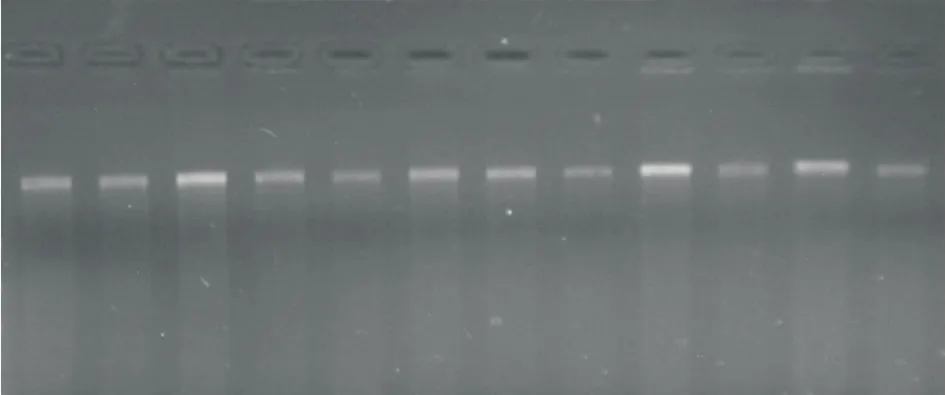
图1 DNA 电泳检测
2.2 预扩增和选择性扩增结果
预扩增是起承上启下作用的一个中间过程,既可检测酶切和连接反应结果,又会对进一步的选择性扩增结果产生影响.因此,对预扩增结果的检测是必不可少的一个步骤,其标准是扩增产物在凝胶中分散并比较均匀地连续一片(smear).经检测表明,预扩增产物呈弥散型分布,预扩增产物片段主要分布在100~2 000 bp,可见获得的预扩增产物能否达到下一步试验的要求,可作为选择性扩增的模板(如图2所示).
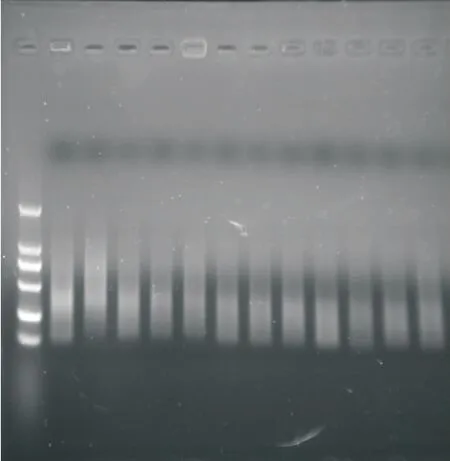
图2 预扩增产物电泳图
选择性扩增产物经检测,呈现均匀的弥散型分布,不同引物组合间弥散的范围略有不同,选择性扩增产物用于进一步聚丙烯酰胺凝胶电泳检测分析(如图3所示).

图3 选择性扩增电泳图(引物组合E-A/M-C)
2.3 AFLP结果
通过预试验对条带清晰度和多态性进行筛选,得到5对符合要求的引物,进一步对不同大豆品种不同生育时期的12个根瘤DNA 样品进行AFLP 扩增.结果表明,5对引物组合扩增的位点数量、多态性位点数量和多态性位点百分率存在明显差异,分别为79(E-A/M-C)-142(E-A/M-T)个、52(E-T/M-A)-121(E-G/M-T)个和46.43%(E-T/M-A)-90.98%(E-G/M-T)(见表2).
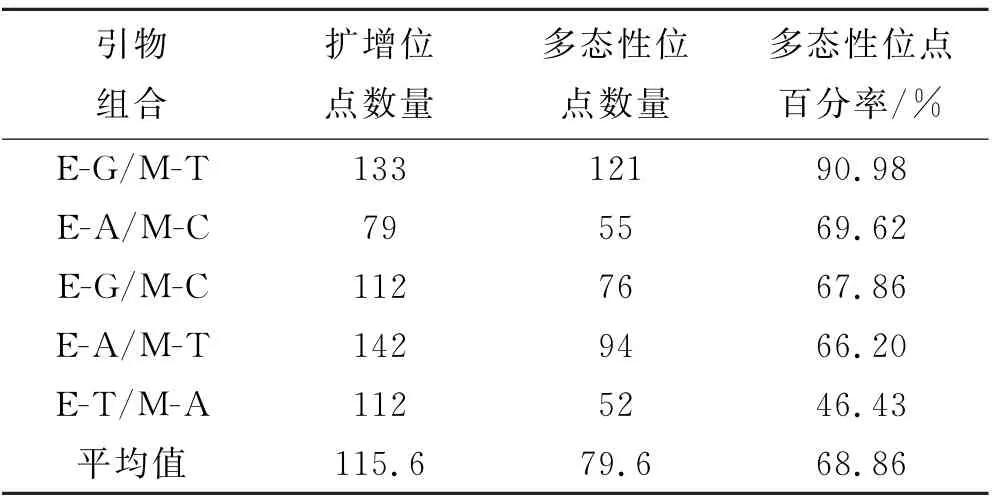
表2 5对引物AFLP扩增结果
对选择性扩增获得的产物,利用6%聚丙烯酰胺凝胶进行检测,银染后结果表明,扩增得到的条带清晰、易于分辨,表现出较好的多态性(图4为引物组合E-A/M-C).
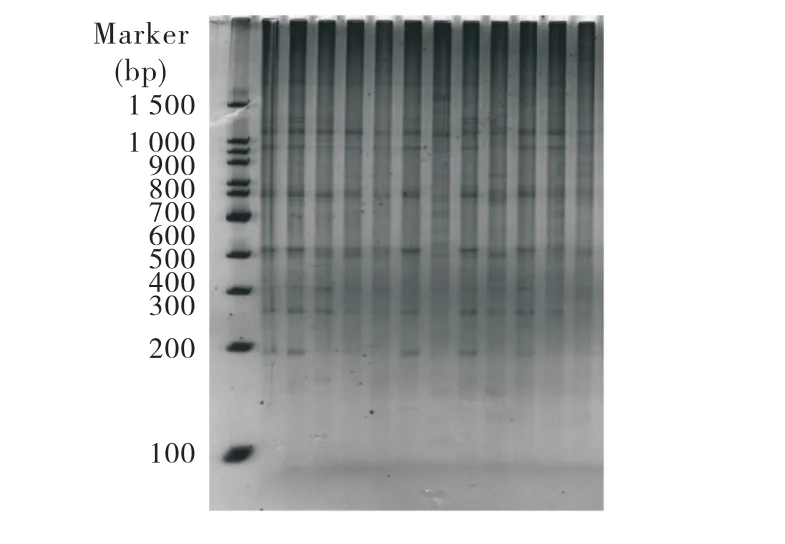
图4 AFLP扩增图谱(引物组合E-A/M-C)
2.4 聚类分析
基于遗传相似系数,利用NTSYSpc 2.1软件,以平均连锁法UPGMA 对12份材料进行聚类分析,在相似系数为0.68处,将不同大豆品种不同生育时期的根瘤菌划分为4大类,Ia包括黑河41苗期(V4),绥农14苗期(V4)和黑河41盛花期(R2),Ib包括黑农40苗期(V4),秣食豆苗期(V4)和秣食豆盛花期(R2);第二类中包含2个部分,IIa包括黑农40盛花期(R2),IIb包括黑河41鼓粒期(R6),黑农40鼓粒期(R6)和秣食豆鼓粒期(R6);第三类为绥农14盛花期(R2);第四类为绥农14鼓粒期(R6).

图5 不同品种大豆根瘤菌聚类分析
3 讨 论
根瘤菌侵染大豆根系形成共生结构-根瘤,能够把空气中游离的氮固定转化为含氮化合物,为大豆植株提供氮素营养,是大豆生长发育和产量形成的重要氮素来源,在大豆的重要发育阶段,根瘤所固定氮素的积累量占全部氮素积累量的比例可以达到60%以上[17].可见,根瘤菌通过与大豆根系的共生,利用固氮作用所产生的氮素在大豆生长发育和产量形成过程中所发挥的重要作用.从研究人员发现豆科植物能够与根瘤菌共生并能够结瘤固氮开始,已经有一百多年的时间,在此期间众多学者和科研工作者开展了大量与豆科植物根瘤和固氮相关的研究工作.
龚振平等研究发现,大豆氮素营养的变化随着生育进程的推进呈现出时期性的特点,来源于土壤氮和肥料氮所占比例逐渐降低,根瘤固氮所占比例逐渐上升,在4片复叶期(V4)至初花期(R1),是根瘤固氮快速增加的时期;营养生长和生殖生长并行期(R1-R5),氮素营养主要来自土壤氮和根瘤固氮;生殖生长阶段(R5-R8),是根瘤固氮营养期[18].陈慧等研究表明,大豆根瘤固氮酶活性和固氮量均存在品种间的差异,生育期短的大豆品种根瘤固氮酶活性高于生育期长的大豆品种,根瘤固氮潜力则随着大豆品种生育期的延长而增加[19].由以上研究结果可以发现,大豆根瘤固氮作用存在的差异因不同品种和不同生育时期而异,目前研究多是针对根瘤固氮量、根瘤固氮率和固氮酶活性方面的变化,而本研究是以与大豆共生的全部根瘤菌作为研究对象,不进行培养,直接从根瘤样品中提取根瘤菌总DNA,分析与大豆共生的根瘤菌差异,以期为进一步探讨大豆与根瘤菌的共生关系奠定基础.
遗传多样性是物种通过长期进化的过程而产生的结果,是指不同种群之间、以及同一种群内的不同个体之间的遗传变异,反映生物个体中蕴藏的遗传信息的总和[20],是生物生存、发展和进化的前提[21].随着分子生物学技术的不断推进和发展,更加有利于生物遗传多样性的研究,为其检测提供了更加直接和准确的方法[22],通过分析某些特定基因或核苷酸序列,从而估计整个基因组的变异性[23].AFLP 作为一项高效、可靠的分子标记技术,是生物分类和遗传多样性研究中使用较多的有力工具[12],能够准确地反映物种间的遗传变异情况及亲缘关系远近等重要信息[22].国内外学者利用该项技术在豆类、玉米、水稻、拟南芥、花生等作物中已经获得了大量的研究成果[14-15,24-26].本研究利用AFLP 分析试剂盒,对提取的DNA 进行酶切、连接、预扩增和选择性扩增(图1~3),利用筛选获得的5个引物组合,在4个大豆品种的3个生育时期的12个根瘤样本的DNA 样品获得了清晰的AFLP指纹图谱(图4),共扩增出位点578个,其中多态性位点398个,平均多态性位点百分率68.86%,可见AFLP技术可以应用到不同大豆品种不同生育时期根瘤菌差异比较方面的研究.
扩增片段长度多态性在检测DNA 多态性方面,非生物因子和生物因子都可能对根瘤菌的多样性、群落组成等产生影响[27].Wang等研究表明,环境因子(湿度、温度、间作、土壤以及营养)与菜豆根瘤菌的多样性和分布密切相关,此外,土壤的酸碱度、有效氮和有效磷含量也是影响菜豆根瘤菌分布的主要土壤因素[28].Yan等人研究发现,大豆根瘤菌的分布、丰度和固氮效率主要与大豆的基因型和品种、纬度和土壤环境(如有机酸含量、p H、有效磷和其他因子)有关[2].本研究在相同的土壤条件下对12份根瘤菌材料研究发现,在相似系数为0.68处,12份材料可划分为4大类.其中第一类中包含6份材料,集中了4个大豆品种的苗期、黑河41盛花期和秣食豆的盛花期,由于黑河41在哈尔滨地区的生育期较短,进入花期的时间要早于中熟和晚熟品种,秣食豆作为饲料大豆,生育进程和与根瘤菌的共生关系可能与其他品种存在差异;第二类中包含4份材料,集中了黑农40盛花期和鼓粒期,黑河41鼓粒期和秣食豆鼓粒期,可以看出,此类中以不同品种鼓粒期与大豆共生的根瘤菌为主,由于黑农40的生育期较长,因此盛花期共生的根瘤菌也聚在这一类;第三类和第四类均各包含一份材料,分别为绥农14盛花期和绥农14鼓粒期,可见与绥农14共生的根瘤菌与其他品种存在较大差异,绥农14可以作为与根瘤固氮作用相关研究的候选材料,为后续研究提供材料基础.本研究结果与前人的研究结果有共同之处,即与大豆共生的根瘤菌品种间存在差异,同时发现根瘤菌的组成与大豆的生育时期存在一定的相关性,这可能与多种因素相关,有待开展进一步的研究.
随着测序技术和基因组学研究的快速发展,许多新的分子标记技术用于细菌分类和鉴定,16S r RNA基因序列分析、多位点序列分型(MLSA)等应用,结合根瘤菌类系统的不断补充和完善,取得的一系列研究结果有力地推动了根瘤菌基因组学的发展[29-30],为本研究结果基础上开展差异根瘤菌挖掘、分类、鉴定、共生固氮机制等更深入的研究提供了有力支撑.
4 结 论
筛选出的5对引物组合从4个大豆品种3个生育时期的12份根瘤菌材料中共扩增出578个位点,每个引物组合平均扩增位点115.6 个,多态性位点398个,平均多态性位点百分率68.86%.基于遗传相似系数,对12份材料的UPGMA 聚类分析共划分为4大类,与大豆品种类型和生育期相关,第一类为黑河41苗期(V4)、绥农14苗期(V4)、黑河41盛花期(R2)、黑农40苗期(V4)、秣食豆苗期(V4)和秣食豆盛花期(R2);第二类为黑农40盛花期(R2)、黑河41鼓粒期(R6)、黑农40 鼓粒期(R6)和秣食豆鼓粒期(R6);第三类为绥农14盛花期(R2);第四类为绥农14鼓粒期(R6).
