牙髓干细胞来源凋亡小体调节巨噬细胞极化及炎症反应
2022-01-17宫晟凯杨晓姗窦庚李子涵刘思颖王玮刘世宇
宫晟凯,杨晓姗,窦庚,李子涵,刘思颖,王玮,刘世宇
1.第四军医大学基础医学院,陕西 西安(710032);2.军事口腔医学国家重点实验室,国家口腔疾病临床医学研究中心,陕西省口腔疾病国际联合研究中心,第四军医大学口腔医院组织工程中心,陕西 西安(710032);3.军事口腔医学国家重点实验室,国家口腔疾病临床医学研究中心,陕西省口腔医学重点实验室,第四军医大学口腔医院牙体牙髓病科,陕西 西安(710032)
近年来,口腔组织来源的间充质干细胞(mesenchymal stem cells,MSCs)在炎症调节及组织再生中得到了广泛的应用[1-2],其中,牙髓干细胞(dental pulp stem cells,DPSCs)因具有高增殖活性、多项分化潜能[3]以及免疫调节能力[1],成为细胞移植治疗的重要细胞来源。细胞移植入宿主体内可通过分化和释放活性因子发挥治疗作用。然而,细胞移植治疗的机制,尤其是细胞移植后在宿主组织中的高比例、迅速的凋亡[4-6]和其产生疗效之间的“矛盾现象”尚未阐明。细胞凋亡过程中可释放一种特殊的细胞外囊泡即凋亡小体(apoptotic bodies,ABs),前期研究发现ABs不仅是细胞凋亡产生的废物,还可调控机体骨稳态[7]、代谢稳态[8]、以及组织再生过程中的血管化[6]。本实验拟通过观察DPSCs在凋亡过程中释放的ABs对巨噬细胞极化和炎性因子释放的影响,并利用小鼠皮肤创伤模型和葡聚糖硫酸钠结肠炎模型,探讨ABs对炎症调节和组织再生的作用及其机制。
1 材料和方法
本实验人DPSCs的使用以及动物实验操作均已得到了第四军医大学口腔医院医学伦理委员会以及第四军医大学动物伦理委员会的批准。
1.1 DPSCs的分离培养与鉴定
采用组织块法培养原代细胞,并将得到的人牙髓干细胞,接种于培养瓶中,在37℃、5%CO2的孵箱中培养,使用含有10%胎牛血清(Gibco,美国)、2 mM L-谷氨酰胺(Invitrogen,美国)和1%青霉素-链霉素(Invitrogen,美国)的α-MEM(Gibco,美国)培养基进行培养。本实验所用细胞均为第3代或第4代细胞。
采用流式细胞术对DPSCs表面标记物进行鉴定,包括PE标记的CD90(eBioscience,美国)、CD105(BioLegend,美国)、CD45(BioLegend,美国)和FITC标记的CD73(BioLegend,美国)、HLA-DR(eBioscience,美国)。用CytoFLEX流式细胞仪(Beckman Coulter,美国)进行检测。另外,对DPSCs进行克隆形成实验、成脂分化能力检测(油红O染色)以及成骨分化检测(茜素红S染色)。
1.2 DPSCs来源的ABs的分离提取及鉴定
DPSCs增殖到80%~90%时,加入0.1μM凋亡诱导剂星孢菌素(Cell Signaling Technology,美国)作用12 h。收集上清液,800 g离心10 min,去除沉淀,上清转移至新的离心管,16 000 g离心30 min收集沉淀即为ABs。通过扫描电镜(scanning electron microscope,SEM)和动态光散射分析(dynamic light scattering,DLS)观察ABs的形态及粒径分布。使用凋亡检测试剂盒(七海生物,中国)检测ABs表面Annexin V阳性率,使用流式细胞仪(Beckman Coulter,美国)进行分析量化。
1.3 骨髓来源巨噬细胞的分离培养及分组
取C57BL/6小鼠股骨、胫骨,用预冷PBS冲洗骨髓腔获得骨髓单细胞悬液。添加巨噬细胞集落刺激因子(M-CSF,Peprotech,美国)(20 ng/mL),接种于细胞培养板中。体外实验分组为对照组、LPS组以及LPS+ABs组,分别对巨噬细胞施加溶剂对照处理、LPS处理、LPS+ABs共处理。
1.4 小鼠皮肤创伤模型的建立及分组
C57BL/6小鼠创面大小为直径1 cm的圆形。将小鼠分为3组,分别为PBS组、DPSCs组以及ABs组,分别于0 d和3 d通过尾静脉注射DPSCs单细胞悬液(5×106个/mL),或DPSCs来源的ABs(200 μg/只),每只小鼠注射总量为100μL,PBS组注射等体积的PBS缓冲液。
1.5 葡萄糖硫酸钠(dextran sulfate sodium,DSS)诱导小鼠结肠炎模型的建立及分组
将雌性C57BL/6小鼠连续10 d通过饮水给予2.5%(w/v)的DSS(MPBiomedicals,美国)。将小鼠分为PBS组、DPSCs组以及ABs组,分别于3 d、5 d和7 d对小鼠尾静脉注射DPSCs单细胞悬液(5×106个/mL)或DPSCs来源的ABs(200μg/只),每只小鼠注射总量为100μL,PBS组注射等体积的PBS缓冲液。
1.6 Western blot检测凋亡通路蛋白Caspase-3裂解片段的表达
使用Bio-Rad电泳系统(Bio-Rad,美国)进行蛋白电泳,电泳结束将蛋白转移至PVDF膜,脱脂牛奶室温封闭2 h,4℃过夜孵育一抗工作液(1∶800)(Caspase-3,9662,Cell Signaling Technology;Cleaved Caspase-3,9661s,Cell Signaling Technology;GAPDH,30201ES20,YEASEN)。TBST洗膜3次,室温孵育二抗1 h。TBST洗膜3次后,加入显影液,化学发光检测系统曝光成像(Tanon4600,中国)。
1.7 免疫荧光染色观察ABs内吞与巨噬细胞M2型极化
收集细胞爬片/组织切片进行免疫荧光染色,4%多聚甲醛溶液4℃固定过夜。置于0.1%Triton X-100溶液室温通透细胞/组织15 min,山羊血清封闭30 min(37℃),过夜孵育一抗工作液(1:400)(F4/80,ab6640,Abcam;CD206,ab125028,Abcam)。PBS洗3次,37℃孵育荧光二抗1 h,PBS洗3次,Hoechst(Sigma-Aldrich,美国)染核10 min,PBS洗3次,80%甘油封片。激光共聚焦荧光显微镜成像,拍照。
1.8 ELISA检测巨噬细胞培养上清及皮肤组织匀浆中细胞因子水平
细胞培养上清样品制备:收集巨噬细胞培养上清,4 000 rpm离心10 min去除沉淀。皮肤组织匀浆制备:取适量皮肤组织,用预冷PBS清洗后剪碎,将组织块转移入匀浆机(IKA,美国)进行充分研磨,得到的匀浆液用超声破碎仪进一步破碎。按照ELISA试剂盒(欣博盛,中国)说明书操作步骤操作,并以标准品浓度为纵坐标,以其对应吸光度值为横坐标绘制标准曲线,计算各孔细胞因子(TNF-α、IL-6、TGF-β)的浓度。
1.9 疾病活动指数(disease activity index,DAI)与组织学病理评分
DAI评分为体重下降分数、粪便性状分数和便血分数的总和,总分为12分,分值越大代表疾病越严重。实验结束后取结肠组织,测量结肠长度并进行H&E染色,按照炎症浸润和上皮损伤程度进行组织学病理评分(histological activity index)。具体评分如下:炎症浸润严重程度=0分(无),1分(轻度),2分(中度),3分(重度);炎症浸润程度=0分(无),1分(黏膜),2分(黏膜及黏膜下层)3分(透过黏膜);隐窝损伤=0分(无),1分(杯状细胞少量损失),2分(杯状细胞大量损失),3分(杯状细胞的大量损失,隐窝少量损失),4分(杯状细胞完全损失,隐窝大量损失)。
1.10 统计学分析
应用SPSS 19.0软件对数据进行统计学分析,结果均采用平均值±标准差()表示。Graph-Pad Prism 8.0软件绘制统计图。多组数据间比较采用单因素方差分析(one-way ANOVA),以Tukey进行两两比较,P<0.05为差异有统计学意义。
2结果
2.1 DPSCs及其来源的ABs的分离鉴定
流式细胞术检测结果显示,培养纯化后的DPSCs阳性表达间充质干细胞的表面标志物CD90(99.8%)、CD73(99.5%)和CD105(95.8%),而不表达HAL-DR和CD45(图1a)。另外,本实验检测了DPSCs的克隆形成能力和多向分化能力。培养14 d后,可以观察到蓝紫色细胞克隆(图1b)。DPSCs成脂诱导后进行油红O染色,显微镜下可观察到红色脂滴(图1c),经成骨诱导后的茜素红染色显示明显的矿化结节(图1d)。以上结果说明分离培养的DPSCs表面标志物符合间充质干细胞特征,并具有成脂和成骨分化潜能。
DPSCs来源的ABs的扫描电镜结果显示ABs形貌成球状(图1e),粒径分布范围在300~900 nm区间内,平均直径为(634.3±42.4)nm(图1f)。另外,凋亡分子Annexin V阳性表达率在70%以上(图1g)。Western blot结果显示ABs中凋亡通路重要分子Caspase-3的裂解片段(Cleaved Caspase-3)表达明显高于DPSCs(图1h)。以上结果表明,诱导并分离提取DPSCs来源的ABs成功。

Figure 1 Isolation and identification of dental pulp stem cells and dental pulp stem cells-derived apoptotic bodies图1 牙髓干细胞及其来源的凋亡小体的分离鉴定
2.2 DPSCs来源的ABs对炎性巨噬细胞的影响
通过LPS(1μg/mL)刺激巨噬细胞建立炎性巨噬细胞模型,将PKH26预标记的ABs加入炎性巨噬细胞中共培养3 h,可以观察到ABs显著的内吞现象(图2a),表明ABs能够被炎性巨噬细胞吞噬。为了进一步证明ABs对炎性巨噬细胞的影响,将ABs(25μg/mL)加入炎性巨噬细胞中共培养24 h后检测巨噬细胞表型分布。荧光结果显示,与对照组相比,加入LPS后炎性巨噬细胞中抗炎表型CD206阳性分群显著减少(P=0.005);ABs作用后,显著增加了巨噬细胞中抗炎表型的比例(P<0.001)(图2b)。LPS组TNF-α和IL-6的水平较高,TGF-β的水平较低;与LPS组相比,LPS+ABs组TNFα、IL-6水平显著降低(P<0.001,P=0.005),TGFβ水平显著升高(P<0.001)(图2c)。

Figure 2 Influence of apoptotic bodies on the phenotype of inflammatory macrophages图2 凋亡小体对炎性巨噬细胞表型的影响
2.3 DPSCs来源的ABs促进皮肤创面的愈合
为了探讨DPSCs释放的ABs对体内炎症反应的调节作用,首先建立了小鼠背部皮肤创伤模型,并于0 d和3 d分别通过尾静脉注射DPSCs或DPSCs来源的ABs,整个实验流程如图3a所示。
皮肤创面愈合的大体照片显示,与PBS组相比,DPSCs和ABs注射组小鼠创面愈合的速度明显加快(图3b)。Image J对愈合率的分析结果显示,第7天和第12天时,DPSCs组和ABs组愈合情况相比于PBS组均有显著性差异(图3c:第7天DPSCs组P=0.011,ABs组P=0.014;第12天DPSCs组P=0.026,ABs组P=0.041)。另外,实验全程各组小鼠体重均无显著差异(图3d)。ELISA结果显示,与PBS组相比,DPSCs组和ABs组TNF-α(DPSCs组P=0.002,ABs组P=0.002)和IL-6(DPSCs组P<0.001,ABs组P=0.002)显著降低,TGF-β则明显升高(DPSCs组P<0.001,ABs组P=0.002)(图3e)。局部皮肤组织切片荧光结果显示,与对照组相比,DPSCs组和ABs组的CD206阳性细胞数量显著增多,差异具有统计学意义(DPSCs组P=0.005,ABs组P=0.001)(图3f)。以上结果说明了DPSCs来源的ABs植入体内后可通过调控巨噬细胞表型促进皮肤创面的愈合。
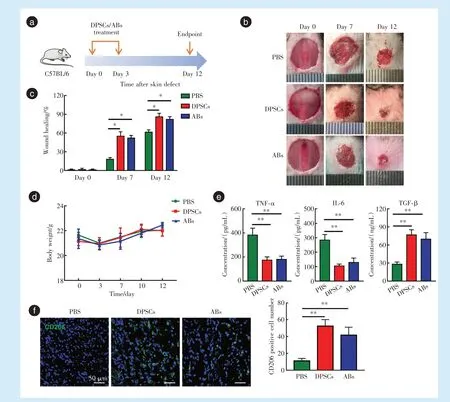
Figure 3 Effect of apoptotic bodies derived from dental pulp stem cells on skin wound healing in mice图3 牙髓干细胞来源凋亡小体对小鼠皮肤创面愈合的影响
2.4 DPSCs来源的ABs对DSS诱导的小鼠结肠炎的保护作用
进一步选择了另一种炎症相关疾病模型即DSS诱导的小鼠结肠炎模型,观察DPSCs来源的ABs是否对结肠炎发挥炎症调控作用。在诱导模型建立的第3 d、第5 d和第7 d分别通过尾静脉注射DPSCs或DPSCs来源的ABs,10 d后取材,整个实验流程图如图4a所示。
各组小鼠体重统计显示,PBS组小鼠体重下降最多,而DPSCs组和ABs组小鼠体重则显著高于PBS组(图4b;DPSCs组P=0.010,ABs组P=0.020)。疾病活动指数(DAI)结果显示,与PBS组相比,DPSCs和ABs注射组小鼠DAI显著降低,代表疾病症状明显减轻(图4c,DPSCs组P<0.001,ABs组P=0.002)。实验结束后取结肠组织,测量结肠长度并进行H&E染色。结果显示,PBS组小鼠结肠隐窝破坏,同时出现炎症浸润和结肠上皮明显损伤(图4d)。DPSCs和ABs注射组的结肠组织病理评分则显著下降,与PBS组相比差异有统计学意义(图4d;P<0.001)。结肠长度统计结果显示,DPSCs和ABs注射组的结肠长度明显大于PBS组(图4e;DPSCs组P<0.001,ABs组P=0.002)。结肠组织荧光染色显示,与PBS组相比,DPSCs组和ABs组的CD206阳性细胞数量显著升高(图4f;DPSCs组P<0.001,ABs组P=0.002)。
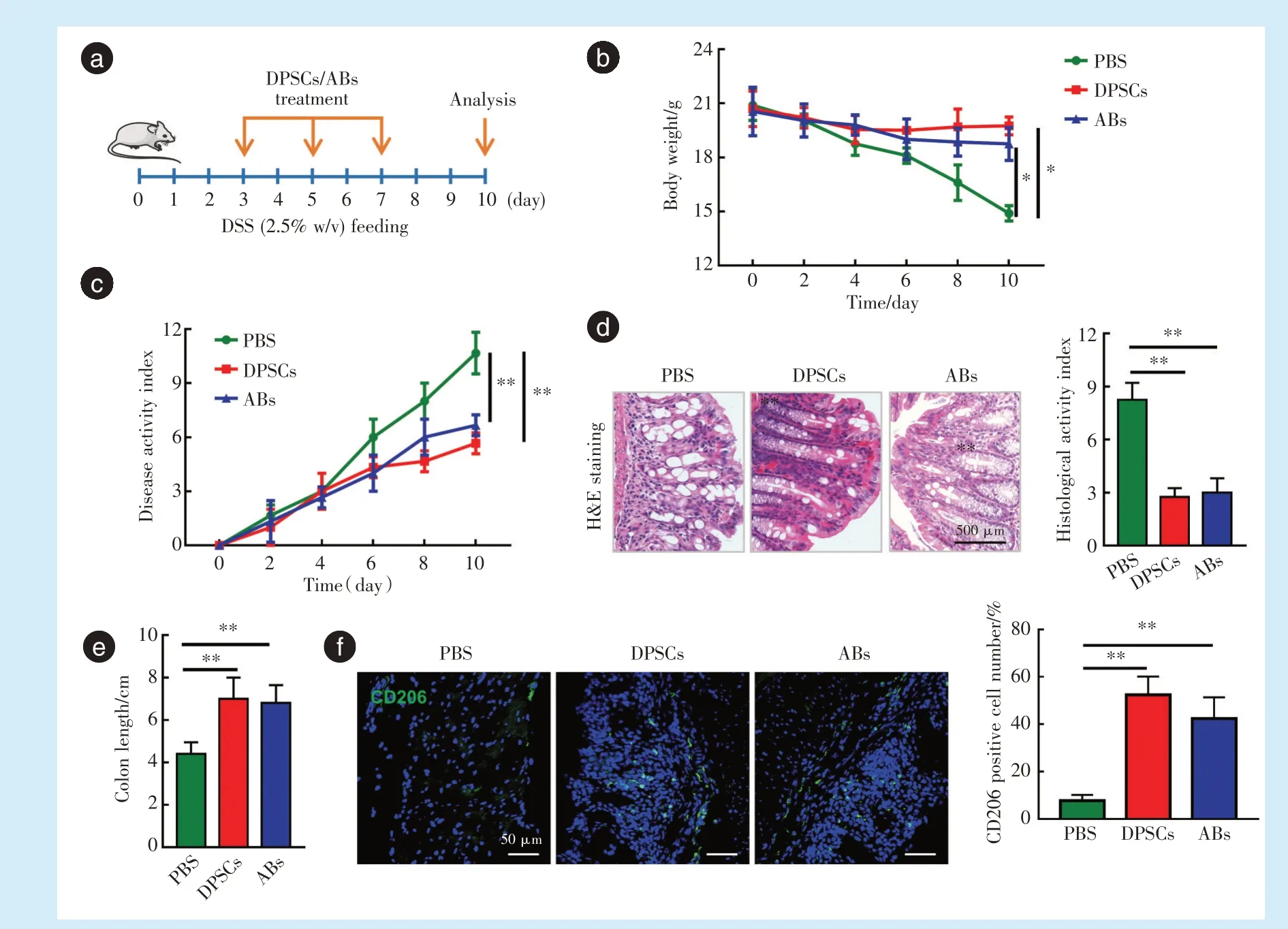
Figure 4 The protective effect of apoptotic bodies derived from dental pulp stem cells on DSS-induced colitis mice图4 牙髓干细胞来源凋亡小体对DSS诱导的小鼠结肠炎的保护作用
3讨论
MSCs移植是实现炎症有效调节和组织再生的重要手段,目前已有多种基于MSCs的细胞治疗方式在进行大动物有效性研究及临床试验。然而,MSCs移植实现广泛临床应用的基础是明确其疗效发挥的机制。以往研究认为植入宿主的MSCs能够完成多向分化及多种因子的释放,而随后的研究认为移植的大多数细胞并不会在宿主体内长期存活。近年研究发现细胞外囊泡的释放是细胞间相互作用的重要媒介[9],并且在细胞移植产生的疗效中发挥重要作用[10]。细胞外囊泡是细胞释放到胞外、具有膜结构、并包含多种信号分子的囊泡,主要包括外泌体、微泡、ABs等,其大小、内容物和生物学功能均具有一定差异[11]。本实验基于前期发现的细胞移植后广泛凋亡的现象[4-5],并基于前期课题组发现的ABs的新生物学功能[7-8],证明了DPSCs在凋亡过程中释放的ABs具有调节炎症和促进组织再生的功能,拓展了细胞外囊泡新功能研究,并提出了牙源性干细胞移植治疗的新机制。
人体内每天有大量的细胞发生凋亡,为维持机体稳态,需要有迅速而有效的清除凋亡细胞以及凋亡相关细胞外囊泡的机制,其中巨噬细胞是发挥此作用的关键细胞[12]。细胞凋亡不仅在发育、组织稳态维持中发挥重要作用,也可在组织损伤过程中释放关键信号,诱导组织再生,提示凋亡现象和再生过程具有密切联系[13]。本实验分离鉴定了DPSCs来源的ABs,发现其基本特征与其他类型细胞释放的ABs类似,并且在体外能够被巨噬细胞吞噬,提示其可能对巨噬细胞功能产生影响。巨噬细胞的极化受多种微环境调控,在组织再生及炎性疾病的发生发展中发挥重要作用[14]。本实验选择小鼠皮肤创面愈合模型和结肠炎模型,发现DPSCs来源的ABs能够在体外和体内实验中显著增加CD206阳性细胞数量,提示其能够促进M2型巨噬细胞极化。巨噬细胞极化与多种组织再生密切相关,因此调控巨噬细胞极化可促进多种组织再生,成为促进组织再生的重要手段。本课题组前期研究发现ABs可通过促进M2型巨噬细胞极化调控机体骨稳态和代谢稳态[8]。因此,笔者推测在其他炎性微环境中,ABs同样可能通过调控巨噬细胞极化并促进组织再生。同时,本实验发现DPSCs来源的ABs通过调控巨噬细胞极化发挥抗炎效果,提示牙源性干细胞的ABs移植可作为调控巨噬极化的新策略。细胞外囊泡功能的发挥可依赖于多种机制,包括其内部的信号分子的细胞间转运以及其表面的受体分子[15],还可能依赖于其内部分子在胞外的释放。本实验发现DPSCs来源ABs可调节巨噬细胞功能,然而其分子机制仍需进一步研究。
