携带丙型肝炎病毒的白内障患者房水中炎症因子的表达分析△
2022-01-15陈淑莹唐婷婷张景尚万修华
陈淑莹 唐婷婷 张景尚 万修华
据世界卫生组织(WHO)统计,全世界约有1.5亿人是丙型肝炎病毒携带者,即HCV(+)患者[1]。最新研究发现,HCV(+)的白内障患者房水中的HCV RNA表达水平较高,足以造成病毒传染[2]。HCV(+)同时也增加了白内障的患病风险,其中接受过干扰素-利巴韦林治疗的患者患白内障风险更高[3-6]。目前,手术是治疗白内障最有效的方法,在表面麻醉下,患者的良好配合是白内障手术成功的关键因素之一,患者的术中疼痛程度直接决定其配合程度[7-8]。大量的研究发现了一些可能加重白内障患者术中疼痛的因素,如:性别、年龄、焦虑、主视眼、高度近视、另一眼白内障手术史、合并青光眼或葡萄膜炎等其他眼部疾病等。近年有研究发现,携带乙型肝炎病毒[HBV(+)]的白内障患者术中疼痛阈值明显低于正常白内障患者[9],本研究团队在HCV(+)白内障患者身上同样发现了这种现象,其具体机制目前尚未见研究报道。近年来有研究表明,HBV(+)白内障患者房水中与疼痛相关的炎症因子表达升高,提示HBV(+)白内障患者更易发生术中疼痛[9-11]。因此,本研究拟采用人类细胞因子抗体阵列检测技术对HCV(+)白内障患者和正常白内障患者的房水中炎症因子进行检测,为HCV(+)白内障患者较正常白内障患者术中疼痛更敏感这一现象提供理论依据。
1 资料与方法
1.1 一般资料选取2018年4月至2019年1月就诊于首都医科大学附属北京同仁医院拟行白内障手术的34例患者为研究对象,其中,男14例、女20例,年龄45~88岁;静脉血HCV(+)者17例为试验组,静脉血HCV(-)者17例为对照组。所有患者均拟行第一只眼的白内障手术。排除标准为合并高度近视、青光眼、葡萄膜炎、Graves眼病、眼部血管阻塞性疾病、黄斑视网膜前膜、年龄相关性黄斑变性和糖尿病的患者。本研究经北京同仁医院伦理委员会批准,所有患者术前均签署知情同意书。
1.2 术前HCV抗体及肝功能、肾功能检测所有患者均于术前7 d留取空腹静脉血标本,采用酶联免疫吸附试验检测HCV抗体情况;采用全自动生化分析仪检测患者肝功能和肾功能常规指标,其中,肝功能检测指标包括总蛋白(TP)、白蛋白(ALB)(溴甲酚绿法)、总胆红素(TBIL)、直接胆红素(DBIL)、总胆汁酸(TBA)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、γ-谷氨酰氨基转移酶(GGT)、前白蛋白(PAB)、甘油三酯(TG)、总胆固醇(CHOL)、低密度脂蛋白胆固醇(LDLC)、高密度脂蛋白胆固醇(HDLC)、C反应蛋白(CRPC);肾功能检测指标包括:尿素氮(BUN)、肌酐(CREA)(酶法)、尿酸(URIC)。所有指标均采用标准方法在北京同仁医院的临床实验室检测。
1.3 样本采集所有患者均由同一位眼科医生行房水样本采集。患者常规眼部消毒后,在白内障手术过程中使用1 mL注射器从前房中抽取100~200 μL房水样本,采集后立即置于-80 ℃冰箱低温保存,直至用于炎症因子含量检测分析。
1.4 炎症因子含量检测采用人类细胞因子抗体阵列检测技术(QAH-INF-3,Ray-Biotech公司),利用双抗体夹心免疫原理,检测房水中40种炎症因子的含量,具体为:肿瘤坏死因子(TNF)-α、TNF-β、重组人TNF受体I(TNF RI)、重组人TNF受体II(TNF RII)、巨噬细胞集落刺激因子(M-CSF)、重组人趋化因子CCL1(I-309)、单核细胞趋化蛋白-1(MCP-1)、基质金属蛋白酶抑制因子(TIMP)-1、TIMP-2、重组人干扰素-γ(IFNg)、细胞间黏附分子(ICAM-1)、白细胞介素(IL)-2、IL-4、IL-5、IL-6、IL-7、IL-8、IL-10、IL-11、IL-13、IL-15、IL-16、IL-17、重组人IL-1α(IL-1a)、重组人IL-1β(IL-1b)、IL-6受体(IL-6R)、IL-1受体拮抗因子(IL-1ra)、IL-12p40、IL-12p70、人血浆炎性趋化因子(MIG)、B淋巴细胞趋化因子(BLC)、趋化因子配体5(RANTES)、粒性白细胞菌落刺激因子(G-CSF)、血小板源性生长因子-BB(PDGF-BB)、巨噬细胞炎性蛋白(MIP)-1α(MIP-1a)、MIP-1β(MIP-1b)、MIP-1δ(MIP-1d)、嗜酸性粒细胞趋化蛋白(Eotaxin)、Eotaxin-2、粒细胞巨噬细胞-集落刺激因子(GM-CSF)。
定量芯片配备有标准蛋白质混合物,房水样本加到芯片上之后,房水中的炎症因子将与芯片上的标准蛋白混合物结合,并将炎症因子固定在芯片的特定位置上。将Cy3-链霉亲和素与固定在芯片上的40种炎症因子抗体混合物进行共孵育,形成抗原抗体复合物。然后用激光扫描仪(InnoScan 300 Microarray Scanner,Innopsys公司,法国) 的Cy3通道(激发光频率532 nm)扫描信号进行荧光检测,通过化学发光显影系统检测芯片上的荧光信号强度,采用QAH-INF-3数据分析软件对各结合点的光密度进行测量分析,计算各炎症因子含量。每个样品测量四次,取平均值记录。
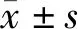
2 结果
2.1 患者的一般情况分析试验组和对照组患者的年龄、性别及眼别构成差异均无统计学意义(均为P>0.05),具有一定的可比性(表1)。

表1 试验组与对照组患者一般资料对比
2.2 两组患者术前肝功能和肾功能常规检测结果分析试验组和对照组患者肝功能、肾功能常规指标检测结果见表2。由表2知,试验组与对照组白内障患者间的肝功能、肾功能各常规指标差异均无统计学意义(均为P>0.05)。

表2 试验组与对照组白内障患者的肝功能和肾功能常规指标检查结果对比
2.3 房水中40种炎症因子含量分析两组白内障患者房水中40种炎症因子含量检测结果见表3。由表3知,炎症因子M-CSF、I-309、MCP-1在试验组白内障患者房水中的含量均显著高于对照组,TNF-β在试验组白内障患者房水中的含量显著低于对照组,差异均有统计学意义(均为P<0.05),其余36种炎症因子在两组白内障患者房水中的含量差异均无统计学意义(均为P>0.05)。

表3 试验组与对照组白内障患者房水中各炎症因子的含量对比

续表3
3 讨论
本研究首次对HCV(+)白内障患者和正常白内障患者的房水中炎症因子含量进行了对比,同时对比了两组患者术前的肝功能和肾功能。结果发现,TNF-β、M-CSF、I-309、MCP-1这4种炎症因子在HCV(+)白内障患者和正常白内障患者房水中的含量差异均存在统计学意义(均为P<0.05),试验组与对照组患者肝功能和肾功能各项常规指标间差异均无统计学意义(均为P>0.05)。
房水中有许多炎症因子,这些炎症因子在不同的眼病,如葡萄膜炎、青光眼和糖尿病视网膜病变中的表达显著不同[12]。目前未见有研究探讨 HCV(+) 白内障患者与正常白内障患者房水中炎症因子表达的差异。这可能是因为房水中存在的蛋白质含量很低,精确、定量地评价前房内炎症反应的难度较大。本研究采用人类细胞因子抗体阵列检测技术检测房水中炎症因子的表达,与传统检测方法相比具有显著的优势,该方法只需要极少量的蛋白质样品即可检测多种炎症因子的表达,适用于测量房水中的蛋白含量[11]。
本研究结果发现,HCV(+)白内障患者的房水中TNF-β的含量较正常白内障患者降低,而TNF-β是一种具有炎症抑制作用的细胞因子,具有抗炎作用的细胞因子表达增强可以有效缓解神经损伤带来的疼痛感,利用这种内源性抗炎能力可以有效地治疗慢性神经病理性疼痛[13]。TNF-β的炎症抑制作用与疼痛的缓解相关,TNF-β的表达降低会导致其对炎症的抑制作用减弱,炎症反应增强最终加重伤害性损伤引起的痛觉[13-14]。因此我们推论,房水中TNF-β的表达降低会导致HCV(+)白内障患者的内源性抗炎作用降低,使HCV(+)白内障患者炎症反应增强,从而较正常白内障患者更易感知术中疼痛。
M-CSF的主要功能为通过受体(CSF-1R或c-Fms)调节单核细胞/巨噬细胞谱系的发育,并在组织中局部作用以控制巨噬细胞的数量和功能,并且通过对小胶质细胞的中枢作用参与神经性疼痛的控制[15]。Jabońska等[16]研究发现,外周血中M-CSF的高表达与HCV(+)患者的肝脏炎症活动密切相关,并且可以作为观测指标反映患者治疗初期的免疫激活效果。在其他领域也研究发现M-CSF与疼痛具有一定相关性。Okubo等[17]研究显示,向周围神经损伤导致疼痛敏感的大鼠行鞘内注射M-CSF受体抑制剂后,可明显减轻大鼠的早期神经痛症状,此外,行鞘内注射重组M-CSF可诱导大鼠的机械性痛觉超敏。这一研究证明,M-CSF是一种初级传入神经的疼痛相关因子,能够诱导大鼠产生周围神经损伤后的神经病理性疼痛。Saleh等[18]提出全身给予CSF-1R或CSF-1单抗可抑制M-CSF所诱导的小鼠炎症引起的疼痛,表明M-CSF在炎症引起的疼痛的发生过程中具有外周诱导功能,是诱导疼痛产生的重要因子。本研究结果显示,HCV(+)白内障患者房水中M-CSF表达较正常白内障患者增高,M-CSF表达增高与HCV(+)白内障患者术中疼痛更敏感密切相关。
I-309是活化的T淋巴细胞、肥大细胞和单核细胞的产物,是参与免疫应答和血管生成调节的重要趋化因子。在伤口修复、肿瘤生长等多个过程中发挥重要作用。多领域研究发现,I-309通过上调神经兴奋性突触的AMPA受体的磷酸化介导神经炎性相关的病理性疼痛。Wang等[19]研究发现,向胫骨骨折复位术后慢性疼痛的小鼠行鞘内注射AMPA受体抑制剂可以减轻疼痛,且鞘内注射外源性I-309促进了小鼠的急性疼痛行为和AMPA受体的磷酸化。这一发现说明,I-309介导的AMPA受体激活在骨折复位术后病理性疼痛的产生中起着至关重要的作用。本研究中,I-309在HCV(+)白内障患者房水中的表达较正常白内障患者明显增高,房水中 I-309 高表达是HCV(+)白内障患者术中疼痛更敏感的一个重要因素。
MCP-1也称为单核细胞趋化和活化因子,是一种疼痛相关的炎症趋化因子[20]。基础研究结果表明,MCP-1的表达受背根神经节神经元的调控[21-22]。MCP-1发挥的作用是增加周围神经损伤后痛觉神经元的兴奋性,阻断MCP-1/CCR2信号通路可以减轻神经性疼痛,这表明MCP-1可以通过增强外周神经元功能来增强疼痛敏感性。不仅如此,MCP-1还可以产生中枢痛觉致敏效果,其机制是通过增加自发兴奋性突触后电流的幅度和频率,同时降低自发抑制性突触后电流的幅度和频率,来提高疼痛信号在脊髓后角胶状质细胞层神经元中传递的效率。
炎症因子在痛觉传导方面发挥着重要作用,这种现象在医学的其他专业领域也得到了确认[23-26]。在本研究中,多种炎症因子在HCV(+)白内障患者房水中表达水平与正常白内障患者明显不同,因此我们认为,HCV(+)白内障患者术中对于疼痛更敏感的原因可能与房水中炎症因子的差异表达有关。
HCV(+)患者一般都存在不同程度的肝细胞损伤,损伤后的肝细胞内容物外渗到血清中,ALT分布于肝细胞的细胞质中,AST分布于肝细胞的线粒体中,血清ALT和AST异常一般提示HCV感染已发展到丙型肝炎。HCV损伤肝细胞时ALT可通过细胞膜释放入血,AST则需要在线粒体溶解后释放入血,因此,血清ALT水平是反映肝损伤最敏感的指标之一[27]。ALT可在一些急性肝损伤(如急性肝炎)时出现显著的急剧升高,也可能在慢性肝炎、肝硬化、肝癌等疾病中升高[27]。在重型肝炎和中重型肝炎患者中,血清中AST水平也显著升高,临床上也常使用AST/ALT的比值作为评估肝脏病变情况的指标。本研究据此对所有患者的AST/ALT的比值进行计算分析,试验组与对照组患者间该数值的差异并无统计学意义。随着机体HCV病毒复制水平的提升,AST、ALT异常的发生率也在提升。当肝细胞受损时,ALT和AST释放入血,血清中ALT、AST水平升高,能以此来判断丙型肝炎病情的严重程度。本研究中两组患者间肝功能各项常规指标均未见明显差异,可能是由于本研究中HCV(+)患者并未发展到丙型肝炎,或是严重程度未对肝功能造成明显影响所致。
本研究仍有一定的局限性。本研究中纳入的样本数量较少,可能存在一定的选择偏倚。这一局限性主要是由于临床上HCV(+)白内障患者数量较少所致,需要进一步的长期临床研究扩大样本量进一步检测并验证。此外,本研究分析得出HCV(+)白内障患者房水中炎症因子的表达变化是术中更容易感知疼痛的原因之一,但HCV(+)白内障患者房水炎症因子升高的具体机制及炎症因子引起疼痛的确切机制尚不清楚,有待进一步研究。此外,HCV感染是一个全身性的疾病,在人体的各个系统均有表现,对人体各部分组织液中的炎症因子表达水平都会产生影响[28-29],因此,仍需进一步探索外周血中炎症因子的表达差异与房水中炎症因子表达是否有关系。理论上,由于血-视网膜屏障和血-房水屏障的存在,房水中的炎症因子的表达相对更独立一些,更能反映眼部疾病的症状与体征。
综上所述,本研究发现HCV(+)白内障患者房水中M-CSF、I-309、MCP-1的表达显著高于正常白内障患者,TNF-β的表达显著低于正常白内障患者。这可能是HCV(+)白内障患者术中疼痛更敏感的原因之一。本研究结果为在临床上减少HCV(+)白内障患者术中疼痛提供了新的思路。
