甘草附生细菌多样性和群落结构组成
2022-01-14李文娟
李文娟
(滨州市自然资源和规划局,山东 滨州 256600)
植物生长环境中存在各种各样的微生物,例如细菌、真菌、古菌等,它们生活于植物器官内部或附着在其表面[1]。微生物在维持植物健康和促进植物生长过程中起着关键作用[1]。微生物可以通过溶磷作用[2]、固氮作用或者分泌铁载体[3]促进植物对所需营养元素的吸收,产生植物激素[3]、抗菌物质等促进植物生长、提高作物产量、保护寄主植物免受病原体的侵害[4]。微生物还能增强植物在各种胁迫条件下的适应能力[5]。此外,植物也对微生物群落产生重要影响。植物为微生物群落提供栖息场所,微生物群落能够在同一植物的不同部位定殖,如根际、叶际以及叶、茎、根内部[6]。植物种类是决定微生物群落结构的重要因子[7]。植物根系分泌的化学物质可以释放到土壤中,进而影响土壤中微生物群落的结构[6]和生物量[8]。植物还可以通过刺激有益于植物生长的微生物来影响根际微生物群落组成[9]。
同一株植物的微生物群落在不同部位具有一定差异。对葡萄不同器官(叶、花、根)和土壤微生物群落结构进行研究,发现地上部分微生物群落结构明显与地下部分不同,但是在叶、花聚集的部分微生物同样在土壤中出现[10]。BAI等[11]采用分离培养技术对拟南芥的叶际和根际微生物群落进行比较,发现叶际微生物群落明显区别于根际。BECKERS等[12]应用16S rDNA测序技术发现,相比杨树茎、叶,根际微生物群落结构更加稳定。目前,关于药用植物微生物的研究多集中于根际微生物与药用植物的互作以及微生物转化对药用植物的影响方面[13-24],对药用植物地上部分与地下部分微生物群落结构差异的研究尚不多见。甘草是豆科草本植物,主要分布于我国西北地区,其药用部位是根和根茎,具有清热解毒、祛痰止咳以及补脾益气等功效,市场需求旺盛。目前,野生甘草资源正迅速减少,提高甘草的栽培质量成为当前急需解决的一个问题。因此,以甘草为研究对象,采用16S rDNA测序技术对其叶际、茎部以及根际土壤的细菌群落的多样性以及结构组成进行初步研究,旨在了解甘草不同部位细菌群落差异,为进一步探究微生物与植物的互作机制提供理论参考,且对于药用植物的栽培具有指导意义。
1 材料和方法
1.1 样品采集与处理
甘草样品采集地点为山东省滨州市无棣县(北纬37°04' ~38°16',东经117°31'~118°04'),该区属北温带东亚季风区大陆性气候,四季分明,降水多集中于7、8月份。无棣县拥有丰富的野生植物资源,药用植物分布广泛。随机选取3株长势良好的甘草植株,小心挖出整株,采集其茎、叶以及附着于植物根表面的土壤颗粒,分别命名为茎部(GJ)、叶际(GY)、根际(TR),放入无菌自封袋中。采样结束后,将样品置于装有冰袋的采样箱中,带回实验室于-20 ℃冰箱中保存,用于后续的DNA提取。
1.2 DNA提取、测序
参照试剂盒说明书,使用E.Z.N.A.®Soil DNA Kit试剂盒对土壤、叶、茎样品进行DNA提取。16S rDNA扩 增 引 物 为341F(5'-CCTACGGGNGGCWGCAG-3')和805R(5'- GACTACHVGGGTATCTAATCC-3')。PCR反应体系为25µL,包含50 ng模板DNA,Phusion Hot start flex 2× Master Mix 12.5µL,上、下游引物各2.5 µL,用超纯水(ddH2O)补至25µL。PCR扩增程序:94 ℃预变性 3 min;94 ℃变性 30 s,56 ℃退火 30 s,72 ℃延伸 30 s,35 个循环;72 ℃ 最终延伸 10 min。扩增完成后,用2% 琼脂糖凝胶电泳验证PCR产物。扩增产物由AMPure XT beads (Beckman Coulter Genomics, Danvers, MA, USA)纯化,Qubit (Invitrogen, USA)定量。采用Agilent 2100生物分析仪(Agilent,美国)和Illumina(Kapa Biosciences, Woburn, MA,美国)的文库定量试剂盒评估扩增子文库大小和数量。利用NovaSeq PE250平台对文库进行测序。
1.3 细菌群落多样性分析
测序完成后,得到原始数据,通过overlap对双端数据进行拼接,并通过质控、过滤嵌合体,得到高质量数据。利用DADA2进行调解,获得特征表和特征序列。根据SILVA分类器,使用每个样本的相对丰度将特征丰度进行归一化。α多样性主要通过Chao1、Observed species、Goods_coverage、Shannon、Simpson 5个指数反映,这些指数用QIIME2计算。采用主成分分析 (Principal component analysis,PCA)对甘草不同部位细菌群落组成差异进行分析。采用Blast进行序列比对,每个代表性序列通过SILVA数据库对特征序列进行注释。
1.4 数据处理与分析
采用Excel 2017和SPSS 20进行统计分析,利用R语言和Excel 2017软件做图。
2 结果与分析
2.1 甘草茎部、叶际、根际细菌特征值分布
由图1可知,甘草3个部位茎部、叶际、根际细菌文库共有特征值102个。茎部独有特征值最少,为432个;叶际独有特征值为818个;根际独有特征值最多,为4 801个(图1)。因此,甘草不同部位特有细菌群落组成差异较大。除了3个部位的共有特征值,根际与茎部、叶际,茎部与叶际也分别都有共有特征值。

图1 甘草茎部、叶际、根际细菌特征值分布
2.2 甘草茎部、叶际、根际细菌的α多样性
微生物物种的丰富度和均匀性主要由Chao1、Observed species、Goods_coverage、Shannon、Simpson 5个指数反映。Chao1和Observed species指数反映物种的丰富度信息,数值越大,物种总数越多。Goods_coverage表示微生物覆盖率,其数值越高,则样本中新物种被测出的概率越高。Shannon和Simpson指数用于反映样本物种的多样性,数值越大,物种多样性越高。由表1可知,甘草茎部、叶际、根际细菌多样性指数具有一定差异。Observed species指数、Chao1指数均表现为根际>叶际>茎部,表明根际微生物群落的丰富度最高,其次是叶际,茎部最低。Shannon指数和Simpson指数总体表现为根际>茎部>叶际。此外,样品Goods_coverage指数介于0.99~1.00,真实地反映了样本中的微生物情况。

表1 甘草茎部、叶际、根际细菌的α多样性
2.3 甘草茎部、叶际、根际细菌的主成分分析
2个样品在PCA图中的距离越近,2个样品物种组成越相似。由图2可以看出,相较于不同类型样品间距离,同类型样品间的距离更近,差异更小。根际与茎部、叶际样品的距离较远,表明细菌的分布因植物部位而有所不同。

图2 甘草茎部、叶际、根际细菌的主成分分析
2.4 甘草茎部、叶际、根际细菌群落结构组成
为了进一步研究甘草不同部位细菌群落组成差异,在门水平和属水平上比较甘草根际、叶际和茎部微生物的相对丰度。各类型样品在门、属水平上丰度排名前30的物种见图3、图4。在门水平上(图3),甘草茎部的优势细菌门为变形菌门(Proteobacteria)(93.73%)、蓝细菌门(Cyanobacteria)(4.15%);叶 际的优势细菌门为变形菌门(55.64%)、蓝细菌门(40.82%)、厚壁菌门(Firmicutes)(1.28%);根际的优势细菌门为变形菌门(47.33%)、芽单胞菌门(Gemmatimonadetes)(9.81%)、酸杆菌门(Acidobacteria)(8.71%)、放线菌门(Actinobacteria)(7.76%)、拟杆菌门(Bacteroidetes)(7.15%)、绿弯菌门(Chloroflexi)(5.28%)、浮霉菌门(Planctomycetes)(4.44%)、疣微菌门(Verrucomicrobia)(1.68%)、己科河菌门(Rokubacteria)(1.37%)、硝化螺旋菌门(Nitrospirae)(1.03%),可见不同部位的优势细菌门存在一定的差异。其中,变形菌门是所有类型样品的优势菌门,但在各部位中所占比例有所不同,在茎部的相对丰度最高,其次是叶际,在根际中最低。

图3 门水平上甘草茎部、叶际、根际细菌群落组成
在属水平上(图4),甘草茎部优势菌属中能准确分类的有泛菌属(Pantoea)(34.82%)、假 单胞菌属(Pseudomonas)(23.85%)、鞘氨醇单胞菌(Sphingomonas)(9.63%)、Falsirhodobacter(7.89%)、Massilia(3.02%)、欧文氏菌属(Erwinia)(2.19%);叶际优势菌属中能准确分类的有泛菌属(15.99%)、假单胞菌属(8.66%)、不动杆菌属(Acinetobacter)(3.67%)、Falsirhodobacter(2.94%)、鞘氨醇单胞菌属(2.62%)、Massilia(1.29%)、甲基杆菌属(Methylobacterium)(1.22%);根际优势菌属中能准确分类的有Pelagibius(2.41%)、Haliangium(1.13%),未准确分类的有Geminicoccaceae科未知属(5.00%)、α变形菌纲未知属(3.00%)、芽单胞菌科未知属(1.58%)、Actinomarinales目未知属(1.57%)、Rokubacteriales门未知属(1.57%)、变形菌门未知属(1.10%)。
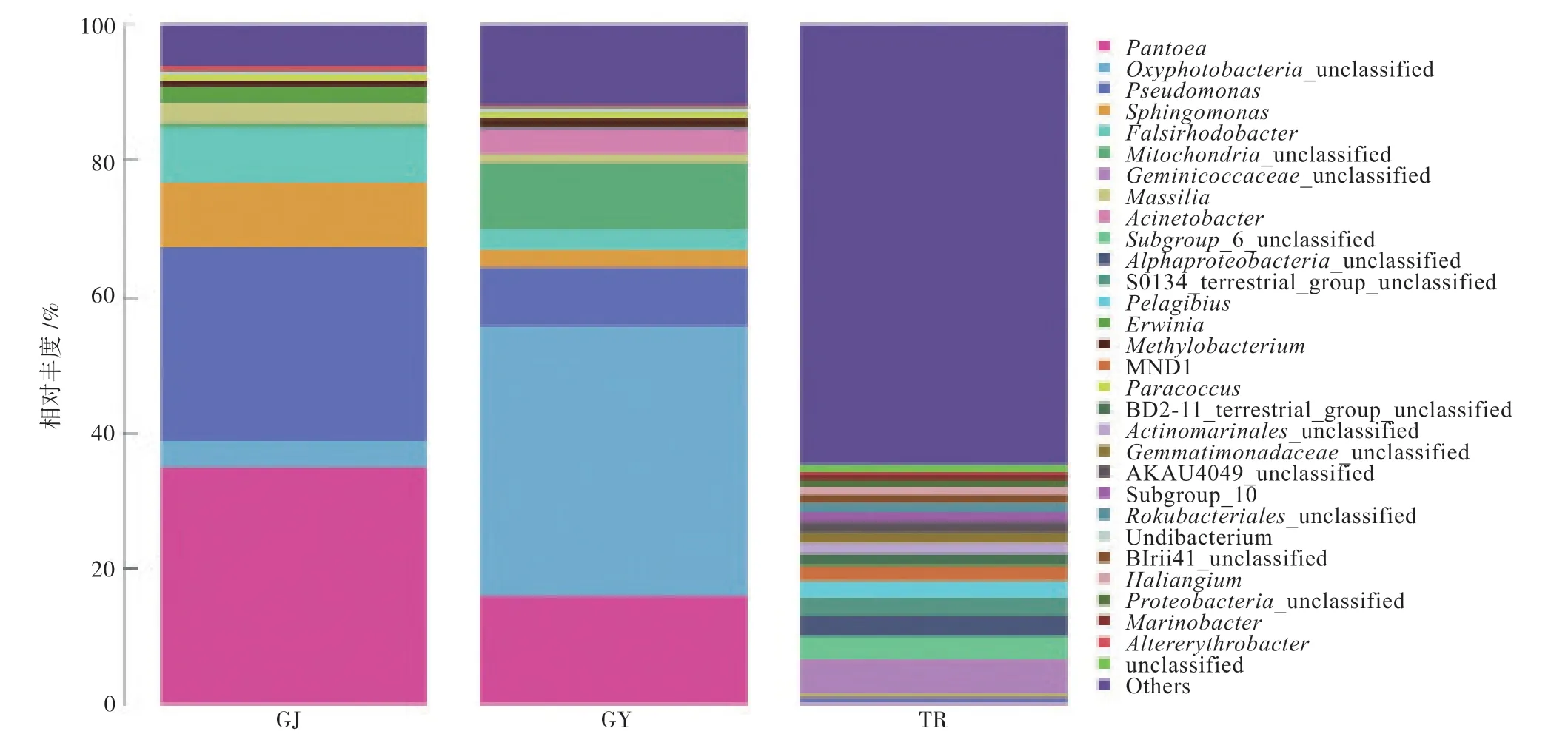
图4 属水平上甘草茎部、叶际、根际细菌群落组成
3 结论与讨论
甘草茎部、叶际、根际细菌群落共有特征值102个,根际独有特征值最多,其次为叶际,茎部最少。植物地上部分细菌的来源之一是土壤[25]。因此,叶际、茎部与根际细菌群落之间存在共性。叶际生态系统因具有开放性强的特点而使其微生物来源多样,微生物除来自土壤外也可能是经气溶胶或昆虫传播而来[11,26]。所以,不同部位细菌的不同来源使各部位存在特定的群落。在α多样性上,不同部位的细菌群落多样性、丰富度均表现出差异,根际细菌群落的α多样性远高于叶际和茎部。本研究结果与使用高通量测序技术对杨树叶、茎、根和土壤微生物的研究结果相似,即地下部分微生物多样性高于地上部分[27]。根际环境中细菌面临的非生物因素影响较弱,而且植物根系分泌化学物质如有机酸、氨基酸并将其释放到周围环境中,极大地吸引了微生物在根际周围聚集[28-29],进而构成了包含丰富多样物种的根际微生物群落。植物地上部环境条件严苛,尤其是叶片寿命短,面临众多非生物因素的影响,如紫外线照射强烈、温湿度变化大、营养物质有限,只有适应该环境的细菌才能在此定殖[1,30]。应用主成分分析比较各部位细菌群落结构,细菌群落根据植物部位聚类,叶际与茎部群落结构的相似性高于根际与叶际或茎部之间的相似性。对杨树以及拟南芥细菌群落的研究发现,不同部位虽存在相同物种,但群落结构差异显著[12,31],与本研究结果一致。上述结果表明,甘草根际、叶际和茎部的细菌群落既存在共性,也具有差异性。
在门水平上,甘草茎部的优势细菌门是变形菌门和蓝细菌门。其中,变形菌门的相对丰度高达90%以上,占绝对优势。叶际的部分优势细菌门与茎部重叠,为变形菌门、蓝细菌门和厚壁菌门,但相对丰度有所不同。对杨树细菌多样性的研究发现,生活于植物地上部分(茎和叶际)的细菌群落存在相似性[32],与本研究结果一致。对其他植物叶际微生物群落的研究发现,主要细菌门是变形菌门、放线菌门、鞘脂杆菌门和拟杆菌门[29,33-34],表明不同植物叶际的优势菌群具有差异。甘草根际最主要的优势细菌门是变形菌门。此外,芽单胞菌门、酸杆菌门、放线菌门、拟杆菌门等也较丰富,根际的优势细菌门同样在水稻、大麦、小麦根际中聚集[35-36]。甘草不同部位的优势菌群表现出显著差异,根际的优势菌群种类远多于叶际和茎部。从上述结果可知,变形菌门在每个部位的相对丰度是最高的,且表现为根际<叶际<茎部。以往研究发现,变形菌门也是其他植物优势菌群中最丰富的[26,29,37],可见不同植物的关键群落成员是重叠的。放线菌已在许多药用植物根际中被发现。前人研究表明,植物根际放线菌能够保护植物根部免受病原菌感染[3],产生生物活性物质[38],红豆杉根际放线菌具有极强的抑菌活性[39],可见放线菌在农业和药物开发方面具有较大潜力。
在属水平上,假单胞菌属、泛菌属、鞘氨醇单胞菌属均在茎部和叶际富集。泛菌属是叶际和茎部最丰富的菌属,在茎部的相对丰度高于叶际。但拟南芥叶际菌属中丰度最高的是假单胞菌属[31]。上述菌属已在许多植物如葡萄[10]、拟南芥[40]叶际或茎部中被分离出来,此外甲基杆菌属也已从叶际中被分离出来。紫外辐射是影响叶际微生物生存的一个重要因子,假单胞菌属、鞘氨醇单胞菌属、甲基杆菌属可以产生色素,帮助叶际微生物群落抵御紫外辐射的伤害[41]。此外,假单胞菌能够增强叶片的湿润性,促进了物质的溶解和扩散,使之易从附生细菌中获得[41]。本研究中根际优势菌属丰富,但未明确分类的占比大,而以往研究中,植物根际的主要菌属为假单胞菌属、芽孢杆菌属[28]、节杆菌属[12]等。
