多巴胺及其受体在哮喘发病机制中的研究进展
2022-01-14廖礼彬姚雪萍
廖礼彬,吴 娜,姚雪萍
(新疆医科大学1. 基础医学院组织胚胎学教研室、2. 第二附属医院、3. 基础医学院机能中心,新疆 乌鲁木齐 830017)
哮喘是危害人类健康的常见慢性呼吸道疾病,儿童的发病率较高,且可迁延至成年,损伤肺功能影响生活质量。1项2011~2018 年的数据统计显示,我国14岁以下儿童哮喘的患病率3.3%。其中4~6岁儿童哮喘患病率最高[1]。虽然儿童患病率最高,但老年哮喘(>65岁)的死亡率却居各
收稿日期:2021-08-09,修回日期:2021-10-17
基金项目:新疆维吾尔自治区自然科学基金(No 2018D0C156)
作者简介:廖礼彬(1983- ),男,博士,讲师,研究方向:神经生物学,E-mail:hunanzero@126.com;
姚雪萍(1984- ),女,硕士,高级实验师,研究方向:神经生理学与呼吸生理学,通信作者,E-mail:55yaoxp@sina.cn
年龄段之首,约占哮喘死亡患者的50%[2]。目前认为,哮喘的发病机制为气道炎症和高反应性(airway hyper reactivity,AHR)。尽管使用舒张支气管药物和抗炎类药物可以缓解哮喘急性期症状,但并不能治愈哮喘和显著降低哮喘恶化进程。科研和医疗工作者们多年来从炎症因子相互作用、神经调节失衡、上皮细胞和气道平滑肌功能异常等方面入手,不断探究哮喘更深层次的发病机制。多巴胺是人体重要的神经递质,在呼吸道及哮喘机制的研究中历经兴衰。最初人们认为多巴胺的功能仅为促进支气管血管收缩,1970年,Aviado等[3]给猫、狗、兔子和山羊等静脉注射多巴胺后,肺阻力略有上升。且这种增加可被支气管中的α肾上腺素受体阻断剂抑制。这种认识局限使多巴胺在呼吸道和哮喘中的研究停滞多年。直至1995年,Kobayashi等[4]在兔肺组织切片中发现多巴胺D1样受体。2013年,Gong等[5]在OVA诱导的小鼠哮喘模型中,使用了多巴胺DRD1受体拮抗剂(SCH23390),结果发现小鼠炎症明显减轻,气道阻力降低。提示多巴胺受体可能在哮喘的发病中起着一定作用。
该综述将从炎症、肺部神经失调、气道上皮细胞和平滑肌细胞功能障碍等方面,介绍多巴胺及其受体在哮喘发病中的作用。
1 多巴胺受体与哮喘气道炎症
哮喘的组织学特征是杯状细胞增生、支气管黏膜炎性细胞浸润、粘膜下层增厚和上皮细胞脱落。 辅助性T(Th)细胞在免疫功能紊乱中起重要作用,参与哮喘的发生发展。 Th细胞分为4种亚型:分泌干扰素(IFN-γ)的Th1、分泌IL-4的Th2、产生IL-17的Th17细胞和CD4+CD25+Foxp3型的调节性T细胞。Th17细胞可释放IL-17,并可募集中性粒细胞(NEUs),进一步加重哮喘发作[6]。Treg细胞通过IL-10和TGF-β等细胞因子发挥作用,或通过细胞间接触发挥作用。目前发现多巴胺受体在许多免疫细胞中均有表达,包括树突状细胞(DCs)和T细胞,但不同多巴胺受体在免疫应答中的作用也是不同的,目前广泛认可的多巴胺受体有5种,根据是否激活cAMP将受体分为两大类,D1样受体,包括DRD1和DRD5;D2样受体,包括DRD2、DRD3、DRD4等。DRD1和DRD2属于低亲和性受体,与多巴胺结合后具有促炎作用[7],而DRD3和DRD5属于高亲和性受体,与多巴胺受体结合具有抗炎作用[8-9]。
1.1 多巴胺及受体促进哮喘中Th17细胞活化原始T细胞也可以分化Th17细胞和调节性T细胞。Th17细胞分泌的IL-17A刺激嗜酸性粒细胞, 也募集中性粒细胞,这些细胞影响气道平滑肌[10],加重哮喘症状。在OVA诱导的哮喘模型中,使用D1样受体拮抗剂SCH23390,支气管肺泡灌洗液中Th17细胞显著减少,中性粒细胞的浸润减少,进一步研究发现D1样受体可增强B细胞激活转录因子活性,进而增加Th17转录因子RORγt的表达。此外,D1样受体拮抗剂抑制OVA哮喘中肺CD11c+抗原递呈细胞产生IL-23[11],D1样受体拮抗剂SCH23390并不能区分DRD1和DRD5,所以在目前尚不能区分DRD5和DRD1在哮喘Th17激活中的作用。另一项研究发现,DRD5刺激小鼠CD4+T细胞促进T细胞的活化,对Th17炎性表型的分化有重要作用[12]。同时移植了DRD5缺陷树突状细胞的小鼠在中枢神经系统内也显示出Th17细胞浸润百分比显著减少[9]。在屋尘螨(HDM)诱导的过敏实验中,DRD3缺乏导致呼吸道嗜酸性粒细胞浸润加剧。DRD3介导的CD4+T细胞信号在效应细胞系的平衡中起着关键作用,有利于CD4+T细胞的炎症[10]。
1.2 多巴胺及受体抑制调节性T细胞功能调节性T细胞是一种特殊的T细胞,在控制免疫稳态中发挥重要作用。Treg分为自然调节性T细胞和适应性T细胞,自然调节性T细胞表现为CD4+CD25+T淋巴细胞(Tregs),还表达特征性转录因子Foxp3。Treg细胞在哮喘中的主要功能是负性调节Th1、Th2和Th17细胞,以防止Th细胞过度活跃[13]。因此,Treg细胞的过度耗竭被证明会加重小鼠哮喘[14]。研究发现Treg细胞中存在多巴胺能系统,不仅DRD1和DRD2受体在Treg细胞有表达,促进多巴胺生成的酪氨酸羟化酶在Treg细胞中也有表达,多巴胺或选择性D1样受体激动剂通过激活Tregs中的D1样受体,导致Tregs的抑制,从而减弱其抑制效应T淋巴细胞(TEFs)的能力,结果TEFs被激活。因此,多巴胺可以激活Treg细胞的D1样受体,并通过这种方式间接激活TEFs[15]。
1.3 多巴胺及受体对Th1/Th2分化的影响静息期的Th细胞即CD4+T细胞受到外界或细胞因子刺激后会向Th1或Th2分化,Th1促进巨噬细胞活化,参与细胞免疫。Th2释放IL-4、IL-5和IL-13细胞因子等参与体液免疫。在过敏性哮喘患者中,树突状细胞在激活原始T细胞中起着至关重要的作用。Th2细胞释放多种促过敏性炎症因子,这些炎症因子激活嗜碱性粒细胞和嗜酸性粒细胞,增加哮喘患者气道粘液分泌[16]. IL-5能刺激嗜酸性粒细胞的产生,促进嗜酸性粒细胞的分化、增殖和存活. IL-13具有与IL-4相似的功能,能提高气道高反应性。树突状细胞(DC)可以合成和储存多巴胺,DC通过DC-T细胞相互作用向原始CD4细胞释放多巴胺,并影响辅助性T细胞的分化[12]。用D2样受体拮抗剂舒必利和奈莫那普利处理树突状细胞后,在这些树突状细胞和同种异体原始CD4之间的混合淋巴细胞反应中,诱导T细胞分泌IL-5、IFN-γ。相反,特异性D1样受体拮抗剂SCH-23390处理树突状细胞后, IL-5、IFN-γ分泌率降低,表明D1样受体拮抗剂使T细胞的反应转向Th1。此外,D2样受体拮抗剂不影响DC上CD86的表达水平以及IL-12的分泌[17]。最近的研究发现,在小鼠和人类的肺发育过程中,交感神经经历了多巴胺能到肾上腺素能的转换,在过敏原暴露的小鼠模型中,多巴胺DRD4通路增加了幼鼠肺部的Th2炎症。这些可能部分解释了幼儿易患哮喘的原因[18]。
2 多巴胺与肺部神经调节
肺组织存在大量的感觉神经纤维,当气道受到各种刺激时,感觉神经纤维可以启动保护性反射,如咳嗽、气管收缩。肺部神经的调控作用包括改变气道张力、粘液分泌、炎症等。哮喘患者在小气管周围有更密集的神经纤维网,且对空气中刺激物的反应阈值降低[19]。AHR是哮喘的特征表现,虽然气道炎症一直被认为是AHR的主要驱动因素之一,但许多证据表明神经活动和炎症细胞与气道神经之间的相互作用才是AHR发生的关键因素[20]。免疫细胞可以合成并释放神经递质和神经调节剂等物质,包括乙酰胆碱、多巴胺和其他儿茶酚胺,在局部免疫调节和更复杂的神经免疫调节通路中起作用。模式识别受体(PRRs)受体(包括Toll样受体(TLRs)和细胞因子受体(cytokine receptors,PRRs)不仅在免疫细胞上有表达,在神经元上也被证实存在,为病原体相关分子模式(PAMPs)同时调节免疫和神经元功能[21]。大脑中星形胶质细胞上的DRD2受体可以通过αB-晶体蛋白(CRYAB)调节先天免疫,使用DRD2激动剂喹吡罗可以减轻神经毒素1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)诱导的小鼠慢性炎症[22]。在OVA诱导的哮喘中,感觉神经元部分通过血管活性肠肽-垂体腺苷酸环化酶激活肽受体(VIP-VPAC2)轴驱动CD4+和ILC2细胞产生IL-5等细胞因子,而产生的细胞因子又可以反向激活感觉神经元[23]。在呼吸道中,多巴胺除了作为去甲肾上腺素前体外,还作为神经递质发挥作用。 人树突状细胞和Treg细胞选择性表达酪氨酸羟化酶,可以催化酪氨酸转变为多巴胺,并释放到组织间隙[15]。DRD1信号通过第二信使环磷酸腺苷(cAMP)负性调节NLRP3炎症小体,cAMP与NLRP3结合并通过E3泛素连接酶MARCH7促进其泛素化和降解[7]。
3 多巴胺与气道上皮和平滑肌功能
最初人们认为多巴胺受体只存在于肺组织血管上, 1995年,Kobayashi等[4]在兔肺组织切片中发现多巴胺D1样受体,提示多巴胺可能在呼吸系统中有着更复杂的作用。最近的一项研究表明多巴胺D1样受体拮抗剂SCH23390可以抑制乙酰胆碱收缩大鼠气管环多巴胺的支气管扩张作用[23],表明多巴胺D1样受体在气道平滑肌上有表达,通过激活细胞内cAMP的多种潜在信号通路诱导支气管扩张。
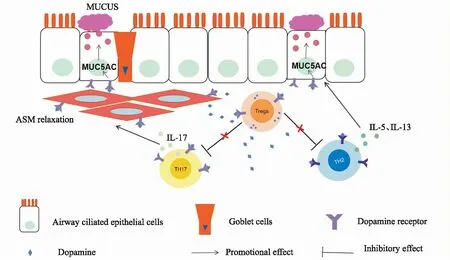
Fig 1 Dopamine and dopamine receptor in pathogenesis of asthma
同时也有研究者发现气道平滑肌上存在DRD2受体,通过cAMP调节气管舒张[24]。
气道上皮是气道屏障的第一道防线,在启动宿主防御和控制免疫应答中起着重要作用。在哮喘基因组筛查和全基因组关联(GWA)研究中发现了众多哮喘相关的基因和基因位点都在气道上皮细胞表达[25]. 这说明气道上皮在健康个体和哮喘病理学中的重要性。气道上皮为假复层单层柱状上皮,由纤毛细胞、杯状细胞、刷细胞、基细胞和小颗粒细胞等组成。纤毛细胞与粘液可将吸入的颗粒包裹在分泌的粘液中,纤毛将其向上输送到口腔,然后被吞咽或咳出,这被称为粘液纤毛清除系统。粘液成分尤其是粘蛋白的表达差异已被证实与哮喘的发病及死亡率相关[26]。粘蛋白是一种异质性糖蛋白由MUCIN编码,目前发现的粘蛋白已有21种,其中存在于呼吸道的主要为3种,气道上皮细胞和杯状细胞通常表达MUC5AC ,而黏膜下腺体的黏膜细胞主要表达MUC5B,它们对粘液的粘弹性和功能特性起着重要作用。哮喘患者的气道高反应性与MUC5AC的表达有密切关系[27]。多巴胺D1样受体激动剂SK83959可明显加重OVA致敏小鼠的支气管粘液分泌[5]。进一步研究发现在气道上皮细胞中也存在DRD1受体的表达,激活DRD1刺激人气道上皮细胞产生cAMP、CREB磷酸化进而促进MUC5AC的mRNA和蛋白表达[28]。
哮喘的发生是复杂的病理和病理生理过程,包括各类炎症细胞的浸润、炎症因子的相互作用、上皮细胞损伤以及气道重塑。多巴胺及其受体在炎症细胞上表达差异,影响着多种炎症细胞活化及炎症介质的释放,同时也影响着气道粘液分泌和平滑肌的收缩(见Fig 1)。这为哮喘患者多巴胺的用药,提供了更全面的思考。同时也提示,开发吸入性的肺部特异性多巴胺受体阻断剂或激动剂,或许能够控制和减轻哮喘患者症状。
