IL-36Ra抑制炎性痛小鼠脊髓A1型星形胶质细胞极化
2022-01-14朱怡文李玲玲
李 倩,朱怡文,李玲玲
(1. 上海市儿童医院,上海交通大学附属儿童医院,中心实验室,上海 200040; 2.上海交通大学医学遗传研究所,上海 200040; 3. 国家卫健委医学胚胎分子生物学重点实验室,上海市胚胎与生殖工程重点实验室,上海 200040
慢性炎性痛是一种严重破坏患者生活质量的常见疾病。尽管目前对炎性痛的分子机制尚未完全阐明,但脊髓中的促炎性细胞因子是公认的关键病理因素。IL-1β和IL-33等白介素(IL)-1超家族细胞因子可通过作用于其特异性受体参与炎性痛的发生发展[1]。
IL-36α(以前称为IL-1F6)、IL-36β(IL-1F8)和IL-36γ(IL-1F9)是最近报道的IL-1细胞因子家族新成员。IL-36细胞因子的每个成员都可通过结合IL-36受体(IL-36R)及IL-1R辅助蛋白(IL-1RAcP)激活下游丝裂原激活的蛋白激酶(mitogen-activated protein kinase, MAPK)和核转录因子(nuclear factor kappa B,NF-κB)等信号通路促进炎症反应[2]。而IL-36R拮抗剂(IL-36 receptor antagonist,IL-36Ra)可竞争性结合IL-36R,阻断IL-36R及其下游信号通路[3]。已证实,IL-36及其受体参与多种炎性疾病的病理过程。我们之前研究也表明,CFA炎性痛小鼠脊髓IL-36γ与IL-36R表达升高,而给予IL-36Ra可缓解小鼠痛行为[4]。但IL-36Ra缓解炎性痛的具体作用机制目前尚不清楚。
IL-36R在小鼠脊髓内主要表达于星形胶质细胞,星形胶质细胞作为中枢神经系统内数量最多的一类细胞,在炎性痛调控中至关重要。在外周炎性刺激时,脊髓星形胶质细胞可被激活,形态上增生、肥大,称为反应性星形胶质细胞。反应性星形胶质细胞释放的促炎、趋化因子可直接作用于神经元,导致中枢敏化,促进炎性痛维持与发展[5]。最新研究表明,星形胶质细胞激活后可向A1和A2两种不同的表型极化,A1型星形胶质细胞可分泌促炎性细胞因子,加剧神经炎症反应;A2型星形胶质细胞可分泌神经营养因子,具有神经保护性[6]。本研究旨在研究IL-36Ra对CFA炎性痛小鼠痛行为以及脊髓A1型星形胶质细胞极化的作用。揭示其缓解炎性痛的分子作用机制,为临床治疗炎性痛提供可能靶点。
1 材料
1.1 动物成年♂ C57BL/6小鼠53只,6-8周龄,体质量(25~30)g,由上海灵畅生物科技有限公司提供,动物生产许可证号:SCXK(沪)2018-0003。饲养环境为12 h光照/黑夜循环,温度(22-25)℃。
1.2 试剂CFA试剂购自Sigma公司(F5881-10 mL);IL-36Ra纯化蛋白购自R&D公司(2714-ML-025/CF);GFAP抗体购自Millipore公司(MAB360)、C3抗体购自Abcam公司(ab200999);FITC或Cy3标记的荧光二抗购自Jackson公司;RNA提取试剂盒购自Qiagen公司;逆转录试剂盒购于Takara公司,SYBR Green试剂购于Roche公司。
2 方法
2.1 动物分组与处理行为学实验将32只小鼠随机分为4组,每组8只:对照治疗组(CFA + Saline组)、IL-36Ra不同剂量治疗组:CFA+IL-36Ra 50 ng、CFA+IL-36Ra 100 ng、CFA+IL-36Ra 200 ng。每组均在造模后d 1至d 7鞘内注射给药,每日1次。造模后d 1、3、5、7检测各组小鼠痛行为变化。
分子实验将12只小鼠随机分为4组,每组3只:正常组、对照治疗组(CFA + Saline组)、CFA+IL-36Ra 100 ng组、CFA+IL-36Ra 200 ng组。造模及给药方法同行为学实验,给药7 d后新鲜取材脊髓组织用于RT-PCR实验。
形态学实验将9只小鼠随机分为3组,每组3只:正常组、对照治疗组(CFA + Saline组)、CFA+IL-36Ra 200 ng组。造模及给药方法同行为学实验,给药7 d后灌流固定取材脊髓组织用于免疫荧光实验。
2.2 动物模型建立外周炎性痛小鼠模型制备:固定小鼠,抓取小鼠右后爪,使用微量注射器向小鼠足底正中表面注射20 μL完全弗氏佐剂。
2.3 机械刺激缩足阈值分别在造模前以及造模后d 1、3、5、7检测各组小鼠的机械刺激缩足阈值 (mechanical withdraw threshold, MWT)。方法如下:将小鼠置于铺有小孔铁丝网的笼中适应至少30 min。然后使用一组von Frey弗莱毛(0.02、0.04、0.07、0.16、0.4、0.6、1.0和1.4 g)垂直刺激右侧后爪的掌面正中。采用Dixon介绍的Up and down方法测得小鼠的50% MWT[7]。
2.4 辐射热刺激缩爪潜伏期分别在造模前以及造模后d 1、3、5、7检测各组小鼠的辐射热刺激缩爪潜伏期(paw withdrawal latency,PWL)。具体方法:将小鼠放置在底部铺有玻璃板的亚克力笼中,将辐射热施加到右侧后爪足底表面,直到小鼠将其爪子从玻璃板上抬起。缩爪潜伏期为从辐射热开始到小鼠缩爪的时间,截止时间设为20 s[7]。
2.5 用免疫荧光法测定脊髓GFAP、C3表达正常、CFA+Saline以及CFA+IL-36Ra 200 ng小鼠在给药7 d后取材,每组3只。具体方法:采用1%戊巴比妥钠50 mg·kg-1腹腔注射麻醉后灌流多聚甲醛固定取材,取腰膨大段脊髓组织,经蔗糖梯度脱水OCT包埋后冰冻切片。采用小鼠来源GFAP以及兔来源C3一抗进行免疫荧光染色,激光共聚焦显微镜拍照采集结果。
2.6 用RT-PCR法检测星形胶质细胞标志物表达正常、CFA+Saline以及CFA+IL-36Ra 100和200 ng小鼠在给药7 d后新鲜取材,每组3只。具体方法:采用1%戊巴比妥钠50 mg·kg-1腹腔注射麻醉,生理盐水灌注后新鲜取材腰膨大段脊髓组织。提取脊髓组织的RNA,将RNA逆转录成cDNA,使用SYBR Green试剂进行实时荧光定量PCR反应。结果以2-△△Ct计算靶基因的转录水平。
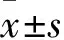
3 结果
3.1 IL-36Ra对CFA炎性痛小鼠MWT和PWL作用使用雄性C57BL/6小鼠成功建立CFA炎性痛小鼠模型。与造模前相比,各组小鼠在造模后d 1即出现MWT明显下降。而IL-36Ra 100、200 ng在连续给药5 d后可有效提高CFA小鼠造模侧机械痛阈,且较生理盐水对照组差异有显著性(P<0.05)。IL-36Ra 200 ng在治疗7 d后,可使CFA小鼠MWT恢复至造模前71.9%,明显缓解炎性痛小鼠机械性痛觉超敏(Fig 1A)。
CFA小鼠造模后各组PWL明显下降,出现明显热痛觉过敏。而IL-36Ra 100、200 ng连续给药3 d后,均可以明显提高CFA小鼠PWL(P<0.05)。IL-36Ra 100、200 ng在治疗7 d后,可使CFA小鼠PWL分别提高50.0%与66.2%(Fig 1B)。

Fig 1 Effects of IL-36Ra on ipsilateral MWT and PWL of CFA mice n=8)
3.2 IL-36Ra对CFA炎性痛小鼠脊髓反应性星形胶质细胞作用为了进一步探索IL-36Ra缓解炎性痛的作用机制,选取IL-36Ra有效剂量100 ng和200 ng观察其对脊髓反应性星形胶质细胞的作用。RT-PCR实验发现,CFA小鼠脊髓内星形胶质细胞激活标志物GFAP、Lcn2的mRNA表达水平较正常小鼠明显升高(P<0.05)。与生理盐水相比,IL-36Ra 100 ng与200 ng连续治疗7 d后均可明显抑制CFA诱导的GFAP mRNA水平升高。同时,IL-36Ra 200 ng可显著抑制Lcn2 mRNA水平升高(P<0.05)(Fig 2)。表明IL-36Ra可抑制CFA引起的小鼠脊髓星形胶质细胞激活。

Fig 2 Effects of IL-36Ra on mRNA expression changes of GFAP, Lcn2 in spinal cord of CFA mice n=3)
3.3 IL-36Ra对CFA炎性痛小鼠脊髓A1、A2型星形胶质细胞标志物表达的作用RT-PCR实验发现,在CFA小鼠上,IL-36Ra 200 ng连续治疗7 d可逆转CFA诱导的脊髓A1型星形胶质细胞标志物Serping1、H2-T23表达升高,且较生理盐水治疗组差异有显著性(P<0.05),见Fig 3A-B。CFA小鼠造模后脊髓A2型星形胶质细胞标志物S100a10、Ptx3的mRNA表达水平下降,但IL-36Ra治疗对其无明显影响(P>0.05),见Fig 3C-D。提示IL-36Ra可抑制CFA小鼠脊髓星形胶质细胞向A1型极化。
3.4 IL-36Ra对CFA小鼠脊髓A1型星形胶质细胞标志物C3表达影响为了进一步从形态上观察IL-36Ra对CFA小鼠脊髓星形胶质细胞激活以及向A1表型极化的作用,采用正常组、CFA+生理盐水组以及IL-36Ra有效剂量200 ng组进行形态学实验。免疫荧光实验发现,CFA+生理盐水组小鼠在造模后d 7,造模侧脊髓背角内A1型星形胶质细胞标志物C3与GFAP的信号均显著增多,星形胶质细胞增生、肥大(Fig 4)。而IL-36Ra 200 ng可抑制CFA小鼠脊髓中C3与GFAP信号升高。统计相对荧光强度发现,IL-36Ra治疗可以显著抑制CFA小鼠脊髓背角A1型星形胶质细胞标志物C3与GFAP的共定位信号水平(P<0.05),见Fig 5。

Fig 3 Effects of IL-36Ra on mRNA expression changes of A1 and A2 astrocyte maker in spinal cord of CFA mice n=3)

Fig 4 Effects of IL-36Ra on GFAP (green) and C3 (red) immunoreactivity in ipsilateral spinal cord dorsal horn of CFA mice (×200,n=3)

Fig 5 Statistical results of GFAP (green) and C3 (red) immunoreactivity in ipsilateral spinal cord dorsal horn of CFA mice n=3)
4 讨论
外周炎性痛是临床上最常见的症状之一,常伴发于局部感染以及关节肌肉炎症等病理过程。中枢敏化是炎性痛发生的重要病理机制。脊髓作为处理疼痛信息的低级中枢,外周神经传入的伤害性信息会在脊髓进行加工整合,继而上行投射到脑干与大脑皮层产生痛觉[8]。而由胶质细胞激活、促炎性细胞因子大量生成为特征的神经炎症可降低脊髓神经元兴奋性阈值,在炎性痛的发生发展中起了非常重要的作用[9]。本研究通过CFA进行炎性痛造模,小鼠造模后表现有稳定的痛行为,且脊髓内存在星形胶质细胞激活,说明存在神经炎症反应,进一步证实模型建立成功。
IL-36α、IL-36β和IL-36γ是IL-1细胞因子超家族的新成员,而在小鼠脊髓中仅可检测到IL-36γ表达。IL-36γ表达于脊髓神经元,而其受体IL-36R则主要表达于星形胶质细胞。IL-36γ/IL-36R作为一条新发现的神经元—星形胶质细胞间信号通路,可通过诱导星形胶质细胞激活促进神经炎症[4]。在本研究中,IL-36R拮抗剂IL-36Ra连续鞘内给药可显著缓解CFA小鼠机械性痛觉超敏与热痛觉过敏,证实IL-36R及其下游信号通路参与炎性痛过程。此外,IL-36Ra还有效抑制了脊髓星形胶质细胞激活,进一步证实阻断IL-36R可直接调节脊髓星形胶质细胞活性。
在神经炎症过程中,激活后的星形胶质细胞可向A1表型极化。有研究证实,A1型星形胶质细胞内C3等补体蛋白过度表达,生成大量SERPINA3、CXCL10等趋化因子、促炎因子[10]。而抑制脊髓星形胶质细胞向A1型极化可有效缓解慢性痛痛行为[11]。本研究发现CFA小鼠脊髓内A1型星形胶质细胞标志物表达升高,而IL-36Ra 200 ng治疗7 d后,A1型星形胶质细胞标志物明显降低。同时有体外试验证实,IL-36Ra可有效抑制IL-36γ诱导的原代星形胶质细胞内CCL2、IL-6表达升高[4]。进一步说明,IL-36R拮抗剂IL-36Ra可抑制脊髓星形胶质细胞向A1极化,进而抑制神经炎症反应。
关于IL-36Ra抑制A1型星形胶质细胞极化的分子机制,尚未完全阐明。有研究表明,小胶质细胞激活后释放的IL-1α、TNF-α和C1q可在直接体外诱导星形胶质细胞激活并向A1表型极化[12]。CFA炎性痛小鼠脊髓内,已证实存在小胶质细胞激活、TNF-α炎症因子大量生成等病理变化[13]。因此,我们推测在炎性痛造模后,脊髓小胶质细胞激活并释放促炎性细胞因子,进而诱导星形胶质细胞向A1型极化。虽然有研究表明,抑制神经痛大鼠脊髓小胶质细胞激活可阻止星形胶质细胞A1型极化[14]。但IL-36Ra可直接与星形胶质细胞表面IL-36R结合并阻断第二受体IL-1RAcP的募集来拮抗下游信号通路,调节星形胶质细胞活性[15]。有证据表明,IL-36Ra可抑制脊髓星形胶质细胞内JNK、NF-κB等信号通路激活[4]。因此我们认为,IL-36Ra可通过直接调控星形胶质细胞内信号通路,而非通过抑制小胶质细胞激活,来阻断脊髓A1型星形胶质细胞极化。
综上所述,CFA小鼠脊髓内星形胶质细胞激活并向A1型表型极化,IL-36Ra可抑制星形胶质细胞向A1型极化并缓解炎性痛。本研究结果首次证实了IL-36R对脊髓A1型星形胶质细胞极化的调节作用,为神经元-星形胶质细胞间的功能调节提供了新的线索与思路,而IL-36Ra可能成为外周炎性痛有效的治疗药物。
