HSCT 患儿血浆中白消安的浓度测定及暴露量研究*
2022-01-14杜小换黄晨蓉胡绍燕刘筱雪朱增燕刘纪松王文静缪丽燕
杜小换,黄晨蓉,胡绍燕,刘筱雪,董 吉,朱增燕,刘纪松,李 芳,王文静,缪丽燕**
1 苏州大学附属儿童医院 药剂科,苏州 215025;2 苏州大学附属第一医院 药学部,苏州 215006;3 苏州大学附属儿童医院 血液科,苏州 215025;4 浙江佰辰医疗科技有限公司,杭州 310000
白消安(BU)是儿童造血干细胞移植(HSCT)预处理方案中的重要组成药物。根据国际血液和骨髓移植研究中心(CIBMTR)的分类方法,BU 总剂量大于9 mg·kg-1的预处理方案为清髓方案(MAC),BU低于此剂量的方案为降低强度预处理方案(RIC)。MAC 方案下的多项研究表明,在儿童患者中BU 药动学存在个体差异性[1,2],且BU 治疗窗范围窄,BU体内暴露与HSCT 患者的移植后治疗结局及毒副作用存在显著相关性,最佳暴露范围尚有待确立[3]。国外多个移植中心通过开展BU 治疗药物监测(TDM)探索儿童患者的BU 最佳暴露范围,以期改善移植治疗结局,减少BU 高暴露产生的毒性反应[4,5]。由于RIC 方案中BU 用药疗程更短(1~2 天),这对TDM的时效性要求非常高,因此目前RIC 方案下的相关研究少,尤其是在儿童患者中[6]。
根据文献报道,BU 血药浓度检测方法主要有高效液相色谱法(HPLC)[7,8]和液相色谱串联质谱法(LC-MS/MS)[9,10]等。其中LC-MS/MS 法具有检测特异性、灵敏度、准确度高及检测速度快等优点,日渐成为TDM 主流分析技术和检测“金标准”。
本研究拟建立LC-MS/MS 法检测患儿血浆中BU 药物浓度,并对RIC 方案下患儿体内BU 暴露情况进行估算,为进一步开展儿童HSCT 患者BU 药动学和药效学研究提供技术支持和理论参考。
1 材 料
1.1 仪器与设备
高效液相色谱串联质谱联用仪(Waters 公司,型号Xevo TQD,配备电喷雾离子化源(ESI)以及MassLynx V4.1 数据处理软件);电子分析天平(Mettler Toledo 公司,型号XS105DU)等;超纯水仪(Millipore 公司,型号Direct-Q5 UV);台式高速离心机(北京白洋医疗器械有限公司,型号G20)。
1.2 药品和试剂
BU 对照品(纯度>98%,批号S1111AS,大连美仑生物技术有限公司);BU-D8 对照品(纯度为≥98%,批号D021161-1004,CFW Laboratories,Inc);BU 注射液(规格10 mL:60 mg,Otsuka Pharmaceutical Co.,Ltd.);甲醇、乙腈、甲酸为色谱纯;试验用水为纯化水。
2 方法与结果
2.1 色谱条件
色谱柱:Waters ACQUITY UPLC BEHC18(50mm×2.1 mm,1.7 μm);以含10 mmol·L-1甲酸铵和0.1%甲酸的水溶液为水相(A),以含0.1%甲酸的乙腈溶液为有机相(B),采用梯度洗脱法(程序为:0~0.5 min,95%A;0.5~1.5 min,95%A→5%A;1.5~2.2 min,5%A;2.2~2.3 min,5%A→95%A;2.3~3 min,95%A);流速:0.4 mL·min-1;柱温:40 ℃;进样量:2 μL。
2.2 质谱条件
采用ESI 和多反应监测(MRM)模式检测;毛细管电压:3.0kV;离子源温度:150℃;脱溶剂温度:400℃;脱溶剂气流速:800L·h-1;锥孔气流速:20L·h-1。BU 离子通道为m/z 264.10→150.90;锥孔电压为25 V,碰撞能量10 V;BU-D8 离子通道为m/z 272.10 →159.10,锥孔电压为25 V,碰撞能量11 V。
2.3 溶液配制和处理
2.3.1 对照品溶液 精密称取BU 对照品11.90 mg,置于30 mL 棕色玻璃瓶中,用电子移液器精密加入乙腈11.67 mL 使溶解,制成浓度为1.0 mg·mL-1的BU 对照品储备液;取该液适量,然后用甲醇-水(1∶1,V∶V)定量稀释,制成其质量浓度分别为1.0、2.0、5.0、10.0、20.0、50.0 和100.0 μg·mL-1的系列对照品溶液,以及其质量浓度为1.5、15.0、80.0 μg·mL-1的质控(QC)溶液。
2.3.2 内标溶液 精密称取BU-D8 对照品10.00mg,置于10 mL 容量瓶中,用甲醇-水(1∶1,V∶V)溶解并稀释至刻度,制成浓度为1.0 mg·mL-1的BU-D8 内标储备液,取该液适量,用乙腈定量稀释制成浓度为0.25 μg·mL-1内标乙腈溶液。
2.4 血浆样品配制和处理
取空白血浆90 μL 加入1.5 mL 离心管中,分别加入“2.3.1”项下不同质量浓度的BU 对照品溶液以及QC 溶液各10 μL,得到标准曲线和QC 血浆样品,然后分别加入0.25 μg·mL-1的BU-D8 乙腈溶液300 μL,涡旋混匀3 min,15000 r·min-1离心8 min,取上清液100 μL 至进样瓶中,进样量2 μL。
2.5 专属性考察
分别取6 份不同来源的空白血浆、标准血浆样品和患者用药后的血浆样本,除空白血浆中用乙腈等量代替BU 对照品溶液和BU-D8 内标溶液外,其余按照“2.4”项下的操作方法进行配制、处理,然后进样测定,分别记录色谱图,见图1、图2、图3。由图可见,BU 和BU-D8 的保留时间均为1.34 min;血浆内BU 和BU-D8 内标物的峰形良好,分离较为完全,不受血浆中内源性物质干扰。
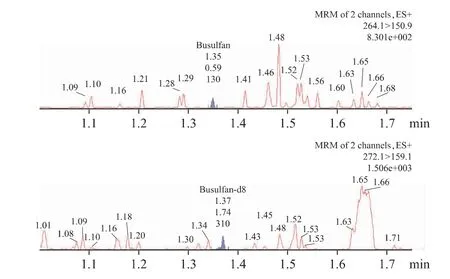
图1 空白血浆色谱图

图2 BU 标准血浆样品(0.2 μg·mL-1)与BU-D8内标物色谱图

图3 某患者BU 首剂给药后2 h 血浆样本与BU-D8内标物色谱图
2.6 标准曲线绘制
按照“2.4”项下方法操作,制备不含对照品和内标的空白血浆样品1 份、不含对照品含内标的空白血浆样品1 份,以及浓度为0.1、0.2、0.5、1.0、2.0、5.0、10.0 μg·mL-1的标准曲线血浆样品7 份,处理后进样测定。
以BU 浓度(μg·mL-1)为横坐标(X),BU 与内标物BU-D8 峰面积的比值(ABU/ABU-D8)为纵坐标(Y),采用加权最小二乘法进行回归运算,求得直线回归方程为:Y=1.416X+0.0103(r=0.999),BU 浓度在0.1~10.0 μg·mL-1范围内线性关系良好,定量下限(LLOQ)为0.1 μg·mL-1。
2.7 准确度和精密度
按照“2.4”项下的操作方法分别配制LLOQ,低、中、高4 个浓度的QC 血浆样本各6 份,处理后进样分析,连续测定3 批。批内和批间准确度(RE)分别为101.4%~103.7%和101.1%~103.5%,批内和批间精密度(RSD)分别为4.3%~5.1%和3.2%~6.9%,均符合《中国药典》2020 年版的要求。见表1。
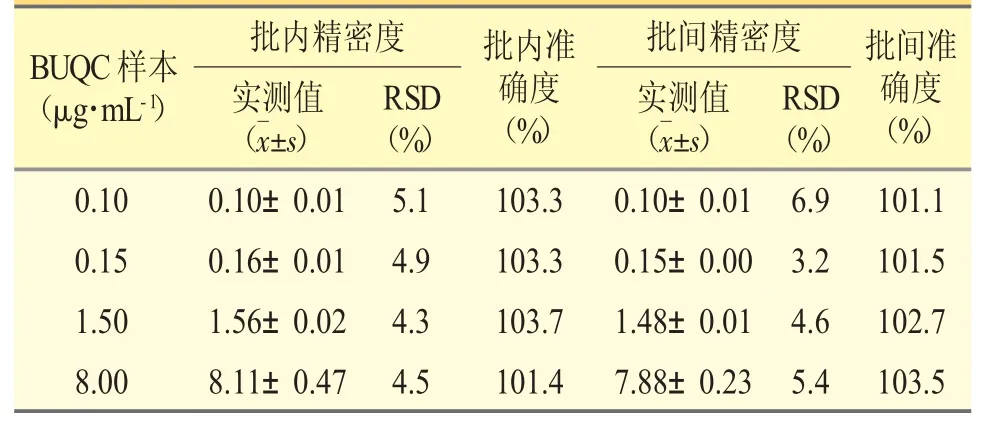
表1 BU 精密度、准确度实验结果(n=6)
2.8 提取回收率和基质效应
按照“2.4”项下的操作方法分别配制和处理低、中、高血浆样品各6 份,定为A1 组;取6 个不同来源的空白血浆各100 μL,先加入乙腈进行蛋白沉淀后取上清液,再分别加入等量3 个不同浓度BU QC溶液和BU-D8 内标溶液,定为A2 组;以A1 组中BU 峰面积与A2 组中BU 峰面积的均值之比计算提取回收率。以等体积纯化水代替空白血浆,分别加入3 个不同浓度BU QC 溶液各10 μL,定为A3组;以A2 组BU 和BU-D8 峰面积与A3 组中BU 和BU-D8 峰面积的均值之比分别计算基质因子,再计算经内标归一化的基质因子。结果显示,平均提取回收率为(111.2±11.8)%,经内标归一化的基质效应均<15%,说明该方法提取过程中药物几乎没有损失,基质对BU 和BU-D8 内标物的测定影响较小。见表2。

表2 BU 提取回收率与基质效应实验结果(n=6)
2.9 稳定性试验
分别配制低、高两个浓度的血浆样本各3 份进行稳定性试验。结果显示,BU 血浆样品在室温放置4 h、经历反复冻融3 次和血浆样品处理后进样器内放置24 h 条件下均可保持稳定,见表3。
表3 BU 血浆样品稳定性实验结果(±s,n=3)

表3 BU 血浆样品稳定性实验结果(±s,n=3)
2.10 血浆中的BU 浓度测定与体内暴露量计算
收集苏州大学附属儿童医院血液科移植病房中采用RIC 方案的病例,即BU 基于患儿体重,按0.8 mg·kg-1计算每剂给药量,每剂持续静脉输注2 h,每天给药4 次,连续用药2 天。分别采集BU首剂给药后即刻(记为2 h)、4 h、6 h 外周静脉血约2 mL,记录准确采血时间(精确到分钟),血样收集于EDTA 抗凝管内,于0.5 h 内转移至实验室,以4000 r·min-1离心5 min 分离血浆,按照“2.4”项下处理后进行血药浓度测定。使用NextDose 贝叶斯回归模型分别计算患儿体内BU 的暴露情况(以AUC 表示)。
本研究入组患儿21 例,中位年龄为5.4 岁(2.0~15.8 岁),体重18 kg(11~60 kg),BU AUC 中位值为1191.23(775~2511.57)μmol·min·L-1,其他临床信息见表4。

表4 RIC 方案下患儿临床信息及BU 暴露结果
3 讨论
本研究使用BU-D8 同位素内标,建立了测定HSCT 患儿血浆中BU 浓度的LC-MS/MS 法,该方法采用乙腈进行蛋白沉淀,前处理操作简单快速,蛋白沉淀完全。在流动相的选择方面,首先以0.1%甲酸水溶液为水相,乙腈为有机相,但试验后发现BU 及内标物BU-D8 的响应值均较低,故而参考文献[9]尝试将水相中加10 mmol·L-1甲酸铵,有机相中加入0.1%甲酸,响应明显提高。该方法中血浆用量少(100 μL),适合儿童患者开展BU治疗药物检测。
经模型估算,本研究中RIC 方案下21 例患儿首剂给药后的BU 暴露量存在个体差异性,这与MAC 方案下的其他研究结论一致[11-13]。与美国FDA推荐方案下[14]的目标暴露范围(900~1350 μmol·min·L-1)相比,本研究中有33.3%的患者未能达到目标值。因此,患者移植后疗效以及毒副反应发生情况有待继续随访,应通过进一步分析BU AUC 在患儿个体间出现差异的影响因素以及不同暴露情况下患儿的移植后疗效及安全性,建立BU 最佳暴露范围,从而达到实现BU 个体化给药,改善患儿移植治疗结局的目的。
