牛源多杀性巴氏杆菌主要荚膜群和脂多糖基因型两组三重PCR 检测方法
2022-01-13李霄阳刘文晓章振华徐福洲陈小玲李永清
李霄阳,许 建,刘文晓,章振华,徐福洲,陈小玲,李永清
(北京市农林科学院畜牧兽医研究所,畜禽疫病防控技术北京市重点实验室,北京 100097)
牛出血性败血症,也称牛巴氏杆菌病,是由某些血清型的多杀性巴氏杆菌(Pasteurella multocida,Pm)引起牛的一种高发病率、高死亡率急性败血症或肺炎型疾病,对养牛业危害严重,世界动物卫生组织(OIE)将其列入须通报动物疫病名录[1]。Pm 分为A、B、D、E、F 5 个荚膜血清群和16 个脂多糖(LPS)血清型(1~16)[2-3],二者结合构成完整的血清学分型系统[4]。在国外,牛源Pm 主要有B:2、B:5、E:2、A:1 和A:3 血清型。我国2006 年以前主要流行B:2、B:5 型,2008 年以来我国至少有一半省区市发生或流行过A 型巴氏杆菌病[5-6]。
过去对该病原的实验室诊断依靠细菌分离、生化试验和动物致病性试验。而为进行流行病学调查和疫苗研发,还需要鉴定分离株的血清群和血清型。传统血清学方法成本高,操作繁琐耗时,制备高质量抗血清难度大,且敏感性和特异性差,使得Pm 荚膜分群和LPS 分型的血清学方法难以推广应用。近年来核酸检测方法逐渐用于鉴定Pm 种、血清群以及血清型所对应的基因型[7-8]。Townsend 等[7]建立的Pm 种和荚膜分群六重PCR 方法已被纳入OIE《陆生动物诊断试验与疫苗手册》[1]。鉴于我国牛源Pm 分离株血清群至今仅限于A 群和B 群,本研究选择此六重PCR[7]中的Pm 种和荚膜A、B群引物并做了部分修改,优化建立了鉴定Pm 种和荚膜A、B 群的三重PCR(PmAB-3PCR),以方便国内使用。
随着疫苗研究的深入,LPS 被发现是Pm 的主要免疫保护性抗原[8]。Harper 等[8]建立了以Pm 脂多糖外核生物合成基因为基础的LPS 基因分型八重PCR,将Pm 分为8 个基因型,用它取代复杂且分型能力低的传统1~16 分型系统。该方法在国内也有了初步应用[6,9]。鉴于牛Pm 的主要基因型为L1、L2和L3型,分别对应传统1~16型中的1、14型,2、5 型和3、4 型。本研究选出此八重PCR 中的L1、L2 和L3 型引物[8],构建鉴定LPS 基因型的三重PCR(LPS-3PCR)。在此,将PmAB-3PCR和LPS-3PCR 的建立、模拟临床检验以及与传统血清学分型方法的比较试验总结如下。
1 材料与方法
1.1 试验菌株
本试验所用30 株Pm(表2)及7 株其他菌株,由国家兽医微生物菌种保藏中心(CVCC)、澳大利亚昆士兰大学Pat Blackall 教授、华中农业大学胡长敏博士、哈尔滨兽医研究所提供或本实验室保存。
1.2 实验动物及病料
体质量2 kg 新西兰家兔、12 周龄SPF 鸡和SPF 级BALB/c 小鼠,购自北京维通利华试验动物技术有限公司;牛鼻拭子样品,采自北京市某奶牛场。
1.3 PCR 模板及制备
挑取血清TSA平板上过夜培养的菌落3~5个,悬浮于50 μL 无菌去离子水,用煮沸法粗提DNA,即煮沸10 min,冰上冷却3~5 min,12 000 r/min 离心2 min,取上清为模板。PCR 敏感性试验所需纯化DNA 样品,经细菌DNA 试剂盒提取后使用。
1.4 PCR 引物
参考文献[7-8]合成3 对PmAB-3PCR 引物和3 对LPS-3PCR 引物(表1)。
1.5 体系优化
在25.0 μL 反应体系中,分别优化模板DNA质量浓度(5 pg/μL~50 ng/μL)、引物浓度(10 pmol/μL的PmAB-3PCR 引物每条0.1~0.8 μL,10 pmol/μL的LPS-3PCR 引物每条0.25~2.0 μL)、4 个不同公司或型号的2×PCR premix 试剂、退火温度(47~57 °C)和PCR 扩增循环数(25~40)等PCR条件。PCR 反应完成后,分别取产物7.0 μL,用1.0%琼脂糖凝胶电泳检测。
1.6 PmAB-3PCR 特异性检验
用A、B、D、E、F 群参考菌株和7 株非Pm 菌株(溶血性曼氏杆菌、隐秘杆菌、猪胸膜肺炎放线杆菌、多动物链球菌、奇异变形杆菌、金黄色葡萄球菌、大肠杆菌)检验该PCR 方法的特异性,对部分阳性PCR 产物进行测序验证。
1.7 PmAB-3PCR 和LPS-3PCR 敏感性检验
将已知 A 群、B 群和LPS 型菌株的DNA 样品10 倍系列稀释成50 ng/μL~5 pg/μL。将这些菌株在TSB 中振荡培养16 h,进行活菌计数后10 倍系列稀释成106~102CFU/μL。以系列稀释的DNA和菌液样品各2.0 μL 进行PCR 检验。
1.8 感染小鼠组织样品检验
用A 群和B 群Pm 的TSB 过夜培养物0.3 mL腹腔注射小鼠各5 只,在小鼠死亡后取肺、心、肝组织接种TSA 分离Pm,并用试剂盒提取DNA 进行PmAB-3PCR 检测。设空白对照2 只,注射TSB培养基0.3 mL,同样取组织进行细菌分离和PCR鉴定。
1.9 牛鼻拭子样品检验
从某奶牛场随机采100 份牛鼻拭子,接种含小牛血清的TSA 和TSB,培养过夜,分离疑似Pm,并在其中10 份鼻拭子培养物(约含杂菌107CFU/μL)中加入等体积过夜培养的Pm A 型菌株,另外10 份中加入等量Pm B 型菌株(含Pm 2×106~3×106CFU/μL),全部进行PmAB-3PCR检测。
此外在25.0 μL PCR 体系中,加入1.0 μL 上述鼻拭子培养物(不含目的菌,约含杂菌107CFU/μL)和106~102CFU/μL 系列稀释的PmA 或PmB 菌液1.0 μL,然后进行PCR 检测,检验PmAB-3PCR 检测人工污染牛鼻拭子样品的敏感性。
1.10 PCR 分群分型与常规血清学分群分型比较
参照文献[1,3]用参考株和本实验室分离株各2 株制备A 群和B 群兔抗血清,用LPS 1~4 型参考株制备1~4 型LPS 鸡抗血清;将所有Pm 参考株和分离株制备不耐热荚膜抗原和耐热LPS 抗原;荚膜分群琼扩试验用0.2 mol/L PBS 加1%琼脂糖制备琼脂板,LPS 分型琼扩试验用8.5%生理盐水加0.9%琼脂糖制备琼脂板,对30 个Pm 参考菌株的荚膜和菌体抗原进行分群分型检验。同时对这30 个菌株按照优化后的方法进行PmAB-3PCR和LPS-3PCR 检测,对PmAB-3PCR 无法鉴定的菌株,用D、E、F 群引物[1]进行单个PCR 鉴定。最后,将PCR 结果与琼扩试验结果进行比较。
2 结果
2.1 优化后的PCR 反应条件
PmAB-3PCR 反应体系为25.0 μL:无菌去离子水8.1 μL,2×PCR premix 12.5 μL,10 pmol/μL的Pm 种引物各0.3 μL,B 群引物各0.3 μL,A 群引物各0.6 μL,模板2.0 μL。PCR 反应程序:94 °C,3 min;94 °C 30 s、55 °C 30 s、72 °C 1 min,30 个循环;72 °C 10 min 延伸后4 °C 保存。PCR 电泳结果见图1-A。LPS-3PCR 反应体系:10 pmol/μL 的L1 型引物各1.0 μL,L2 型引物各1.0 μL,L3 型引物各0.5 μL,其余成分和PCR 程序与上述PmAB-3PCR 相同。PCR 电泳结果见图1-B。
2.2 PmAB-3PCR 特异性
PmAB-3PCR 特异性试验结果见图2。阳性A群和B 群菌株扩增出两条带,分别为A 群或B 群特异性条带和Pm 种特异性条带;D、E、F 群只扩增出Pm 种特异性条带;7 株非巴氏杆菌PCR 结果均为阴性。PCR 扩增产物测序结果与目的片段序列一致。
2.3 PmAB-3PCR 和LPS-3PCR 敏感性
用已知Pm 荚膜群、LPS 基因型的纯化DNA为模板,检验了两组三重PCR 的敏感性。PmAB-3PCR 每个反应可检出10~100 pg DNA 和200~2 000 CFU,LPS-3PCR 每个反应可检出1 ng DNA和2 000~20 000 CFU。DNA检测结果见图3-A、B。
2.4 PmAB-3PCR 检测模拟临床样品
从10 只感染小鼠的30 份组织样品中,全部分离并扩增出A 群或B 群Pm,而从2 只对照小鼠的6 份组织样品中未分离和扩增出A 群或B 群Pm,细菌分离和PCR 检验结果100%一致。部分PCR 检测结果如图4 所示。从100 个牛鼻拭子样品中未分离到疑似Pm,进而用鼻拭子肉汤培养物进行PmAB-3PCR 检测。除人为加入A 群或B群Pm 菌液的20 份鼻拭子样品PCR 检测结果为阳性外,其余样品均为阴性。100 个拭子中的48 个拭子PCR 检测结果见图5。检测人工污染鼻拭子样品的敏感性结果见图6,每个反应可检出1 000 CFU。
2.5 PCR 与传统血清学分群分型比较
琼扩试验和PCR 试验对30 个菌株的分群分型结果见表2,PmAB-3PCR、LPS-3PCR 分别与琼扩试验分群分型的统计学比较结果见表3。因为D、E、F 群没进行荚膜分群琼扩试验,所以比较荚膜分群时除去了D、E、F 群3 个参考株和2 个PCR 鉴定为D 群的澳大利亚菌株,只统计余下的25 株;30株Pm 都进行了LPS1~4 型琼扩试验和LPS-3PCR分型试验并进行了比较。
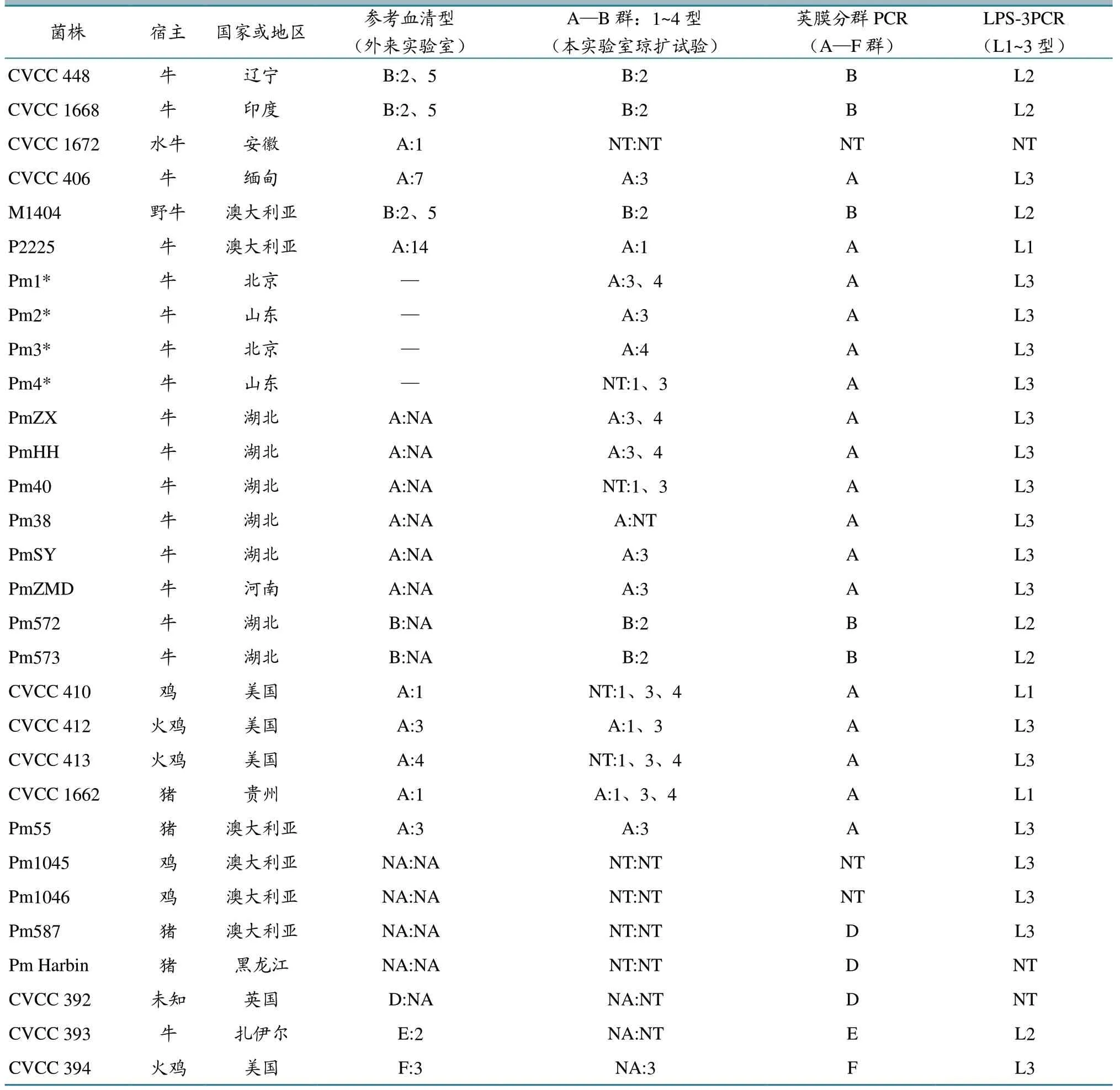
表2 试验所用Pm 菌株和分群分型结果

表3 多重PCR 与琼扩分群分型比较结果
综合分析试验结果和参考分型信息,对于荚膜分群,PmAB-3PCR 和琼扩试验的检出率(阳性率)分别为88%和72%,经t 检验,二者差异不显著(P>0.05);对于LPS 分型,LPS-3PCR 与琼扩试验的检出率分别为90%和50%,经t 检验,二者差异显著(P<0.05)。PmAB-3PCR 和琼扩试验分群方法的符合率为84%,LPS-3PCR 和琼扩试验分型方法的符合率为60%。
3 讨论
Townsend 等[7]建立的Pm 种和荚膜分群六重PCR 已被写入OIE《陆生动物诊断试验与疫苗手册》。但OIE 手册也指出用该多重PCR 系统做出的分型结果可能不清楚,遇到这种情况建议将扩增Pm 种的引物,从多重PCR 中剔除(即单独鉴定种)。该PCR 方法在国内外已得到广泛应用。各实验室根据各自国家、地区的流行血清型,选择性使用其中的荚膜分群引物。本研究开始也利用Townsend 等[7]设计的3 对引物进行PmAB-3PCR研究,但发现检测敏感性较低,故修改了Pm 种和荚膜A 群这2 对引物(其他报道[5]也对A 群引物进行了修改)。修改后的引物特异性有保证,且敏感性提高了1~2 个数量级。Townsend 等[7]和Harper等[8]建立的多重PCR 没有报道PCR 模板检测限。2010 年段新华等[10]建立了检测Pm 及3 个血清群的四重PCR 方法,发现其对B 群(该文中将B 群错写成了E 群)的检测限为2.5 ng。本研究未包括E 群,因为E 群在国内从未报道过,与本研究建立PmAB-3PCR 的目的不符。
本研究发现,PmAB-3PCR 的敏感性为10~100 pg DNA 和200~2 000 CFU,LPS-3PCR 的检测限为1 ng DNA 和2 000~20 000 CFU。LPS-3PCR 的敏感性虽然偏低,但LPS 基因型鉴定是在Pm 种和荚膜群签定出结果之后,届时分离株已被保存收藏,模板量不成问题。PmAB-3PCR 对感染小鼠和污染牛鼻拭子样品的PCR 定性与细菌分离结果完全一致,对污染牛鼻拭子样品的敏感性为1 000 CFU,略低于检验A 群纯Pm 菌液样品。
有学者认为,Pm 是动物和人类口腔、鼻咽部、上呼吸道的常在菌或条件致病菌[11-12]。试想如果能从健康牛鼻咽拭子中检出Pm,那么从病牛鼻咽拭子就更容易检出,这将有助于该病的早期诊断和早期治疗。在牛鼻咽拭子Pm 核酸检测方面,国外有很多研究,从兽医到人医,用核酸检测方法检测细菌、病毒,诊断疫病,越来越追求能从活动物(特别是牛这样的大动物)和人体上找到病原。本研究从一个临床健康奶牛场随机采集了100 份鼻拭子,经细菌分离培养和PCR 检测,结果均为阴性,分析原因可能有以下几方面:(1)健康牛鼻腔带Pm 量低。研究[12]显示,从健康牛场运出后2 d 进行二代测序检测到的Pm 只有运出当天的约1/5,到14 d 则降为约1/10。(2)使用的拭子长度不够。国外给成年牛用20~27 cm 拭子,国内能买到的最长拭子是15 cm,达不到鼻咽部[13]。(3)鼻拭子过夜培养,使得本来就少的目标菌被杂菌掩盖(活菌计数达1010CFU/mL)。更多研究[13-15]表明,从患呼吸道病或潜在呼吸道病牛的鼻咽拭子中检出Pm 的可能性更大。
Carter[2]建立的经典Pm 荚膜抗原分群方法是间接血凝试验(IHA),但此法非常繁琐、耗时。OIE 在手册中将琼扩试验也列入Pm 荚膜抗原分群方法。Heddleston 等[3]建立的LPS 抗原血清分型系统只有琼扩试验方法。本研究在进行PCR 与琼扩试验比对中发现:两组PCR 方法除了各有3 株不可分群或分型外,其他菌株都可以明确分入一个群或一个基因型;而琼扩试验有7 株不可分群,8株不可分型,另外7株有多个血清型或交叉反应(表2~3)。因此,本研究将试验结果与参考血清学信息不一致的菌株进行了重复验证和分析,如参考株CVCC1672、CVCC 信息显示为A:1 型,但用传统方法和PCR 都不能将其定群定型,只能鉴定其为Pm;延伸测序发现,其与A 群PCR 引物序列匹配度很低,与A 群荚膜合成基因序列的同源性只有87%(GenBank 中A 群Pm 间此序列相似性大多在99% 以上)。另外CVCC406 株参考信息为A:7 型,而本研究进行的琼扩和PCR 检测结果一致,均为A:3型和A:L3,故将这株计入了有多型或交叉反应。还有6个参考株与分离株琼扩试验分型显示有1、3、4 型间的交叉反应。有报道[16]称,Pm 传统分型中1 个菌株中有1 种以上LPS 抗原的不在少数,如A:3、4、7,A:4、7,A:3、4、12 型。Harper 等[8]的LPS 基因分型研究也报告了有传统血清学分型为7型,1、3 型,1、4 型,1、3、4 型的澳大利亚分离株用液相色谱进行LPS 成分分析(作为金标准)和LPS-mPCR 分型检测均为L3 型(对应于血清3、4 型)的情况。本试验检测的参考株和分离株大多是已知血清群和血清型或经同行实验室用PCR 鉴定到群的菌株,与本试验结果基本一致,说明这两组三重PCR结果正确可信且优于传统血清学方法,特别是LPS-3PCR 的检出率(90%)显著高于传统分型方法(50%)。Harper 等[8]建立的LPS-mPCR可对57/58(98.3%)的菌株正确分型,而琼扩试验只能对20/58(34.5%)的菌株正确分型;Turni等[17]用传统方法和Harper 等[8]的LPS-mPCR 对43 株猪Pm 进行了LPS 分型,结果琼扩试验有33株(77%)不可分型或有多个型,而用LPS-mPCR全部给出了可靠和可重复的分型结果,且无交叉反应。
总之,本研究建立了特异、敏感的检测牛源Pm 及荚膜A、B 群的三重PCR(PmAB-3PCR)和LPS 基因分型三重PCR(LPS-3PCR),前者可从人工感染小鼠组织和加入了Pm 的健康牛鼻拭子培养物(含大量杂菌)中直接检测出Pm 及其荚膜群。对30 个菌株进行了PCR 与传统血清学鉴定,证明了PCR 分群分型方法成本低、简便高效,特别是LPS-3PCR 较少产生无法分型或多型交叉情况,这对流行病学调查和灭活苗菌株筛选至关重要。下一步拟收集有疑似呼吸道疾病的牛深部鼻咽、口咽拭子和组织样品,进行短时增菌后提取或直接提取核酸进行PCR 检测,以检验这两组PCR 的临床应用效果。
