C反应蛋白/白蛋白比率在接受动脉化疗栓塞术结合射频消融术肝癌患者中的预后评估价值*
2022-01-13谭婉燕曹卉余红露郑君沈莹
谭婉燕,曹卉,余红露,郑君,沈莹
430077 武汉,华中科技大学同济医学院附属梨园医院 消化内科(谭婉燕、曹卉、余红露、郑君),老年病科(沈莹)
肝细胞癌(hepatocellular carcinoma,HCC)是全球发病率排名第6位、死亡率排名第4位的消化道恶性肿瘤,严重威胁人类健康[1]。目前,外科手术仍是HCC最佳的治疗方式[2-3]。然而,某些患者在确诊时已属晚期或肝功能较差,失去了外科手术的机会。目前,动脉化疗栓塞(transarterial chemoembolization,TACE)联合射频消融术(radiofrequency ablation,RFA)被推荐作为不可切除HCC的主要治疗方法[4-5],但患者的整体预后仍然不佳[6]。因此,寻找能早期预测患者预后不良的生物标志物,将患者进行合理分层并制定个体化治疗方案,对改善不可切除HCC患者的临床结局具有积极意义。近年来,系统性炎症-免疫反应已被证实与肿瘤进展和转移密切相关[7]。作为重要的炎症—免疫评估指标,C反应蛋白/白蛋白比率(C-reactive protein/albumin ratio,CAR)已被报道与多种不同类型癌症患者的预后密切相关,其值升高提示预后不良[8]。然而,关于CAR在接受TACE联合RFA治疗HCC患者中的预后评估价值尚无报道。因此,本研究旨在通过回顾性分析在我院接受治疗的HCC患者的临床预后资料,以探究CAR对接受TACE联合RFA治疗HCC患者的预后评估价值。
1 资料和方法
1.1 研究对象
选取于2012年1月至2014年10月在华中科技大学同济医学院附属梨园医院接受TACE+RFA治疗的98例HCC患者为研究对象。HCC的诊断依据为美国肝脏研究协会标准[9]:即经组织病理活检或2种显示典型HCC特征的影像学技术确诊。纳入标准为:1)HCC初诊患者;2)C反应蛋白和白蛋白水平检测时限为在治疗前1周内;3)临床预后资料完整。排除标准为:1)有临床证据表明伴发其他系统肿瘤、感染或炎症状态的患者;2)TACE+RFA治疗后接受了化疗的患者。本研究获得我院医学伦理委员会批准,所有患者均签署知情同意书。
1.2 临床病理资料收集
所有纳入患者的临床病理资料均从患者的保存病历中获取,包括性别、年龄、最大肿瘤直径(cm)、肿瘤数目、肝功能Child-Pugh分级、血清甲胎蛋白水平(ng/dL)、治疗前的C反应蛋白和白蛋白水平、以及是否有肝硬化及门静脉癌栓。其中,CAR定义为治疗前基线水平的CAR水平。
1.3 治疗方法
TACE:1)选择性行肠系膜上动脉造影以评估肿瘤的病理特征,包括大小、数量、形状和肿瘤的供血动脉;2)使用选择性/超选择性技术,将之前放置在肝动脉部位的柔性同轴微导管选择性地插入肿瘤供血动脉中;3)放置微导管后,将吡柔比星(15 mg/m2)、羟基喜树碱(8 mg/m2)和碘油(5~10 mL)的混合物经导管注入;4)用栓塞材料(如明胶海绵颗粒或聚乙烯醇颗粒)栓塞血管,直到肿瘤供血动脉血流完全停滞。为减轻相关副反应,在接受TACE治疗前提前预防性使用止吐等药物。
RFA:RFA采用内部冷却电极进行,电极末端约2 cm或3 cm暴露在外。局部麻醉后,在CT引导下将电极针经皮导入肿瘤中,射频治疗直到肿瘤完全消融,并密切注意避免接触肝内的大血管和肝内胆管。患者在接受TACE术后1周内接受RFA治疗。
1.4 随访
以患者确诊当日为随访起点,采用电话随访、门诊复诊或住院病历资料的方式进行随访,随访截止时间为2019年10月31日。记录纳入患者的生存状态、死亡时间等资料,所有纳入患者均有5年随访数据。本研究的主要终点是总生存期(overall survival,OS),定义为自HCC确诊之日至死亡或最后一次随访的时间间隔。
1.5 统计学分析
采用SPSS 22.0统计学软件进行数据分析。分类变量组间比较采用χ2检验,连续变量组间比较采用Mann-WhitneyU检验。采用受试者工作特征曲线(receiver operating characteristic,ROC)确定CAR的最佳临界值。采用Kaplan-Meier分析和log-rank检验计算累积生存率并绘制生存曲线。采用单因素分析探究影响HCC患者OS的危险因素,有统计学意义的风险因素(P<0.05)纳入Cox比例风险模型进行多因素分析,探究影响患者OS的独立危险因素,以P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料
在纳入的98例HCC患者中,男性75例(76.5%),女性23例(23.5%);中位年龄为62岁(36~78岁);患者接受TACE和RFA治疗的中位周期数分别为3(1~10)次、3(1~15)次;患者外周血中C反应蛋白和白蛋白的中位基线水平分别为0.31(0.02~22.16) mg/dL、4.5(3.2~5.2) g/dL。根据图1A所示,根据每位患者基线的C反应蛋白和白蛋白水平,计算对应的基线CAR值。并进一步利用ROC曲线确定CAR的最佳临界值,结果表明,CAR的最佳临界值为0.038(特异性:63.64%,灵敏度:72.41%,AUC:0.705,P=0.027),见图1B。根据此临界值,将患者分为2组:CAR高水平组(n=40)和CAR低水平组(n=58)。
2.2 CAR水平与肝癌患者临床病理特征的关系
临床病理特征相关性分析表明,基线CAR高水平与较大的肿瘤直径、较多的肿瘤数目、较差的Child-Pugh分级及肝硬化显著相关(均P<0.05),而与患者的性别、年龄、AFP水平及门静脉癌栓无显著相关性(均P>0.05,表1)。
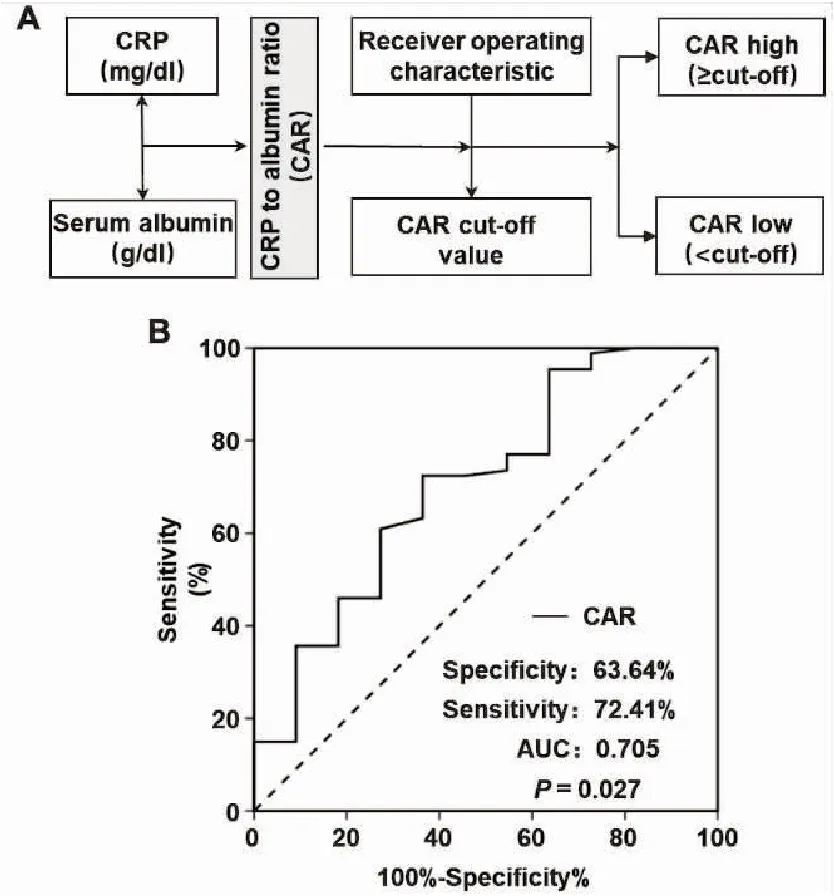
图1 CAR计算模式图及利用ROC曲线确定其最佳临界值
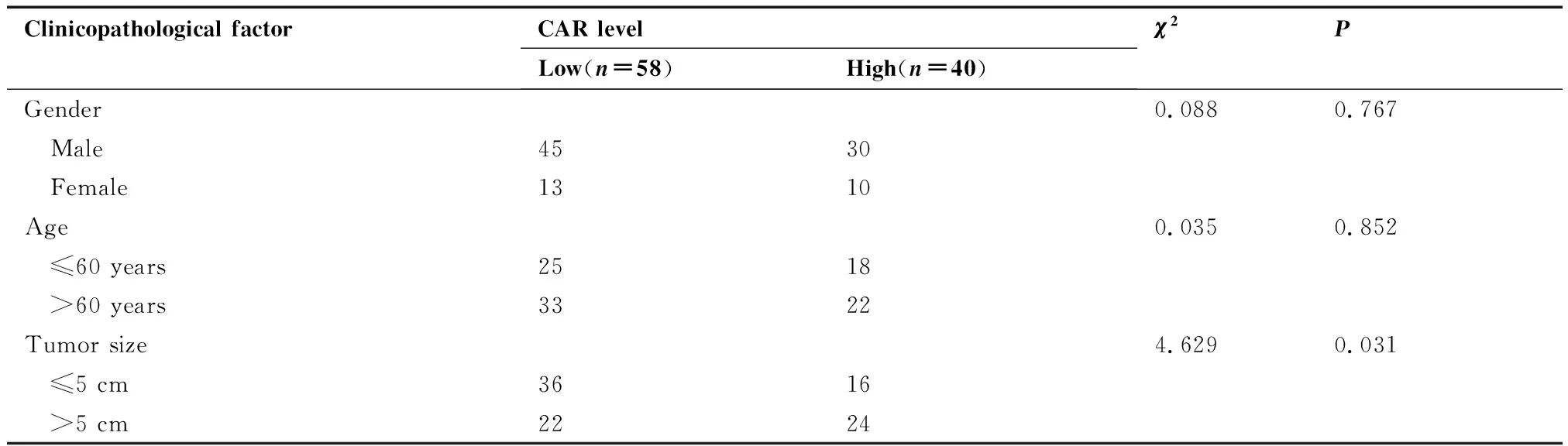
表1 肝细胞癌患者CAR水平与临床病理特征的关系/例
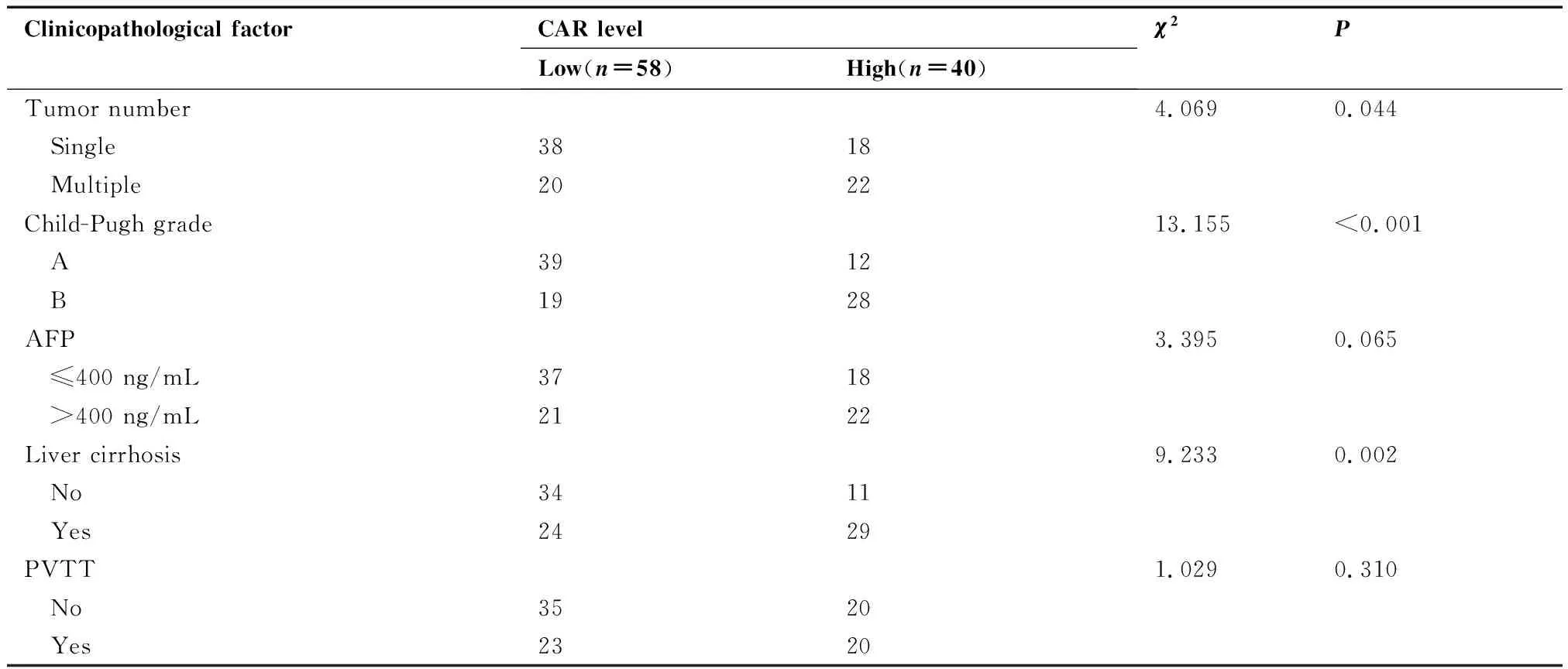
Clinicopathological factorCAR levelLow(n=58)High(n=40)χ2 PTumor number4.0690.044 Single3818 Multiple2022Child-Pugh grade13.155<0.001 A3912 B1928AFP3.3950.065 ≤400 ng/mL3718 >400 ng/mL2122Liver cirrhosis9.2330.002 No3411 Yes2429PVTT1.0290.310 No3520 Yes2320
2.3 CAR水平与肝癌患者OS的关系
在随访周期内,97例患者死亡,1例存活,死亡率为98.98%。Kaplan-Meier生存分析及Log-rank检验结果显示,与低基线CAR水平患者相比,高基线CAR水平患者的中位OS显著缩短(24个月vs13个月,P=0.002;图2)。进一步单因素回归分析结果提示,肿瘤直径、Child-Pugh分级、肝硬化、门静脉癌栓和CAR水平与患者的OS相关(均P<0.05);将单因素分析肿瘤有意义的因素纳入多因素Cox回归分析,结果证实,CAR水平(HR:2.411,95%CI:1.126~5.163,P=0.024),Child-Pugh分级(HR:1.186,95%CI:1.149~2.871,P=0.011),肝硬化(HR:1.465,95%CI:1.142~2.305,P=0.034)及门静脉癌栓(HR:3.073,95%CI:1.161~6.472,P=0.005)是影响接受TACE和RFA治疗HCC患者OS的独立因素(表2)。
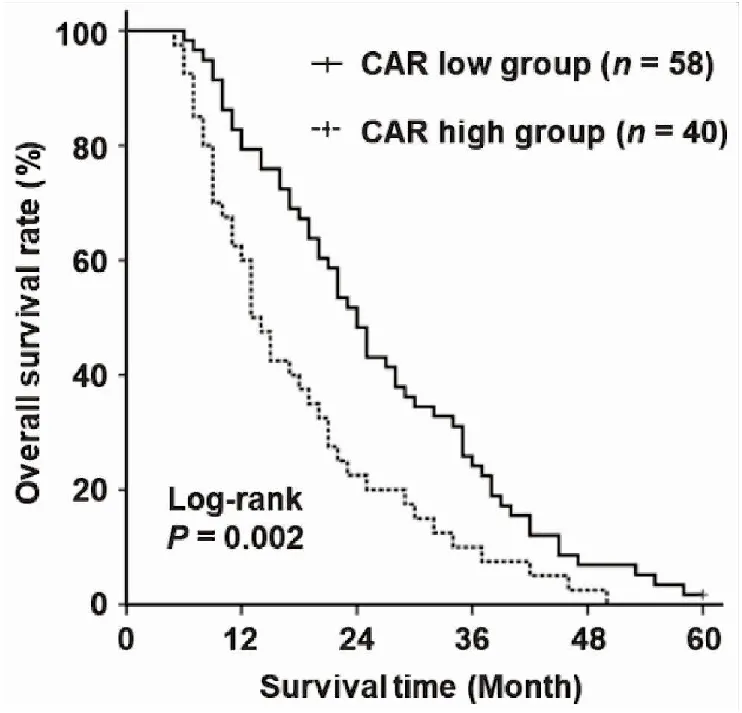
图2 基线CAR水平与肝细胞癌患者总生存期的关系
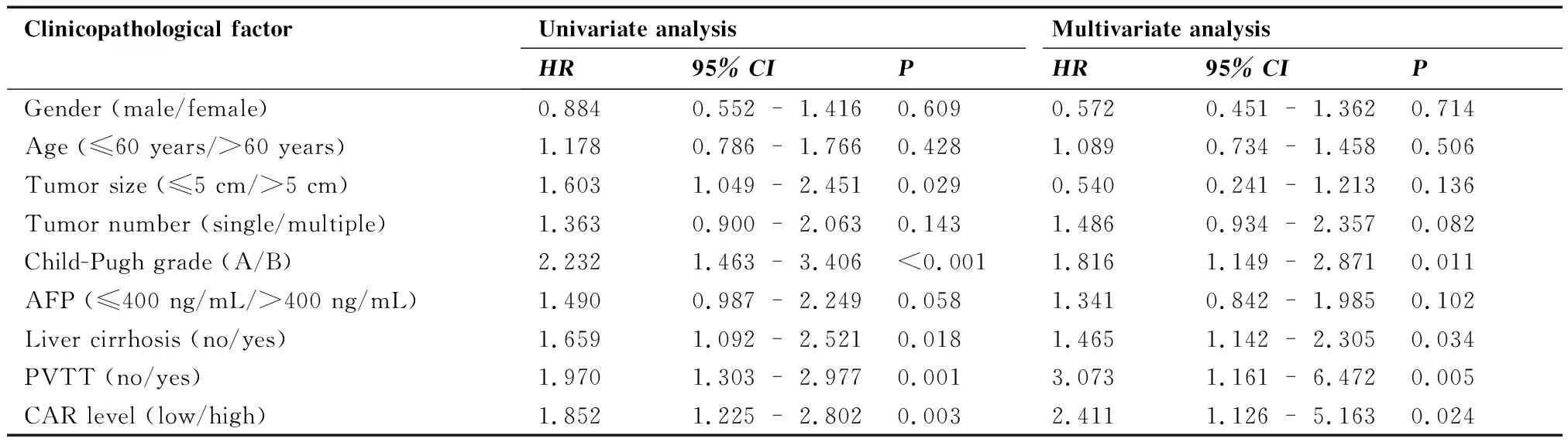
表2 影响肝细胞癌患者总生存期相关风险因素的单因素和多因素分析
3 讨 论
炎症是恶性肿瘤的标志之一,可诱导免疫细胞处于耗竭状态,从而为肿瘤细胞的免疫逃逸创造有利条件,导致肿瘤进展[7]。相关研究表明,慢性炎症可通过增加生长因子、促血管生成因子及细胞外基质调节因子的产生,促进恶性肿瘤生长和转移[10]。CAR作为一个炎症相关标志物,最早被用于脓毒症患者的预后[11]。近年来,随着研究者对慢性炎症在恶性肿瘤中重要作用的认识加深,CAR在恶性肿瘤中的生物标志物功能也逐渐被揭示。当前,CAR已被证实与多种恶性肿瘤的分期、恶性进展及预后密切相关,然而,其在HCC中的预后价值仍需探索。
在本研究中,我们首次评估了基线CAR水平在接受TACE联合RFA治疗的HCC患者中的预后价值。结果表明,较高的基线CAR水平与肿瘤直径、肿瘤数目、Child-Pugh分级及肝硬化等不良临床病理因素呈显著正相关;进一步的生存分析提示,CAR是影响接受TACE和RFA治疗HCC患者OS的独立因素,基线CAR水平较高患者的OS显著缩短。本研究结果与既往相关研究结果相符。Xu等[12]通过回顾性分析III期临床研究的数据发现,术前CAR水平是预测接受胃癌根治术患者早期复发和化疗获益的良好指标,由CAR和TNM分期组成的风险评估模型具有更好的预后预测能力和临床应用价值;Ishizuka等[13]研究表明,在接受手术治疗的结直肠癌患者中,基线CAR水平与患者的年龄、性别、肿瘤位置、大小、肿瘤类型、淋巴脉管浸润、CEA水平及TNM分期显著相关,单因素及多因素分析证实,CAR是影响患者OS的独立预后因素。而在接受手术治疗的早期HCC中,CAR的预后评估价值也得到了证实。Shimizu等[14]研究发现,在Child-Pugh A级接受肝切除的HCC患者中,术前CAR高水平与较差的无复发生存期和OS相关,且是影响患者OS的独立预后因素;类似地,另一项研究也提示术前CAR水平是接受根治性手术HCC患者无肿瘤生存的独立预后指标[15]。此外,Oh等[16]探究了术后CAR在HCC中的预后价值,结果表明,无论是接受腹腔镜或者开腹手术,术后CAR水平均是影响HCC患者术后复发率和死亡率的风险因素。结合既往研究及当前研究结果表明,无论是术前还是术后CAR水平,均是预测HCC患者预后的良好指标,且与患者接受的治疗方式无关。当然,上述推测仍需未来大规模、高质量的临床研究去加以证实。
目前,关于CAR促进HCC进展的机制尚不明确。C反应蛋白作为在IL-6刺激下由肝脏分泌的一种急性期蛋白,在临床上被视为一种重要的炎症指标。既往研究表明,IL-6可通过促进STAT3磷酸化来介导肿瘤相关巨噬细胞的M2型极化或直接抑制肿瘤细胞的凋亡和促进其增殖,进而促进肿瘤进展[17]。此外,研究者在乳腺癌模型中研究表明,C反应蛋白可通过与肿瘤细胞上的整合素α2亚基结合增强肿瘤细胞的侵袭能力,进而发挥直接的促肿瘤作用[18]。因此,目前的研究尚不能确定,C反应蛋白对肿瘤的促进作用是通过直接影响肿瘤细胞,还是为IL-6介导的肿瘤进展的下游作用。有趣的是,少数的临床前研究结果却发现,C反应蛋白可通过抑制肿瘤细胞的上皮—间质转化和肿瘤相关巨噬细胞的M2型极化,进而发挥抗肿瘤作用[19-20]。另一方面,血清白蛋白作为患者营养评估的一个指标,其水平降低提示营养不良,与肿瘤患者的免疫反应受损密切相关,为肿瘤细胞的转移提供了有利条件[21]。在未来,需要更多的研究去探索CAR影响肿瘤进展的潜在机制。
本研究存在以下不足:1)本研究为单中心回顾性研究,研究结论的证据级别不足;2)研究纳入样本量较少,从一定程度上降低了结论的说服力。关于CAR作为预后标志物的潜力,更需要未来大规模、前瞻性、多中心的临床研究去加以验证,以协助为不同患者制定个体化的治疗策略。尽管如此,本研究结果表明CAR作为一种简单、廉价的生物标志物,可用于预测接受TACE联合RFA治疗的HCC患者的预后。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
