MRTF-A的SUMO化对人脐静脉内皮细胞迁移能力的影响*
2022-01-12谷岩张蕊何菊刘辉
谷岩,张蕊,何菊,刘辉
(天津市第一中心医院 血管外科,天津 300192)
血管内皮细胞迁移是血管新生的重要环节,参与并影响受损血管修复、肿瘤生长和转移等多种重要生理、病理过程[1],研究影响血管生成的因素对一些疾病的诊断和治疗具有重要意义[2-4]。SUMO(small ubiquitin-related modifier)是一种小泛素相关修饰物,通过改变其靶蛋白的功能参与多种疾病生理、病理过程。SUMO 分子修饰蛋白种类的多样性使SUMO 在细胞内具有多种不同的生物学功能[5-7]。本研究通过对调控因子(MRTF-A)进行SUMO,探讨其对CCN1 即富半胱氨酸61(cysteine rich 61,Cyr61)表达的调控及对人脐静脉内皮细胞(HUVECs)迁移的影响。
1 材料与方法
1 1 实验材料
HUVECs 购自天津医科大学,DMEM-F12 混合培养基(含10%胎牛血清)(美国Gibco 公司),质粒MRTF-A、SUMO1 和PIAS1/ UBC9(英国Abcam公司),MRTF-A 抗体、SUMO1 抗体、CCN1 抗体(英国Abcam 公司),GAPDH 抗体(美国Santa Cruz公司),抗小鼠和抗兔免疫球蛋白G(美国LI-COR Biosciences 公司),蛋白-DNA 复合物(美国Sigma-Aldrich 公司),Trizol(美国Invitrogen 公司),SYBR Green Master Mix 试剂(美国Applied Biosystems 公司),StepOnePlus 实时荧光定量PCR 仪(美国Applied Biosystems 公司),Odessay 红外激光成像系统(美国LI-COR Biosciences 公司)。
1.2 实验方法
1.2.1 分组及质粒和细胞转染将实验分为两部分,每部分分为5 组。第一部分第1 组为空白对照组,第2 组为转染MRTF-A 组,第3 组为转染MRTF-A、SUMO1 组,第4 组为转染MRTF-A、UBC9 组,第5 组为转染MRTF-A、SUMO1、UBC9组。第二部分第1 组为空白对照组,第2 组为转染MRTF-A 组,第3 组 为转染MRTF-A、SUMO1 组,第4 组为转染MRTF-A、PIAS1 组,第5 组为转染MRTF-A、SUMO1、PIAS1 组。除空白对照组,其余组统称为实验组。用TurboFect 转染试剂转染表达质粒(MRTF-A、SUMO1 和/或PIAS1/ UBC9)。48 h 后进行检测。
1.2.2 染色质免疫共沉淀(co-IP)共转染表达质粒的MRTF-A、SUMO1、UBC9、PIAS1。转染48 h后收集裂解液。将MRTF-A 抗体(1∶1 000)加入磁珠,在整个细胞裂解液中沉淀MRTF-A。将得到的混合物洗涤后,经SDS-PAGE 处理,置于硝酸纤维素膜上,用特异性的SUMO1 抗体(1∶1 000)检测MRTF-A 与SUMO1 蛋白间的相互作用。
1.2.3 实时荧光定量聚合酶链反应(qRT-PCR)用Trizol 裂解收集的细胞,采用随机引物和M-MLV逆转录酶将提取的RNA 模板逆转录为cDNA。采用SYBR Green Master Mix、、StepOnePlus 实时荧光定量PCR 仪检测CCN1 mRNA 相对表达。反应条件:95℃变性30 s,56℃退火45 s,GAPDH 退火54℃,72℃延伸30 s,共30 个循环。CCN1 引物序列:正向5'-AGCAGCGTTTCCCTAC-3',反向5'-TGAGTCCCATCA CCCACA-3';GAPDH 引物序列:正向5'-TCAACGGCA GTCAG-3',反向5'-AGAAGGCGGAGATGA-3'。
1.2.4 Western blotting用SDS-PAGE 分离蛋白,然后分别用抗MRTF-A(1∶1 000),抗CCN1(1∶1 000)和抗GAPDH(1∶5 000)的抗体孵育膜,4℃孵育过夜。二抗为irdye -800 结合的抗小鼠和抗兔免疫球蛋白G(1∶2 000)。免疫反应性检测采用Odessay 红外激光成像系统。用Image J 软件对蛋白相对表达量进行分析。
1.2.5 染色体免疫沉淀(ChIP)HUVECs 转染MRTF-A、SUMO1、UBC9、PIAS1 48 h 后,室温下以1%的最终浓度,将这些蛋白与DNA 交联20 min。用MRTF-A 原抗体免疫沉淀蛋白-DNA 复合物(1∶2 000)。采 用PCR 法检 测CCN1/MRTF-A 和CCN1/MRTF-A/SUMO1/UBC9/PIAS1 启动子复合物的信号。用于CCN1 扩增的引物序列:正向5'-CAGGTTGCGT AGCCATCC-3',反向5'-TGGTAGCCACCTGCCTCT-3'。
1.2.6 划痕实验在6 孔板中用无菌牙签尖端在HUVECs 上划痕,观察0 h、48 h 损伤后的修复情况,并进行拍照。
1.2.7 Transwell 实验在HUVECs 转染SUMO1 和UBC9/PIAS1 后,用胰蛋白酶收集细胞。将细胞按1.0×104个/μl 密度接种到含1% DMEM-F12 培养基的Transwell 小室上层,下层加入600 μl 含有10%的DMEM-F12 的培养基。24 h 后用棉签吸净上室的细胞,将迁移至下室的细胞用4%多聚甲醛固定,并用DAPI 染色。分别在5 个视野(上、下、左、右、中)进行拍照计数。
1.3 统计学方法
数据分析采用SPSS 13.0 统计软件。计量资料以均数±标准差(±s>)表示,比较用方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 SUMO1对MRTF-A的体外修饰
Western blotting 检测结果证实转染MRTF-A、SUMO1、UBC9、PIAS1 后,HUVECs 相应过表达该基因(见图1)。过表达SUMO1 和UBC9/PIAS1 增强MRTF-A的SUMO化(见图2)。

图1 MRTF-A/SUMO1/UBC9/PIAS1在HUVECs中过表达
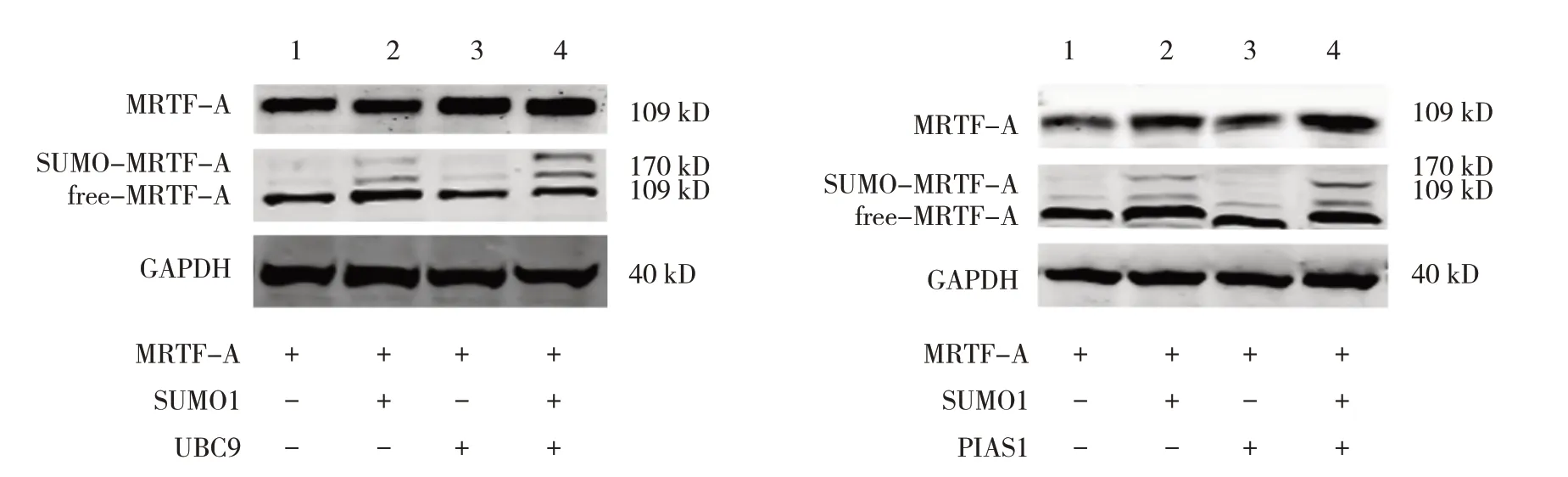
图2 过表达SUMO1和UBC9/PIAS1增强MRTF-A的SUMO化
2.2 MRTF-A的SUMO化调控CCN1的表达
HUVECs 分别转染MRTF-A、SUMO-1、UBC9、PIAS1 48 h 后,qRT-PCR 和Western blotting 检测CCN1 的表达。结果显示,过表达MRTF-A 可转录激活CCN1基因,MRTF-A 与SUMO1 和UBC9/PIAS1 共转染后,CCN1 表达降低(见图3、4)。ChIP 分析证实MRTF-A 的SUMO 化抑制CCN1 启动子上MRTF-A 的募集(见图5)。HUVECs 过表达SUMO1、UBC9、PIAS1 抑制MRTF-A 对CCN1 的转录激活。

图3 HUVECs转染MRTF-A、SUMO1、UBC9、PIAS1 48 h后的CCN1mRNA表达

图4 HUVECs中转染MRTF-A、SUMO1、UBC9、PIAS1 48 h后蛋白相对表达量

图5 MRTF-A的SUMO化抑制MRTF-A对CCN1的转录活性
2.3 SUMO1(△GG)丧失对MRTF-A的体外修饰功能
HUVECs 转染UBC9、PIAS1、SUMO1(△GG),Western blotting 分析发现,UBC9、PIAS1 与缺失特定位点的SUMO1(△GG)共转染后,MRTF-A 条带的迁移速度并没有减慢(见图6)。此外,qRTPCR 和Western blotting 结果表明,SUMO1(△GG)和UBC9、PIAS1 并不影响MRTF-A 对CCN1 的靶向调控(见图7、8)。ChIP 实验也证实上述结果(见图9)。该实验结果表明SUMO1在MRTF-A调控中存在特定功能域。
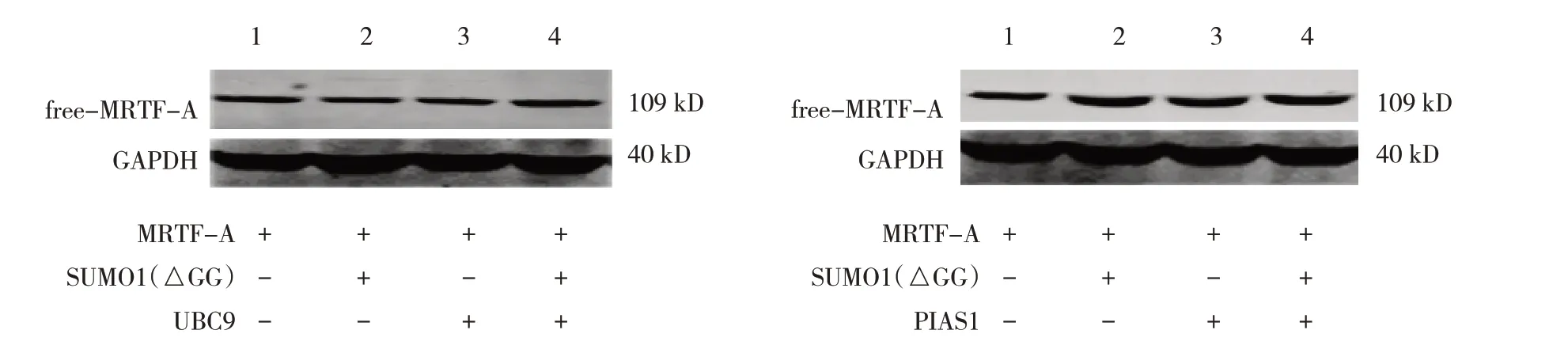
图6 HUVECs中转染MRTF-A、SUMO1(△GG)、UBC9、PIAS1 48 h后MRTF-A的SUMO化表达

图7 HUVECs转染MRTF-A、SUMO1(△GG)、UBC9、PIAS1 48 h后的CCN1mRNA表达

图8 HUVECs转染MRTF-A、SUMO1(△GG)、UBC9、PIAS1 48 h后CCN1蛋白相对表达量

图9 MRTF-A对CCN1的靶向调控
2.4 MRTF-A的SUMO化影响HUVECs的迁移
HUVECs 与MRTF-A、SUMO1 和UBC9、PIAS1共转染后,划痕和Transwell chamber 实验结果表明。在HUVEC 单层形成“划痕”后,从0 h 拍摄图像看,MRTF-A 的SUMO 化显著降低其迁移能力(见图10)。在Transwell 实验中,将转染MRTF-A、SUMO1 和UBC9、PIAS1 或单独转染MRTF-A 的HUVECs 接种到Transwell 的上室。培养48 h 后,通过共聚焦扫描显微镜固定、染色、拍照、计数已经越过单层并迁移到膜下层的细胞。在单独转染MRTF-A 的细胞中观察到细胞明显的迁移和侵袭,而MRTF-A SUMO 化的细胞中,跨Transwell 室膜的迁移细胞减少40%(见图11)。结果表明,MRTF-A的SUMO 化抑制HUVECs 的迁移。

图10 HUVECs转染MRTF-A、SUMO1、UBC9、PIAS1 48 h后划痕实验结果

图11 HUVECs转染MRTF-A、SUMO1、UBC9、PIAS1 48 h后HUVECs的迁移能力
3 讨论
血管内皮细胞是覆盖于血管内膜表层的单层扁平或多角形细胞,是构成血管内膜的基本元素,在血管内膜损伤的自我修复和血管新生过程中起决定作用。因此,探索和研究参与血管内皮细胞的调控分子,具有重要意义。
CCN1 是由CCN1基因编码的分泌蛋白,CCN1 是胚胎发育过程中血管生成所必需的蛋白[8],其在保持胚胎和胎盘的血管完整性方面发挥着重要的作用[9-10]。敲除CCN1 的小鼠在胚胎形成和胎儿发育过程中存在血管缺陷[11]。CCN1 还参与细胞的增殖、分化、凋亡和血管生成[12]。在不同的血管形成模型中,CCN1 可促进血管形成同时改善血流速度[13-14]。有证据表明,结缔组织生长因子(CTGF)和CCN1 通过细胞表面整合蛋白介导调控内皮细胞功能和血管生成,可以促进内皮细胞生长、迁移和黏附[11]。
MRTF-A 是血清反应因子(SRF)的转录共激活因子,与CArG box(CC[A/T]6GG)结合调节血管生成。有研究表明,MRTF-A/SRF 在血管发育、迁移和侵袭中有重要作用[15-17]。此外,VEGF/MRTFA/SRF 信号通路可调控内皮细胞的侵袭和迁移。FRANCO 等[18]报道,使用特异性小干扰RNA 敲除HUVECs 中MRTFA 的表达,可引起肌球蛋白调控轻肽9(MYL9)、非肌球蛋白重链9(MYH9)和肌球蛋白重链10(MYH10)mRNA 水平显著下调,进而抑制迁移。有报道显示,MRTF-A 通过靶向调控CCN1 参与调控间充质干细胞向内皮细胞分化[19]。MRTF-A 及其组蛋白乙酰化参与调控CCN1基因,敲除MRTF-A 可显著降低由于机械刺激引起的MRTF-A 缺失细胞中CCN1 的启动子活性。在HEK 293T 细胞体外重建系统中,MRTFA 的SUMO 化抑制其表达与活性[20]。本研究中,MRTF-A 通过SRF 与CCN1 启动子内的CArG box 结合,从而对CNN1 的表达起到调控作用。
SUMO 修饰蛋白种类的多样性使其在细胞内具有多种不同的生物学功能。SUMO 通过改变DNA 结合活性、亚细胞定位和蛋白质稳定性来调控转录活性。PIAS 家族蛋白的功能与泛素化E3 连接酶相似[21-22],E3 连接酶PIAS1 有助于SUMO 结合的效率和特异性[22-23]。UBC9 是一种重要的E2 结合酶,是泛素化蛋白共价修饰所必需的[24]。PIAS1 和UBC9均能增强特异性靶向蛋白的SUMO 化。本研究通过UBC9 和PIAS1 辅助MRTF-A 的SUMO 化,其对CCN1 表达的调控及HUVECs 的迁移有影响。
本研究中,HUVECs 在转染MRTF-A 后,相应过表达CCN1基因。UBC9、PIAS1 协同SUMO1 抑制MRTF-A 的转录活性,进而影响HUVECs 的迁移。实验结果证实过表达SUMO1 和PIAS1、UBC9 抑制MRTF-A 对CCN1 的转录激活。通过对不同位点的转染研究中,笔者发现SUMO1 在MRTF-A 调控中存在特定功能域。在单独转染MRTF-A 的细胞中观察到明显的迁移和侵袭,而在显示MRTF-A 的SUMO 化细胞中,跨Transwell 室膜的迁移细胞减少。研究结果表明,通过对MRTF-A 的SUMO 化抑制HUVECs 的迁移。
