前路或前后路联合手术治疗颈椎布鲁杆菌性脊柱炎的临床疗效观察*
2022-01-12张凯祥孟宪勇杨新明胡长波
张凯祥,孟宪勇,杨新明,胡长波
(河北北方学院附属第一医院1.创伤急救外科,2.骨外科,河北 张家口 075000)
布鲁杆菌病极易侵犯脊柱,临床上以腰椎或胸腰椎布鲁杆菌性脊柱炎较多见,而颈椎布鲁杆菌性脊柱炎(cervical brucellosis spondylitis,CBS)临床上少见[1-2],颈椎局部解剖结构特殊,更易形成脓肿、不稳及后凸成角畸形,发生瘫痪的危险更高。河北北方学院附属第一医院2007年8月—2017年8月对42 例符合手术适应证的CBS 行手术治疗,包括感染灶清除、缺损处植骨并有效内固定,比较手术后的临床疗效,为CBS 的手术治疗提供依据。
1 资料与方法
1.1 一般资料
确诊颈椎感染布鲁杆菌,在规范化药物治疗的基础上,对有下列症状之一的患者应采用手术治疗[3-7]:①有明显的椎旁脓肿或椎管内脓肿或炎症肉芽组织难以吸收;②伴有神经受损的症状和体征;③出现颈椎不稳并引起相应症状;④经非手术治疗无法缓解的严重颈背疼痛。
本研究共42 例患者。其中,男性28 例,女性14 例;年龄40~75 岁,平均53.5 岁。所有患者均有布鲁杆菌病感染的一般性症状。其中累及颈椎3 个相邻椎体7 例,2 个相邻椎体23 例,单椎体12 例,合并有颈椎管狭窄患者5 例,均存在不同程度的神经功能损害。详见表1。手术前日本骨科学会(JOA) 评分7~11 分,平均(8.6±1.6)分;颈部疼痛视觉模拟(VAS)评分7~10 分,平均(8.4±0.7)分;美国脊髓损伤协会(ASIA)分级:C级11 例,D 级31 例。

表1 42例CBS患者的椎体受累情况
1.2 实验室检查
本组患者均出现血沉(ESR)加快、C 反应蛋白(CRP)升高,ESR 为30~110 mm/h、CRP 为48~115 mg/L。12 例虎红平板凝集试验(tiger red plate agglutination test,RBPT) 阳 性(28.57%),37 例(88.09%)血清试管凝集试验(serum agglutination test,SAT)滴度>1∶160。
1.3 影像学表现
术前影像学检查包括颈椎X 射线片、CT 和MRI。X 射线片示椎体塌陷30 例(71.43%);生理曲度减小11 例(26.19%),反屈16 例(38.09%);椎间盘受累23 例(54.76%)。颈部CT 椎间盘示等密度影,椎体中心骨质受损,新生骨中形成新病灶,相邻椎体骨关节面骨质硬化。MRI 检查同样可见椎体受损,椎间盘有炎症改变,椎体前软组织异常信号及脓肿改变,脊髓受到炎症间盘、硬膜外脓肿及炎症肉芽组织的压迫。
1.4 手术前准备
术前按照“长期、足量、联合、多途径给药”方法标椎化抗布鲁杆菌病治疗[4,8]。患者口服强力霉素(0.1 g,2 次/d)、利福平(0.6 g,1 次/d)及磺胺甲基异恶唑(1.0 g,2 次/d),且强力霉素和磺胺甲基异恶唑口服时首剂加倍,56 d 为1 个疗程,间隔14 d,颈托固定,术前补液,改善贫血、低蛋白血症等,待患者贫血改善,营养状态好转,低热、盗汗等非特异性症状好转,血沉(ESR)呈下降趋势或持续处于某一数值时进行手术治疗[9]。
1.5 手术方法
所有患者均行气管插管全身麻醉,根据手术节段及病变情况决定手术入路,若受累椎体破坏较轻或感染病灶仅累及椎间盘时采用一期前路病灶清除内固定+植骨融合术(ACDF),若受累椎体破坏病灶较大、结构缺损较大时采用一期颈前路病椎次全切除+钛网植骨+内固定术(ACCF),合并颈椎管狭窄患者行前路手术联合后路单开门术。
1.6 术后处理
术后患者均行颈托固定保护,术后1~3 d 可下床行走。5~7 d 拆线,并复查X 射线片。常规佩戴颈托3 个月。术后继续规范化抗布鲁杆菌药物治疗至血凝集试验阴性后2 周。
1.7 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差(±s>)表示,比较用单因素方差分析;等级资料以等级表示,比较用秩和检验。P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况
所有获得随访的42 例患者,随访时间为10~25 个月,平均12.5 个月;术后复查椎间植骨都有良好的骨性融合,骨性融合时间为4~7 个月,平均5.5 个月。所有患者均能耐受手术,术前准备3~14 d,手术时间55~145 min,出血量45~95 ml,平均63.3 ml,术后1~3 d 拔出引流管,伤口均一期愈合。未出现血管损伤,食管气管瘘,神经、脊髓损伤,脑脊液漏等并发症,术后发热仅13 例,最高体温39.5℃,继续前述抗感染联合用药后体温恢复正常。术中所取病变组织,镜下可见大量炎症细胞及增殖性结节和肉芽肿形成,可见成片类上皮细胞组成的结节性病灶。见图1。

图1 布鲁杆菌性脊柱炎
2.2 观察指标情况
患者术后不同时间点的一般情况、实验室指标显示病情有明显好转,脊髓及神经功能受损明显改善。患者术前及术后不同时间点VAS 评分、JOA 评分的比较,经单因素方差分析,差异有统计学意义(P<0.05)。术后1 个月、3 个月、6 个月、12 个月不同时间点VAS 评分较术前降低(P<0.05);术后1 个月、3 个月、6 个月、12 个月不同时间点JOA 评分较术前升高(P<0.05)(见表2)。患者术前及术后不同时间点ASIA 分级例数比较,经秩和检验,差异有统计学意义(H=2.183,P=0.036);术后末次随访ASIA 分级中D 级7 例,E 级35 例,神经功能恢复较术前明显(P<0.05)(见表3)。至末次随访时,仅2 例有残留下肢感觉轻度减退后遗症。
表2 术前及术后不同时间点VAS、JOA评分比较(±s>)
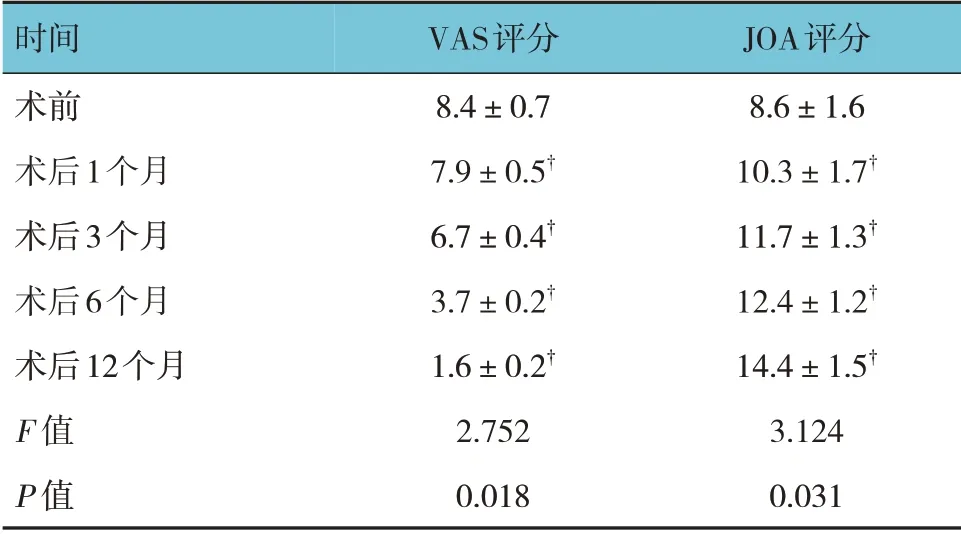
表2 术前及术后不同时间点VAS、JOA评分比较(±s>)
注:†与术前比较,P<0.05。
时间术前术后1个月术后3个月术后6个月术后12个月F 值P 值JOA评分8.6±1.6 10.3±1.7†11.7±1.3†12.4±1.2†14.4±1.5†3.124 0.031 VAS评分8.4±0.7 7.9±0.5†6.7±0.4†3.7±0.2†1.6±0.2†2.752 0.018

表3 术前和手术后不同时间点的神经功能分类 例
2.3 典型病例
典型病例1,54 岁,男性(见图2)。典型病例2,53 岁,女性(见图3)。

图2 C4~5布鲁杆菌性脊柱炎(典型病例1)

图3 C4~6布鲁杆菌性脊柱炎(典型病例2)
3 讨论
3.1 CBS的疾病特点
CBS 是布鲁杆菌侵及颈椎后引发的脊柱感染性病变,发病率较低,但易与脊柱结核、肿瘤等疾病混淆,并且治疗方案与脊柱结核、肿瘤的治疗存在差异,一旦出现误诊、误治会使病情迁延不愈甚至恶化,如何正确认识其疾病特征,进一步减少误诊、漏诊已经越来越引起临床医师重视[10-11]。CBS 与所有颈椎特异性感染及非特异性感染的脊椎炎表现存在相同点,包括不同类型、不同程度的发热、盗汗、乏力等全身中毒症状,局部感染造成颈椎不稳而引起的颈肩臂部疼痛、触压痛、活动受限的症状,椎管内脓肿、肉芽肿压迫脊髓神经根引起四肢麻木、感觉异常等神经损害症状,椎体破坏、椎间隙狭窄、椎旁脓肿的影像学特点。CBS 的特征性表现中影像学特点尤其重要[12-15]:CBS 椎体破坏一般较局限、椎间隙轻度狭窄、椎体无明显压缩征象、感染导致椎体边缘虫蚀样改变、周围骨质硬化增生、有“唇样”或“鸟嘴样”骨赘,病灶区骨破坏与新生修复骨同时存在,可见典型的“花边椎”,存在椎旁脓肿但无死骨及脓肿流注征象,破坏灶极少累及椎弓根。其次,临床表现方面:常伴有全身多处、游走性大关节及肌肉疼痛的典型征象,并经常伴有呼吸和生殖系统感染[16]。此外,多汗是该病的突出表现[17],男性患者可出现睾丸炎,有明显压痛[18]。本组42 例患者中,男性多于女性,36 例患者以长期低热、乏力、颈背部疼痛不适就诊,其中27 例有不同程度的脊髓神经根压迫症状,18 例以多汗并且伴有睾丸炎就诊。故临床中对于疑似患者应注意观察是否存在本病的特征性变化。
3.2 CBS的鉴别诊断
及时准确的诊断是CBS 治疗的基础,而目前CBS 的诊断尚无统一标准[19]。大量研究表明,CBS的诊断不能仅单一依靠临床表现或影像学资料,还应结合流行病学、实验室检查、病理学检查等进行综合诊断[4,20-21]。由于CBS 临床表现复杂多样,通过影像学、实验室及临床表现,布鲁杆菌性脊柱炎和脊柱肿瘤较易区分,而脊柱结核与布鲁杆菌性脊柱炎的鉴别始终是一个难题。脊柱结核发病缓慢,以盗汗、午后低热为主,无四肢大关节以及肌肉疼痛表现,多由肺结核、淋巴结核感染引起,结核菌素实验及结核抗体实验阳性,并且多数患者血沉增快,多数形成腰大肌或椎旁脓肿,并有典型的脓肿流注现象,脓肿灶内可见死骨形成,呈“满天星”样,MRI 可见椎体以溶骨性骨破坏为主,后期可见明显脊柱后凸畸形。本组患者均为回顾性分析,所有患者经术后病理学检查或细菌学检查,证实为布鲁杆菌感染。
3.3 CBS的治疗现状
作为特异性感染性疾病,CBS 与脊柱结核的治疗有相似之处,亦有不同之处。相似之处在于两者的非手术治疗均包括药物、制动、支持治疗,并且敏感有效的药物治疗是治疗的首要方法[4,22-23],均遵循“早期、联合、足量、规律、全程”的治疗原则[20,24]。但二者的疾病特征本质不同决定了治疗方面存在差异,结核杆菌对于脊柱结构破坏较大,多形成寒性脓肿及椎体椎间盘破坏,结构性后凸及不稳多见,神经损害以慢性压迫为主。布鲁杆菌性脊柱炎的细菌特点是以局灶性破坏同时伴有反应骨的增生修复为主,临床中形成大量脓肿造成压迫的比较少见,神经损害主要以炎性刺激及局部压迫同时存在,在符合手术指征的前提下,两种疾病所采取的手术方式无明显差异,手术目的均为清除感染病灶,解除病变组织对脊髓的压迫,恢复颈椎的高度和生理曲度,防止和矫正颈椎后凸畸形,重建颈椎的生物力学稳定性,以利于感染病灶的愈合[1,11,25]。治疗的不同之处关键点为根据药物敏感实验结果选取的抗生素种类不同,并且根据两种疾病的病情发展过程,用药疗程不同[4];查阅大量文献以及结合该院既往对CBS 患者治疗经验,可知以往CBS 的治疗主要参照颈椎结核的治疗而进行,临床上重点是如何更好地鉴别两者,使其早明确诊断,进行精准治疗,减少并发症的发生[4-5,16]。
尽管系统的规范化非手术治疗能够有效控制病情进展,但对部分患者也会出现病情迁延、感染恶化甚至致残。本研究表明CBS 患者的病情发展是多因素综合作用的结果,由于颈部活动度及承重相对较大,存在脊髓神经结构,CBS 的感染病灶容易产生严重病损,感染病灶的脓肿及炎性肉芽组织可损害脊髓及神经硬膜囊等重要神经组织,破坏椎间结构导致颈椎不稳,因此对出现上述严重并发症的患者必须行合理有效的手术治疗加以干预[26]。
CBS 患者的临床症状可以呈多样化及复杂化表现,从仅仅存在程度不同的颈肩痛,到脊髓及神经根损伤甚至出现瘫痪,随病情发展可以出现急剧恶化,本研究42 例患者中23 例在术前出现了神经功能的快速变化,表现为包括下肢沉重无力、二便异常、上肢麻木、无力及笨拙等脊髓损害症状,其中5 例出现进行性加重的上肢及肩背部放射痛。经手术治疗后症状缓解,神经功能逐渐恢复,因此对存在神经损伤的患者应积极予以手术治疗。
3.4 手术治疗以及手术时机的选择
杨新明等[27]认为对于单纯椎体炎及椎间盘炎患者经2 个疗程(56 d 为1 疗程)药物治疗无效而病情进展者应手术治疗,这与本文观点一致。同时也应注意到部分患者经过2 个疗程以上治疗,如椎体或椎间盘炎仍持续存在,而无神经损伤、失稳、剧烈疼痛等症状时应考虑是否存在诸如贫血、血糖控制不良、营养不良等免疫抑制状态,同时延长药物治疗时间或更换药物治疗方案,而非选择立即手术。大量研究表明[28-30],术前正规药物治疗2 个疗程,当患者的一般情况好转,ESR 下降,全身中毒症状明显减轻时为手术时机,但是若合并脊髓损伤和咽后部脓肿致吞咽、呼吸困难时,或出现呼吸衰竭危及生命时,应急诊处理。
布鲁杆菌对脊椎的侵袭大多集中于前柱及中柱结构[3,31],一方面与椎体为终末动脉菌栓容易定植有关,另一方面也与前柱活动度大并且负担大部分轴向载荷而易引起损伤有关,因此对于绝大多数CBS 患者前路手术能够满足手术要求[32]。
3.5 CBS手术注意事项及稳定性重建
为了使CBS 手术治疗取得良好效果,从围手术期开始,应严格按照标准抗布鲁杆菌病治疗方案,规范、系统、科学地进行化疗。常用的一线药为强力霉素、利福平、磺胺甲基异恶唑[4]。术前应用此方案至患者全身中毒症状明显减轻,而局部症状无缓解时方可进行手术治疗,有效药物干预能够提高治愈率、降低复发率[33]。同时术前应注意改善患者贫血和低蛋白血症等,待患者贫血改善,营养状态好转,ESR 呈下降趋势或持续处于某一数值时,表明患者抵抗力已提高、炎症急性期得到控制,此时手术治疗可提高治愈率。CBS 手术的治疗目的除了恢复脊柱稳定性外,还包括合理清除病灶,彻底地解除脊髓神经根的压迫和炎症刺激。术中应合理清除脓肿、炎症肉芽组织、坏死间盘、死骨,为彻底减压切除部分活性骨,合理适当地清除病灶可以有效地改善局部血供,使抗布鲁杆菌病药物更好地渗透到病灶区域,从而更有利于发挥药物作用。同时尽量保留“亚健康骨”,以增加颈椎稳定性。
吕永威等[34]、费正奇等[35]认为布鲁杆菌性脊柱炎术后复发与脊柱稳定性破坏有关,在病灶清除后应采取有效内固定以获得脊柱的即刻稳定,同时术后根据病情可适当延长外固定时间。本研究有5 例患者同时存在颈椎管狭窄,预期单纯病灶清除不能解除脊髓压迫,因此选择前路病灶清除+后路单开门椎管扩大成型术。而对伴有脓肿尤其是存在椎管内脓肿者,病灶清除应尽量彻底,本研究共4 例椎管内脓肿,其中2 例术前拟定手术方案为单纯间盘刮除,但术中为彻底清创而改为椎体次全切除。对于一般的椎体炎及椎间盘炎,病灶清除及内固定就可以满足治疗需要,但对于椎体破坏严重,内部存在脓腔者,椎体次全切除也是比较好的选择。手术应体现出个体化及针对性,应根据患者的具体病情制订综合治疗方案。
本研究患者术后末次随访的VAS 评分、JOA 评分及ASIA 分级均显示病情均较术前明显好转,综上可见,在合理的病灶清除基础上恢复颈椎稳定性可有效改变术前感染病灶造成的脊髓神经压迫、颈椎不稳导致的神经功能损伤及颈部剧烈疼痛等症状,对治疗该病导致的神经功能损伤可行且有较好的临床效果,同时对脊柱脊髓功能康复有重要意义。
