吡咯-2-甲胺类化合物的简便合成
2022-01-12宋治耘黄海洪张东峰
宋治耘, 闫 红, 黄海洪, 张东峰*
(1. 北京工业大学,北京 100124; 2. 中国医学科学院药物研究所,北京 100050)
吡咯结构在药物研究中应用广泛,很多药物或活性物质均具有吡咯结构骨架或片段[1-4]。在吡咯类化合物中,吡咯-2-甲胺类化合物由于其独特的性质,其衍生物具有多种生物活性,如抗肿瘤[5]、抗感染[6-7]、抑制单胺氧化酶活性[8-9]等。
合成胺类化合物的方法较多,其中以醛或酮为原料经还原胺化反应制备胺类化合物是一种非常重要的途径,还原胺化常用的方法有催化氢化和氢化物还原。催化氢化一般在铂、钯或镍等金属催化下进行,对于大量制备是一种经济高效的方法,然而该方法也有不足,例如:不适用于含有不饱和碳碳双键、硝基、卤素和氰基等敏感基团的底物,催化剂活性易被含硫底物抑制等。使用氢化物进行还原胺化常用的还原剂有NaBH4、 KBH4、氰基硼氢化钠、三乙酰氧基硼氢化钠、硼烷等,并且根据不同的底物,可以添加相应的催化剂促进反应,例如Ti(OiPr)4/NaBH3CN[10]、 NaBH4/Mg(ClO4)2[11]、 Zn(BH4)2/ZnCl2[12]等。氢化物进行还原胺化具有反应条件温和、底物耐受范围广和收率高等优点。
本课题组在构建含有吡咯-2-甲胺结构骨架的化合物库进行生物活性研究的过程中发现,虽然以2-醛基吡咯衍生物与胺基化合物为原料采
本文以廉价易得的2-醛基吡咯和脂肪胺为起始原料,通过条件筛选,得到了最优的还原胺化反应条件,随后以最优条件合成多种吡咯-2-甲胺类化合物(3a~3g, Scheme 1),收率89%~98%,所有化合物结构均经1H NMR,13C NMR和HR-MS(ESI)表征。

Scheme 1
1 实验部分
1.1 仪器与试剂
Yanaco MP-J3型熔点仪(温度未经校正);Bruker 400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Thermo Exactive Orbitrap plus型质谱仪。
所用试剂均为化学纯。
1.2 合成
向反应瓶中加入2-醛基吡咯190 mg(2 mmol),胺2 mmol和甲醇10 mL,于65 ℃反应1 h。冷却至室温,冰浴下加入NaBH415 mg(0.4 mmol)反应0.5 h后,室温下继续反应3 h,再加入NaBH438 mg(1 mmol),反应0.5 h后,加入饱和碳酸氢钠溶液20 mL终止反应。乙酸乙酯(3×20 mL)萃取,合并有机相,依次用饱和NaCl溶液洗涤,无水硫酸钠干燥,过滤,滤液浓缩得产物3a~3e和3g,或经硅胶柱层析纯化(洗脱剂:二氯甲烷/甲醇=90/10,V/V)得产物3f。
N-((1H-吡咯-2-基)甲基)环己胺(3a)[13]: 淡黄色油状液体338 mg,收率95%;1H NMR(400 MHz, CDCl3)δ: 9.52(brs, 1H), 6.71(s, 1H), 6.10(d,J=1.2 Hz, 1H), 6.03(s, 1H), 3.85(s, 2H), 3.43(brs, 1H), 2.55~2.48(m, 1H), 1.94~1.91(m, 2H), 1.75~1.70(m, 2H), 1.63~1.60(m, 1H), 1.29~1.08(m, 5H);13C NMR(100 MHz, CDCl3)δ: 129.32, 117.72, 107.89, 106.74, 56.23, 43.31, 32.86, 25.95, 24.97; HR-MS(ESI)m/z: Calcd for C11H19N2{[M+H]+}179.1543, found 179.1539。
N-((1H-吡咯-2-基)甲基)环丁胺(3b)[5]: 淡黄色固体279 mg,收率93%;m.p.40~41 ℃;1H NMR(400 MHz, CDCl3)δ: 9.60(s, 1H), 6.66(d,J=1.6 Hz, 1H), 6.09(dd,J=5.6 Hz, 2.8 Hz, 1H), 6.01(s, 1H), 3.69(s, 2H), 3.29~3.24(m, 1H), 2.26~2.20(m, 2H), 1.72~1.59(m, 4H), 1.53(brs, 1H);13C NMR(101 MHz, CDCl3)δ: 130.27, 117.51, 107.72, 106.40, 53.38, 43.58, 31.03, 14.79; HR-MS(ESI)m/z: Calcd for C9H15N2{[M+H]+}151.1230, found 151.1224。
N-((1H-吡咯-2-基)甲基)环戊胺(3c): 淡黄色固体315 mg,收率96%; m.p.48~49 ℃;1H NMR(400 MHz, CDCl3)δ: 9.61(brs, 1H), 6.68(s, 1H), 6.10(s, 1H), 6.03(s, 1H), 3.78(s, 2H), 3.11(p,J=7.2 Hz, 1H), 2.73(brs, 1H), 1.91~1.83(m, 2H), 1.70~1.62(m, 2H), 1.57~1.50(m, 2H), 1.39~1.30(m, 2H);13C NMR(101 MHz, CDCl3)δ: 129.81, 117.63, 107.83, 106.61, 59.29, 45.22, 32.75, 24.04; HR-MS(ESI)m/z: Calcd for C10H17N2{[M+H]+}165.1386, found 165.1380。
N-((1H-吡咯-2-基)甲基)环庚胺(3d): 淡黄色油状液体357 mg,收率93%;1H NMR(400 MHz, CDCl3)δ: 9.62(brs, 1H), 6.69(s, 1H),6.10(s, 1H), 6.03(s, 1H), 3.81(s, 2H), 3.19(brs, 1H), 2.73~2.67(m, 1H), 1.90~1.85(m, 2H), 1.66~1.38(m, 10H);13C NMR(101 MHz, CDCl3)δ: 129.49, 117.67, 107.85, 106.67, 58.50, 43.96, 34.28, 28.25, 24.35; HR-MS(ESI)m/z: Calcd for C12H21N2{[M+H]+}193.1699, found 193.1695。
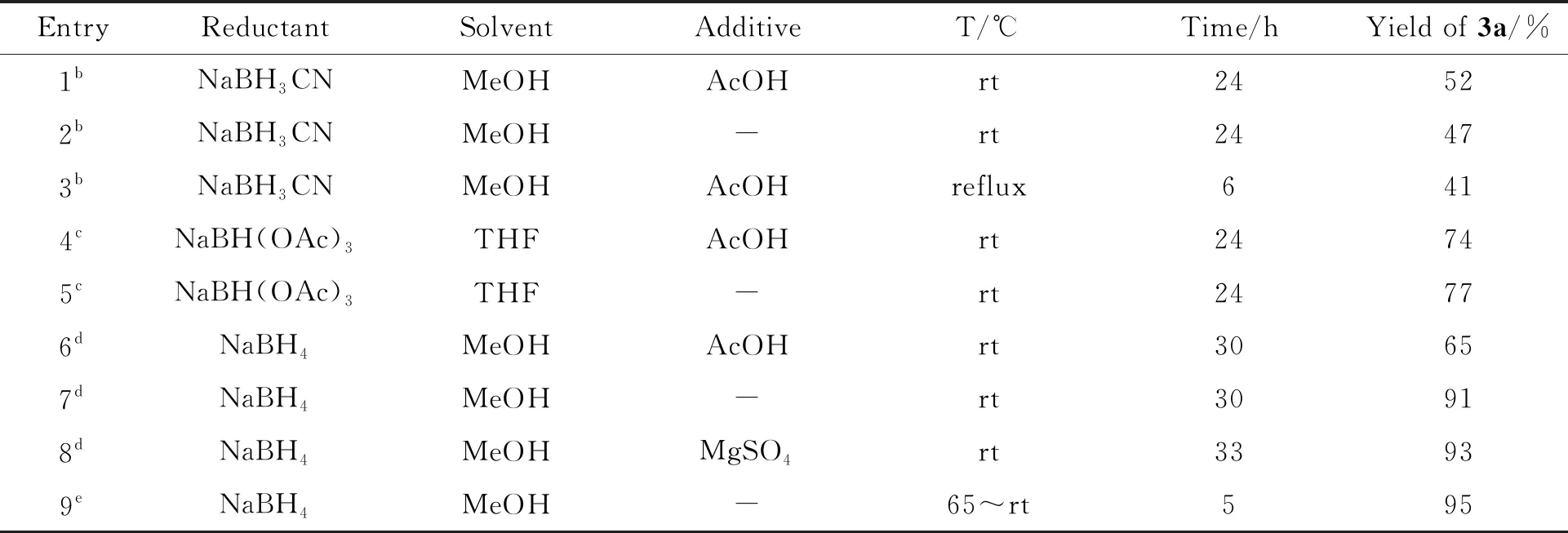
表1反应条件优化a
N-((1H-吡咯-2-基)甲基)环辛胺(3e): 淡黄色油状液体392 mg,收率95%;1H NMR(400 MHz, CDCl3)δ: 9.54(brs, 1H), 6.68(s, 1H), 6.10(s, 1H), 6.02(s, 1H), 3.78(s, 2H), 2.76~2.71(m, 1H), 2.55(brs, 1H), 1.78~1.42(m, 14H);13C NMR(101 MHz, CDCl3)δ: 129.94, 117.51, 107.81, 106.43, 57.43, 44.04, 32.20, 27.20, 25.78, 24.10; HR-MS(ESI)m/z: Calcd for C13H23N2{[M+H]+}207.1856, found 207.1852。
N-((1H-吡咯-2-基)甲基)异丙胺(3f)[14]: 淡黄色油状液体246 mg,收率89%;1H NMR(400 MHz, CDCl3)δ: 9.93(brs, 1H), 6.65(s, 1H), 6.08(t,J=2.8 Hz, 1H), 6.03(s, 1H), 3.78(s, 2H), 2.87(hept,J=6.4 Hz, 1H), 2.71(brs, 1H), 1.09(d,J=6.4 Hz, 6H);13C NMR(101 MHz, CDCl3)δ: 129.67, 117.78, 107.81, 106.76, 48.63, 44.14, 22.53; HR-MS(ESI)m/z: Calcd for C8H15N2{[M+H]+}139.1230, found 139.1225。
N-((1H-吡咯-2-基)甲基)正丁胺(3g)[16]: 淡黄色油状液体298 mg,收率98%;1H NMR(400 MHz, CDCl3)δ: 10.04(brs, 1H), 6.78(s, 1H), 6.21(t,J=2.8 Hz, 1H), 6.15(s, 1H), 3.88(s, 2H), 2.75(t,J=7.2 Hz, 2H), 2.27(brs, 1H), 1.64(p,J=7.2 Hz, 2H), 1.45(s,J=7.2 Hz, 2H), 1.02(t,J=7.2 Hz, 3H);13C NMR(101 MHz, CDCl3)δ: 130.08, 117.76, 107.77, 106.73, 49.19, 46.67, 31.91, 20.58, 14.10; HR-MS(ESI)m/z: Calcd for C9H17N2{[M+H]+}153.1386, found 153.1377。
2 结果与讨论
2.1 反应条件优化
以2-醛基吡咯和环己胺(2a)作为反应底物对还原胺化的条件进行了考察(表1)。首先,考察了氰基硼氢化钠作为还原剂[17](entries 1~3),以甲醇为溶剂,向反应体系中加入乙酸和不加乙酸,室温下反应,产物收率基本相当,约50%;当提高反应温度在回流状态下进行时,虽然可以缩短反应时间,但收率略下降(entry 3)。当采用三乙酰氧基硼氢化钠替代氰基硼氢化钠作为还原剂时[18](entries 4~5),以四氢呋喃为溶剂,向反应体系中加入乙酸和不加乙酸,产物收率均有所提高且相当,约75%。继续考察更价廉易得的硼氢化钠作为还原剂[19-20]时对于该反应的影响。以甲醇为溶剂,室温下,当向反应体系中添加乙酸时,反应收率为65%(entry 6),不添加乙酸时,反应收率可达91%(entry 7),但是两种条件下的反应时间均较长,达30 h。考虑到还原胺化反应第一步有水生成,因此,在不添加乙酸的条件下仅向反应体系中加入无水硫酸镁作除水剂考察对反应的影响,结果显示收率为93%,反应时间仍然长达30 h,表明除水剂对反应进程无促进作用(entry 8)。最后考察了反应温度对反应的影响,当反应体系中不加入任何添加剂时,仅升高反应温度,反应在5小时即可完成,且收率可达95%(entry 9)。经过优化,确定了制备吡咯-2-甲胺类化合物的最优反应条件,即以甲醇为反应溶剂,反应底物和还原试剂的比例为2-醛基吡咯/胺/硼氢化钠=1/1/0.7,采用先加热生成亚胺,再分批加入硼氢化钠的方式,可以大于90%的高收率得到产物。
2.2 底物拓展
在最优反应条件下,对反应的底物进行了拓展(表2)。反应结果显示,无论是小体积环状胺(entries 1~2),还是大体积的环状胺(entries 3~4),均可以大于90%的收率得到产物。当胺类化合物2为支链或直链的脂肪胺时(entries 5~6),反应也可以近90%的高收率获得产物。研究结果表明,优化后的反应条件适用性较好。
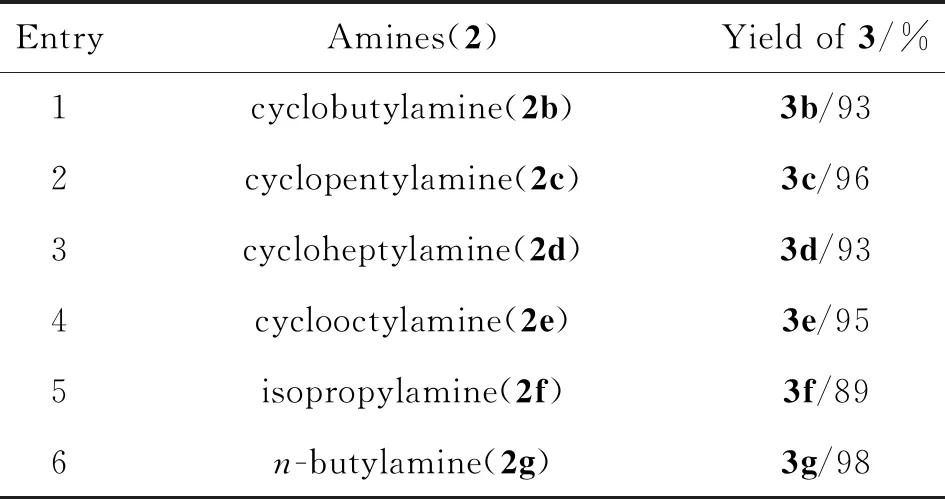
表2 底物拓展
以2-醛基吡咯和各种环状或链状的脂肪胺为原料,采用还原胺化反应得到了吡咯-2-甲胺类化合物。经还原剂筛选和反应条件优化,最终以廉价易得的硼氢化钠为还原剂,可以高收率(89%~98%)获得目标化合物。该合成方法具有底物适用性较广、反应时间短、条件温和及操作简便的优势。
