缩氨基硫脲衍生物的合成及抗菌活性研究
2022-01-12刘海彬
刘海彬, 吕 萍
(辽宁科技学院 生物医药与化学工程学院,辽宁 本溪 117004)
缩氨基硫脲及其衍生物由于具有广泛的生物活性如抗病毒、抗菌、抗肿瘤、抗结核、抗疟等而备受人们的重视[1-5]。在缩氨基硫脲化合物中,-N1NHC(S)N4-结构是缩氨基硫脲化合物具有生物活性的基本活性单元,N(1)上醛酮的不同结构及N(4)上不同结构的活性基团,对其抗菌、抗肿瘤等多种生物活性的强弱将产生极大影响[6-10]。水杨醛及其衍生物是有机合成和精细化工重要的中间体,广泛用于农药、医药、香料、螯合剂、染料中间体等领域[11-12]。
因此,本文根据生物活性拼合原理,把水杨醛结构引入到缩氨基硫脲化合物中,以期得到具有更强抗菌活性的化合物,合成了一系列含有水杨醛结构的缩氨基硫脲(Scheme 1),并且对它们进行了抗菌活性研究。

Scheme 1
1 实验部分
1.1 仪器与试剂
WRS-1B型数字熔点仪(温度计未校正);Bruker avance 500 Hz型核磁共振仪(TMS为内标);Thermo LCQ Fleet HPLC-MS型质谱仪;WQF-510型红外光谱仪;ZF-I型三用紫外分析仪。
所用试剂均为分析纯。
1.2 合成
(1) 乙酸钠(1)的合成
在室温下,将氯乙酸28.4 g(0.3 mol)溶于尽量少的乙醇中并置于冰水浴中冷却,不断搅拌下将冷却至5 ℃左右的0.3 mol氢氧化钠饱和水溶液逐滴加到上述氯乙酸的乙醇溶液中,使反应液温度不超过10 ℃,滴加完毕后,放置5 min,抽滤,无水乙醇洗涤,真空干燥,得氯乙酸钠白色结晶134.64 g,产率90%。
(2)N(4)取代氨基硫脲(2)的合成
N(4)邻甲苯基氨基硫脲的合成:参照文献[13]方法,向邻甲苯胺10.7 g(0.1 mol)和乙醇(95%)30 mL中加入20 mL浓氨水,不断搅拌下15 min内缓慢滴加CS28.0 mL,并控制温度在30 ℃以下。反应液澄清后,室温静置1 h,加入氯乙酸钠11.6 g(0.1 mol),室温下搅拌至反应液再次澄清,后加入水合肼(80%)12 mL反应1 h。将反应液浓缩至原体积的1/2,析晶,抽滤,粗产品在乙醇和少量水中重结晶,得到N(4)-邻甲苯基氨基硫脲11.7 g,产率70.4%, m.p.147.6~149.1 ℃(147~148 ℃[13]);1H NMR(CDCl3, 500 MHz)δ: 9.40(s, 1H, NH), 9.09(s, 1H, NH), 7.54(d,J=5.9 Hz, 1H, ArH), 7.21(d,J=7.4 Hz, 1H, ArH), 7.15(t,J=7.3 Hz, ArH), 7.12(t,J=7.2 Hz, 1H, ArH), 4.45(s, 2H, NH2), 2.21(s, 3H, CH3)。
N(4)苯基氨基硫脲的合成:合成方法同N(4)邻甲苯基氨基硫脲,m.p.135.7~137.9 ℃(140~141 ℃[13]);1H NMR(CDCl3, 500 MHz)δ: 9.69(s, 1H, NH), 9.13(s, 1H, NH), 7.39(d,J=5.4 Hz, 2H, ArH), 7.08(d,J=6.9 Hz, 2H, ArH), 6.61(t,J=7.1 Hz, 1H, ArH), 4.79(s, 2H, NH2)。
N(4)羟乙基氨基硫脲的合成:合成方法同N(4)邻甲苯基氨基硫脲,m.p.114.8~116.6 ℃;1H NMR(CDCl3, 500 MHz)δ: 9.40(s, 1H, NH), 9.08(s, 1H, NH), 4.43(s, 2H, NH2), 3.83(t,J=5.5 Hz, 2H, CH2), 3.77(t,J=3.5 Hz, 2H, CH2)。
(3) 化合物3的合成通法
向带有冷凝装置的100 mL烧瓶中加入溶有0.01 mol取代水杨醛的15 mL无水乙醇溶液和溶有0.01 molN(4)-取代氨基硫脲的无水乙醇(15 mL)溶液,并加入两滴浓硫酸,回流反应4 h。冷却至室温,抽滤,乙醇中重结晶得产物。
水杨醛N(4)邻甲苯基缩氨基硫脲(3a): 白色晶体,产率68.2%, m.p.172.8~173.4 ℃;1H NMR(CDCl3, 500 MHz)δ: 10.33(bs, 1H), 9.45(bs, 1H), 8.18(s, 1H), 8.14(s, 1H), 7.61(d,J=7.5 Hz, 1H), 7.35(t,J=8.5 Hz, 1H), 7.31~7.28(m, 4H), 6.99(d,J=8.5 Hz, 1H), 6.95(t,J=8.5 Hz, 1H), 2.35(s, 3H, CH3); ESI-MSm/z: 286.10{[M+H]+}。
3,5-二叔丁基水杨醛N(4)邻甲苯基缩氨基硫脲(3b): 白色晶体,产率43.1%, m.p.190.4~190.6 ℃;1H NMR(CDCl3, 500 MHz)δ: 10.49(bs, 1H), 9.96(bs, 1H), 8.18(d,J=12.0 Hz, 2H), 7.64(d,J=7.0 Hz, 1H), 7.41(s, 1H), 7.31~7.27(m, 3H), 7.06(d,J=2.0 Hz, 1H), 2.37(s, 3H, CH3), 1.43(s, 9H, C(CH3)3), 1.31(s, 9H, C(CH3)3); ESI-MSm/z: 398.12{[M+H]+}。
3,5-二溴水杨醛N(4)-邻甲苯基缩氨基硫脲(3c): 淡黄色晶体,产率82%, m.p.208.5~208.9 ℃;1H NMR(CDCl3, 500 MHz)δ: 9.33(bs, 1H), 9.29(s, 1H), 8.89(s, 1H), 8.57~8.55(m, 2H), 7.73~7.69(m, 2H), 7.44~7.40(m, 2H), 7.28(d,J=8.5 Hz, 1H), 2.46(s, 3H, CH3); ESI-MSm/z: 443.52{[M+H]+}。
3,5-二溴水杨醛N(4)-羟乙基缩氨基硫脲(3d): 白色固体,产率89.3%, m.p.211.8~212.8 ℃;1H NMR(500 MHz)δ: 10.63(bs, 1H), 8.37(s, 1H), 8.20(s, 1H), 7.72(s, 2H), 3.83(t,J=5.5 Hz, 2H), 3.79~3.77(m, t,J=5.0 Hz, 2H); ESI-MSm/z: 396.12{[M+H]+}。
2-乙酰基吡啶N(4)邻甲苯基缩氨基硫脲(3e): 淡黄色固体,产率67.2%, m.p.168.7~170.2 ℃(164~166 ℃[14]);1H NMR(CDCl3, 500 MHz)δ: 9.16(s, 1H), 8.88(s, 1H), 8.63(d,J=4 Hz, 1H), 7.99(d,J=8.0 Hz, 1H), 7.75(d,J=4.0 Hz, 1H), 7.72(t,J=7.5 Hz, 1H), 7.32~7.22(m, 4H), 2.49(s, 3H), 2.37(s, 3H)。
2-乙酰基吡啶N(4)苯基缩氨基硫脲(3f):淡黄色针状固体,产率59.5%, m.p.183.1~184.7 ℃(182~183 ℃[14]);1H NMR(CDCl3, 500MHz)δ: 9.37(s, 1H), 8.83(s, 1H), 8.64(d,J=4.5 Hz, 1H), 8.01(d,J=8.0 Hz, 1H), 7.76~7.69(m, 5H), 7.32(t,J=6.5 Hz, 1H), 7.26(t,J=7.0 Hz, 1H), 2.48(s, 3H)。
1.3 抑菌活性测试
抑菌活性试验采用滤纸片法。以金黄色葡萄球菌(S.Aureus,革兰氏阳性菌)、枯草芽孢杆菌(B.subtilis,革兰氏阳性菌)和大肠杆菌(E.Coli,革兰氏阴性菌)为试验菌株。用无菌操作分别将细菌(金黄色葡萄球菌、枯草杆菌和大肠杆菌)活化。取活化好的细菌接入9 mL无菌生理盐水中,充分分散菌体。采用10倍系列稀释法,制备10倍系列稀释菌悬液。各梯度菌悬液进行涂布记数,每次用移液管吸取0.2 mL该梯度菌悬液于倒好平板的牛肉膏培养皿中,采用画半圆法使菌液分布均匀,涂布完成后正置15 min,将平板翻转,37 ℃下培养24 h,选取细菌浓度范围在108CFU/mL的试管做菌悬液。用无菌的移液管吸取1.0 mL菌悬液置于无菌的平板中央,加入约15~20 mL无菌的琼脂培养基(牛肉膏、蛋白胨、氯化钠和琼脂,约50~60 ℃),轻轻摇匀。以DMSO为溶剂,将化合物分别配成0.1 mg/mL、 0.5 mg/mL和1.0 mg/mL的溶液,分别称取适量的待测药品于20 mL烧杯中。将足够数量的滤纸片(直径为6mm)浸泡于溶液中,充分浸泡2 h备用(同时做DMSO溶液空白对照)。待培养基冷却凝固后,将无菌滤纸片(直径6 mm)浸于待测试样分别置于含菌的平板培。待活化完毕后,取出培养基,观察抑菌结果,量取抑菌圈直径,记录平均值。
2 结果与讨论
2.1 N(4)取代氨基硫脲(2)的合成
脂肪胺或芳香胺与二硫化碳反应,在浓氨水的存在下,实际上先生成R1-NH-C(S)-SNH4。此步是放热反应,需要控制反应温度在30 ℃以下。滴加CS2时需要注意滴加速度,速度不能太快,否则温度升高会使副产物增多。加入氯乙酸钠后生成了R1-NH-C(S)-CH2COONa,实际上是氯乙酸钠作为亲核试剂发生了亲核取代反应。随后,水合肼作为亲核试剂进行了反应,为了反应进行完全,水合肼是过量的。反应结束后,粗产品经重结晶可得纯品。
2.2 化合物3d的表征
化合物3d的氢结构示意图和1H NMR谱图如图1和图2所示。δ2.053为CD3C(O)CD3的溶剂峰。在化学位移δ10.636~7.719共5个氢,分别是1号、2号、3号、4号和5号氢。水杨醛上羟基氢(3号)与亚胺-CH=N(5号)中的氮形成氢键、与N-NH-C(S)-中的氢形成氢键,由于受吸电子效应影响,降低了电子云密度,使两种氢表现出较强的去屏蔽效应,因而其吸收峰出现在低场。化学位移δ3.807~3.769处的吸收峰为两个亚甲基(7号和8号氢),两种氢各裂分成三重峰。6号和9号氢为活泼氢,在1H NMR上未显示出峰。从1H NMR测试结果推断,其质子在苯环及其他位置上的结构与目标产物结构一致。

图1 化合物3d的氢结构示意图

δ
2.3 抑菌活性
采用滤纸片扩散法测定水杨醛缩氨基硫脲化合物3在不同浓度下抑菌圈直径,结果如表1所示。有代表性的化合物3d抑制金黄色葡萄球菌的实验照片如图3所示。

表1 化合物3在不同浓度下的抑菌圈直径(mm)a
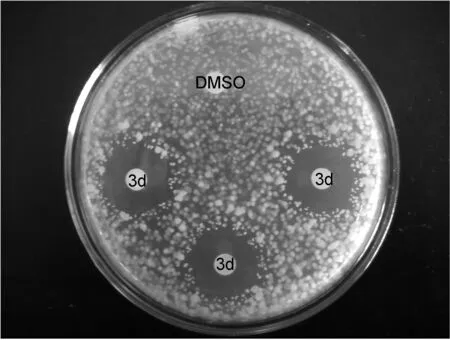
图3 化合物3d在1.0 mg/mL时抑制金黄色葡萄球菌的实验照片
从表1中可以看出,化合物3a、3b和空白样DMSO对三种菌株均无抑制活性。化合物3c和3d对3种菌株均有抑制活性;化合物3e和3f对金黄色葡萄球菌和枯草芽孢杆菌有抑制活性。化合物3d对金黄色葡萄球菌和枯草芽孢杆菌具有良好的抑菌性,并且随着溶液质量浓度的增大抑菌效果增强。当溶液质量浓度达到0.1 mg/mL时,对两种菌株均为低度敏感,抑菌圈为8 mm;当溶液质量浓度达到0.5 mg/mL时,对两种菌株均为中度敏感,抑菌圈分别为12 mm(金黄色葡萄球菌)和13 mm(枯草芽孢杆菌);当溶液质量浓度达到1 mg/mL时,对两种菌株均为极度敏感,抑菌圈平均直径约为30 mm。而化合物3d对大肠杆菌有低度敏感水平。当溶液质量浓度达到1 mg/mL时,化合物3e对金黄色葡萄球菌的抑菌圈为23 mm,对枯草芽孢杆菌的抑菌圈为14 mm。从图3也可以看出,滴加DMSO的滤纸片上显示为无抑菌圈,而另外3个加有1.0 mg/mL3d溶液的滤纸片周围显示出明显的抑菌圈,抑菌圈平均直径约为30 mm,证明3d在1.0 mg/mL浓度下对金黄色葡萄球菌有很强的抑制活性。
通过初步的构效关系分析发现:(1)取代水杨醛N(4)缩氨基硫脲的水杨醛部分连有溴原子可以增强革兰氏阳性菌的抑制活性;(2)2-乙酰基吡啶N(4)缩氨基硫脲可以增强革兰氏阳性菌的抑制活性;(3)缩氨基硫脲的氨基硫脲部分连有羟基可以增强抑菌活性。
合成了6个缩氨基硫脲化合物3a~3f。体外抗菌活性筛选结果表明,化合物3d具有良好的抗菌活性,在水杨醛上含有溴、氨基硫脲部分含有羟基对革兰阳性菌(金黄色葡萄球菌和枯草杆菌)有非常强的抗菌活性,对革兰阴性菌(大肠杆菌)有一定的抗菌活性。该化合物有可能成为抗革兰阳性菌的先导化合物,值得进一步研究。
