环状碳酸酯的固载型离子液体催化合成
2022-01-11卢金凯初秉宪金理健肖健泽董丽辉范闽光
卢金凯, 张 梦, 初秉宪, 金理健, 肖健泽, 李 斌, 董丽辉, 范闽光
(广西大学化学化工学院∥广西石化资源加工及过程强化技术重点实验室, 南宁 530004)
自工业革命以来,化石燃料成为全球的主要能源支柱. 随着世界人口增长和全球工业化进程的加快,大量的化石燃料被消耗,CO2排放不可避免. CO2作为主要的温室气体,时刻影响着全球气候和人类的生产生活,例如近几年引起高度重视的全球变暖导致的两极冰川融化和海平面上升的问题. 最有效控制CO2排放的方法是捕获、封存和利用CO2[1],大气中CO2含量非常高,且易获得,具有天然、无毒、丰富、廉价等优点,是一种非常具有前景的C1资源[2].
在CO2的利用过程中,将其和环氧化物反应合成环状碳酸酯的方法受到了科研人员的青睐,因为该反应拥有100%的原子利用率[3],生成的环状碳酸酯作为绿色化学品在工业生产上应用广泛. 近年来已经报道了多种用于CO2和环氧化物合成环状碳酸酯的催化剂[4],其中离子液体(ILs)因为具有蒸气压低、毒性低、易于合成且性质稳定等特点,是优良的相转移催化剂[5],并且为了方便分离,研究人员将多种离子液体(醇胺、咪唑鎓、吡啶鎓、季铵盐和季鏻盐等)嫁接在固体载体(SiO2、介孔分子筛)上[6],但该过程往往需要交联剂(三甲氧基硅烷等),增加了嫁接的复杂性,限制了离子液体嫁接量(交联剂占用孔道空间),并且嫁接物容易脱落.
氯甲基聚苯乙烯树脂微球(PS-Cl)廉价易得,有很好的酸碱耐受性,结构稳定,具备作为催化剂载体的条件,表面具有丰富的氯甲基,避免使用交联剂,可以直接作为醇胺烷基化反应的活性基团[7-8].
本文通过烷基化反应和简单的一锅法将醇胺类离子液体嫁接在氯甲基聚苯乙烯微球上,在微球表面形成羟基功能化的季铵盐离子液体, 比较了不同阴离子基团对反应的影响. 为了探讨反应条件的影响,研究了催化剂用量、反应压力、温度和时间等因素. 此外,为了进一步研究可重复使用性,将其多次重复使用,提出了合理的反应机理.
1 实验部分
1.1 试剂与仪器
主要试剂:氯甲基聚苯乙烯微球、乙腈、三乙醇胺、碘化钾(KI)、溴化钾(KBr)、四氟硼酸钠(NaBF4)和环氧丙烷(PO)均为分析纯,购于阿拉丁股份有限公司;氮气、CO2、氢气和空气的纯度均为99.999%,购于广东华特股份有限公司.
主要仪器:扫描电子显微镜(Hitachi S-3400,日本日立)、X射线光电子能谱仪(ESCALAB 250XI,美国赛默飞)、热重分析仪(TGA/DSC3,瑞士梅特勒-托利多)、气相色谱(GC-2010 plus,日本岛津).
1.2 制备方法
反应式见图1,将50 mL乙腈、1.5 g氯甲基化聚苯乙烯小球(PS-Cl)和0.3 g KI(等物质的量的KBr、NaBF4,或无添加)加到容积为100 mL的三颈圆底烧瓶中,打开恒温加热搅拌器将混合物加热至70 ℃,然后在搅拌状态下缓慢滴加2 mL三乙醇胺,继续升温至90 ℃,回流反应24 h. 反应完毕后将反应混合物静置冷却至室温,去除上层清液,得到白色的沉积物,用乙醇洗涤3次,放到烘箱中80 ℃下干燥12 h以上,得到催化剂为PS-[TEA]I(PS-[TEA]Br、PS-[TEA]BF4、PS-[TEA]Cl).

图1 催化剂的制备方法
1.3 催化剂的表征
使用KBr压片检测法在波数400~4 000 cm-1范围内对样品进行傅里叶变换红外光谱(FT-IR)分析. 通过扫描电子显微镜(SEM)观察样品的微观细节. XPS数据在Al Kα辐射(1 486.8 eV)下测定,将C 1s(284.6 eV)作为内部结合能的标准. 使用TGA/DSC3热重分析仪测试热稳定性,测试前将所有样品在100 ℃下干燥4 h,然后在氮气气氛下以升温速率为10 ℃/min从室温升至900 ℃.
1.4 反应活性测试
反应前将催化剂放入烘箱中120 ℃下活化4 h,称取0.1 g(在反应物中摩尔分数为0.63%)催化剂,移取1.2 mL(17 mmol)环氧丙烷于25 mL高压反应釜中,缓慢通入CO2保持5 min以排除釜内空气,关闭出气口,待压力缓慢升至预计压力后,打开升温和搅拌开关,调节预计温度和转速(500 r/min). 反应结束后,将反应釜置于冰水混合物中降温至室温,然后缓慢打开出气口,防止产物喷出. 过滤并离心分离液体产物和固体催化剂. 对于使用后的催化剂,用乙醇洗涤3次,放入烘箱中在80 ℃下干燥12 h以上,用于下次循环.
对过滤后的液体产物进行气相色谱分析. 将液体产物注入配有 FID 检测器的 GC 气相色谱仪中检测. 本实验使用型号为 GC-2010 plus 气相色谱仪,色谱柱使用 DB-624 型毛细管柱,规格 30 m×0.32 mm×1.8 μm,通入以 N2为载气、H2和空气为混合气体,检测液进样量均为0.2 μL. 采用程序升温,具体步骤:(1)柱温60 ℃保持 1 min,以30 ℃/min速率升温到 240 ℃ 保持 8 min;(2)采用SPL气化室,温度 250 ℃;(3)采用FID 检测器,温度 250 ℃.
利用气相色谱中的面积归一化法来确定上层清液混合物中各组分的含量,其中包括:环氧化物、环碳酸酯、副产物(丙二醇)以及其他杂质(空气中水分).
转化率(Conversion)
(1)
产率(Yield)
(2)
选择性(Selectivity)
(3)
其中,n0表示加入初始环氧化物的物质的量,n表示生成环碳酸酯的物质的量,n1表示未参与反应的环氧化物的物质的量.
2 结果与讨论
2.1 材料表征
2.1.1 傅里叶变换红外光谱(FI-IR) 由PS-Cl和PS-[TEA]I的红外光谱(图2)可知,PS-[TEA]I在波数3 350 cm-1附近存在很强的宽峰,此处对应于三乙醇胺中羟基(-OH)的伸缩振动峰[9-10];PS-Cl在1 267 cm-1处有C—Cl键的较强伸缩振动峰[11],而在PS-[TEA]I的红外光谱中,1 267 cm-1处的特征峰已经消失,说明载体聚苯乙烯上的Cl已被部分取代[12];综合以上分析,三乙醇胺基离子液体已经成功被嫁接到PS小球上.

图2 PS-Cl和PS-[TEA]I的FI-IR谱
2.1.2 微观形貌 从氯甲基化聚苯乙烯小球的SEM图(图3A)可看出,未嫁接的三乙醇胺基离子液体的PS-Cl表面光滑平整,且形状规则[13];而嫁接了三乙醇胺基离子液体的聚苯乙烯小球的整体(图3B)和局部形貌(图3C)显示,当聚苯乙烯小球嫁接了三乙醇胺基离子液体后,其表面比未嫁接时的表面更粗糙,这表明三乙醇胺基离子液体已经被嫁接到PS小球上[7].

图3 PS-Cl和PS-[TEA]I的SEM图
2.1.3 X射线光电子能谱分析 在嫁接前后,载体表面元素的质量分数见表1,在PS-[TEA]I表面均检测出了N、I、O元素,说明三乙醇胺基离子液体已经嫁接到PS小球上. 在XPS能谱分析(图4A)中,Cl 2p的主峰结合能由PS-Cl的200.29 eV偏移到PS-[TEA]I的199.08 eV,这是由于三乙醇胺基离子液体的成功嫁接使部分有机Cl向Cl-转化;I 3d峰为618.88 eV,符合I-的状态;N1s峰的结合能为402.45 eV,也是成功季铵化的表现[12]. 图4B显示PS-[TEA]I中存在未被烷基化的Cl(有机Cl).
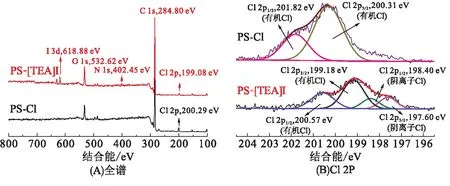
图4 PS-Cl和PS-[TEA]I的XPS能谱

表1 PS-Cl和PS-[TEA]I的表面元素XPS分析结果Table 1 The XPS analysis results of the elements on the surface of PS-Cl and PS-[TEA]I
2.1.4 元素分析(EA) 各物质的元素分析(测定2次取平均值)结果(表2)显示,PS-[TEA]I中碳、氮的质量分数分别为76.57%、1.50%,与载体PS-Cl相比,w(C)明显降低,而N元素源于三乙醇胺的嫁接,这一结果也再次证明了离子液体已经嫁接在PS-Cl表面,根据w(N)计算可得嫁接量为1.07 mmol/g(约为19.77%),此外,对循环5次后PS-[TEA]I的元素分析结果表明,该催化剂能够保持较好的稳定性.
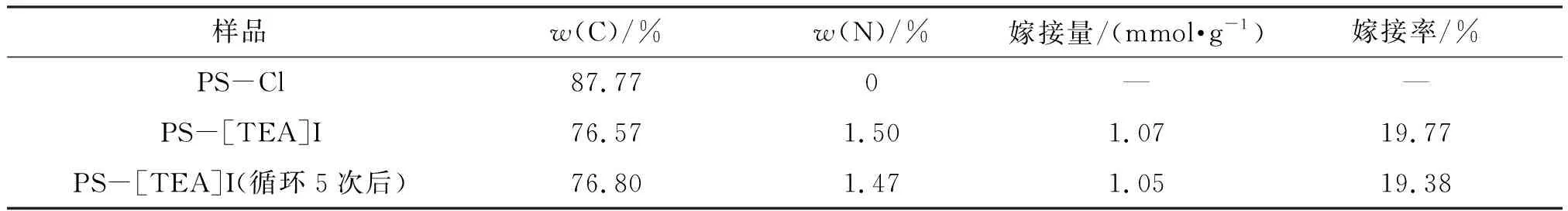
表2 各种样品的元素分析数据Table 2 The data of elemental analysis of various samples
2.1.5 热稳定性 与PS-Cl相比,PS-[TEA]I的热稳定性有所下降(图5). PS-Cl在350 ℃左右开始分解,质量损失率为5.29%,源自氯甲基化聚苯乙烯中Cl的损失. 当升温至370~380 ℃时,由于高温使聚苯乙烯的交联骨架遭到破坏[14],所以质量损失率大;而PS-[TEA]I在200 ℃开始分解,在200~350 ℃质量损失了20.32%,与元素分析结果(19.77%)基本一致,这是因为嫁接上的三乙醇胺基离子液体受热不稳定而分解[15];在350 ℃之后,聚苯乙烯上未被取代的Cl以及聚苯乙烯骨架都因高温而分解. PS-[TEA]I的最高承受温度为200 ℃,这远高于实验的反应温度,所以该催化剂具有较好的热稳定性,在实验中可以稳定存在.

图5 PS-Cl和PS-[TEA]I的TGA曲线
2.2 催化活性
选择廉价、稳定和安全的环氧丙烷作为催化反应的底物. 选择一系列三乙醇胺基催化剂来研究不同阴离子对碳酸丙烯酯(PC)合成的影响(表3). 结果表明:不存在任何催化剂,就不会形成PC产物(表3中的实验1);只有三乙醇胺和PS-Cl具有非常低的催化性能(表3中的实验2和实验3). 在不同阴离子活性的比较中,I-具有最好的活性(表3中的实验4~7). 该结果可能与阴离子的亲核性有关(I->Br->Cl->F-)[16],三乙醇胺中的羟基也会对环氧化物有活化作用[17]. 因此,通过选择最佳催化剂PS-[TEA]I,进一步优化了环氧丙烷和CO2合成环状碳酸酯的反应条件.
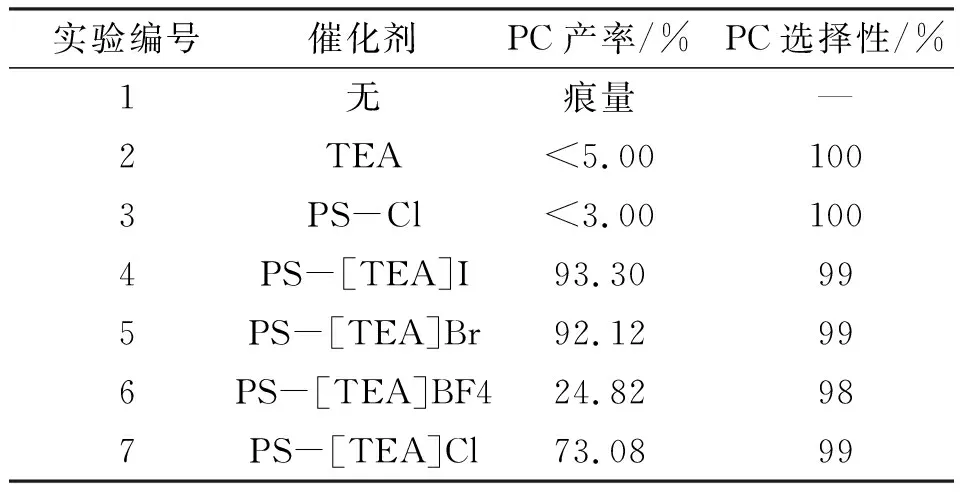
表3 不同催化剂对CO2与PO环加成反应的催化性能
2.3 不同反应条件的影响
以制备的PS-[TEA]I为反应催化剂,在120 ℃和2 MPa CO2气压的条件下反应4 h,探究不同催化剂用量对CO2和环氧丙烷环加成反应的影响(图6),当催化剂用量从0.025 g增加到0.10 g时,PC的产率由38.99%升高到93.30%;此时继续提高催化剂用量至0.20 g,PC的产率为96.76%,只是略有提高,反应选择性一直保持在99%以上.
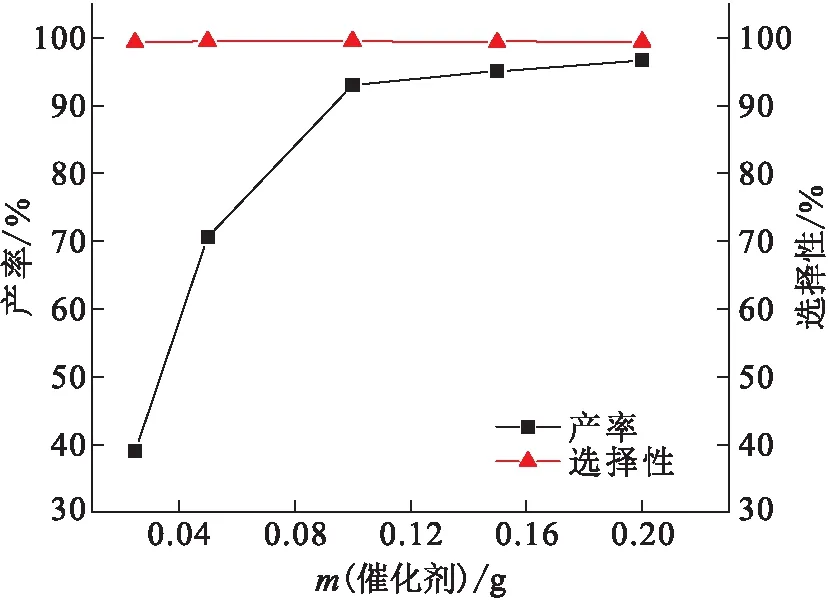
图6 催化剂用量对PC产率的影响
以0.1 g PS-[TEA]I作为反应催化剂,以反应温度120 ℃、2 MPa CO2气压为条件探究了反应时间对PC产率的影响(图7),随着反应,PC的选择性一直在99%以上,产率在不断增加. 当反应2 h时,PC的产率为84.26%,反应时间增加到4 h时,PC的产率为93.30%,增幅较大;当反应6 h后,PC的产率仅增加到94.80%,与反应4 h相比略有增加. 从节能的角度考虑,PS-[TEA]I在反应4 h内即可有效地将CO2和环氧丙烷转化为PC,所以最佳反应时间确定为4 h.
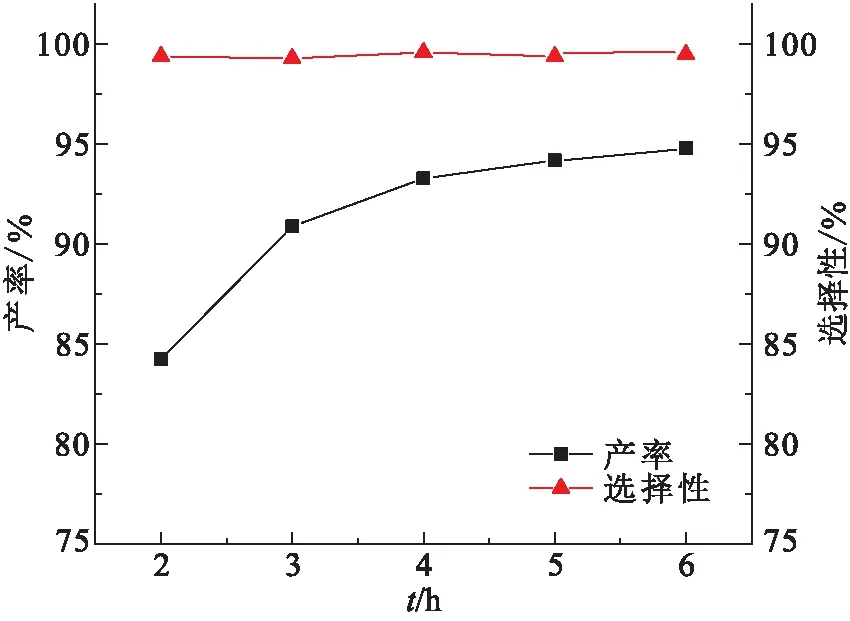
图7 反应时间对PC产率的影响
探究CO2气压对PC产率的影响(图8),结果显示CO2气压对反应选择性的影响不大,但是对产率的影响较大. 对于在反应低压区(0.5~2.0 MPa),CO2气压增加会引起碳酸酯丙烯酯产率的增加,但是当CO2气压大于2.0 MPa时,PC产率反而下降,类似的情况也在其他催化体系中出现过. 主要原因是由于CO2气压过大,导致催化剂周围环氧丙烷的浓度相对降低[18],不利于反应的进行,PC的产率降低.
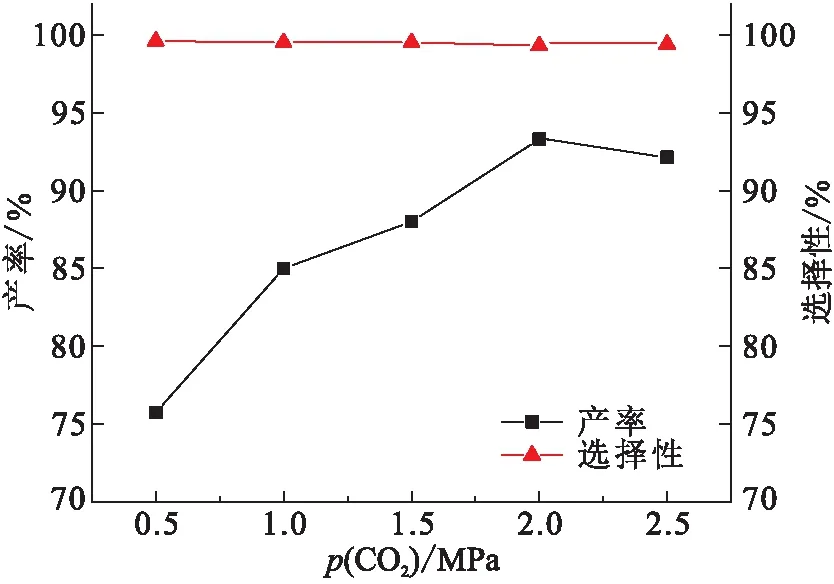
图8 CO2气压对PC产率的影响
以0.1 g PS-[TEA]I为反应催化剂,在2 MPa CO2气压下反应4 h,探究了反应温度对PC产率的影响(图9). 温度由90 ℃升至120 ℃,PC的产率由80.4%增加到93.3%,当继续升温至130 ℃,PC的产率略有增加. 过高的反应温度容易使CO2和环氧丙烷生成副产物(图10),例如PC聚合生成聚碳酸酯、环氧丙烷异构化以及环氧丙烷和水的相互作用[19]等,结合气相色谱仪分析结果显示,尽管此时环氧丙烷的转化率较高(大于90%),但是反应选择性开始降低.
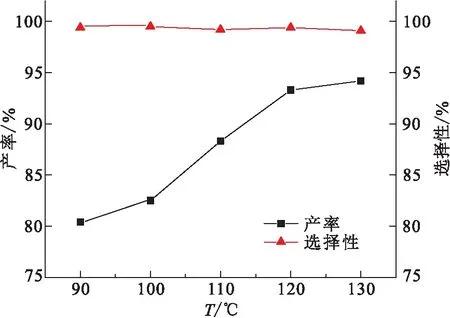
图9 反应温度对PC产率的影响
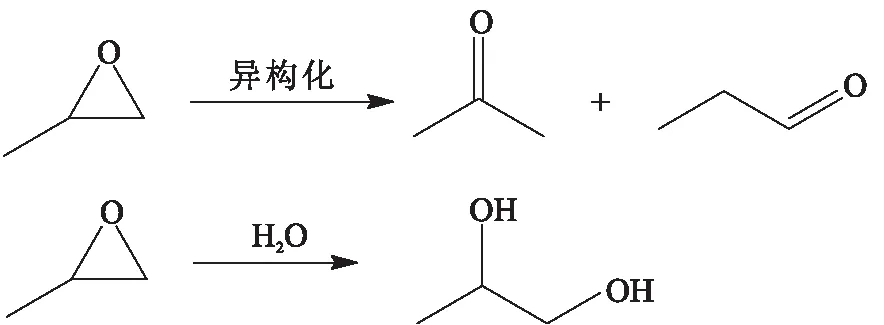
图10 PO可能发生的副反应
2.4 催化剂的循环性能
以1.2 mL环氧丙烷为底物,0.1 g PS-[TEA]I为催化剂,在120 ℃、2 MPa CO2气压下反应4 h考察催化剂的循环性能(图11). 每次反应结束后离心混合物,将分离得到的催化剂用无水乙醇洗涤离心3次,然后放入烘箱80 ℃恒温干燥,用于下一次循环反应. 结果显示,PS-[TEA]I循环使用5次仍保持着良好的催化活性. 在使用5次之后,产率开始低于90%.

图11 催化剂PS-[TEA]I的循环性能
2.5 提出的反应机理
根据以上实验和一系列前人的研究[20],我们提出了PS-[TEA]I催化剂的催化机理(图12). 首先,PS-[TEA]I上的羟基与环氧化物上的O原子通过形成氢键使环氧化物活化,实现C—O键的极化(Step 1);然后,作为路易斯碱的I-亲核进攻环氧化物上空间位阻比较小的β-C原子,使环氧化物开环形成氧负离子中间体,该中间体通过羟基上的氢键保持稳定(Step 2);随后,CO2作为亲电试剂插入氧负离子中间体中,形成新的烷基碳酸酯化合物(Step 3);最后,通过闭环反应生成环碳酸酯,并使催化剂PS-[TEA]I再生进行下一个催化循环(Step 4). 在整个催化循环中,PS-[TEA]I作为氢键供体使环氧化物活化,通过与I-的协同作用共同促进环加成反应的顺利进行.
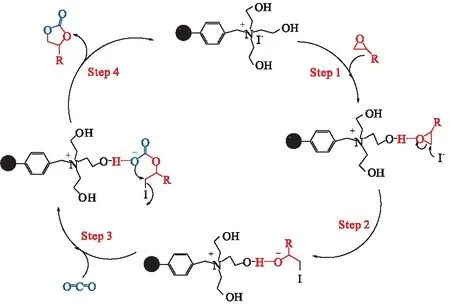
图12 PS-[TEA]I催化的CO2与环氧化物环加成的反应机理
3 结论
利用“一锅法”合成了一种聚苯乙烯嫁接的三乙醇胺基离子液体催化剂 PS-[TEA]I,通过SEM、XPS、FI-IR、TGA等方法对催化剂进行了表征,证实了三乙醇胺基离子液体的成功嫁接. 将催化剂应用于CO2与环氧丙烷的环加成反应,当使用0.1 g PS-[TEA]I时,在120 ℃、2 MPa CO2气压的条件下反应4 h,PC的产率可达93.3%,反应选择性大于99%,并且在多次循环使用的过程中能保持良好的稳定性. 最后提出了PS-[TEA]I的催化机理:由于PS-[TEA]I中含有较多羟基和卤素阴离子,作为一种氢键供体和亲核试剂可以很好地协同催化环氧化物环加成反应的进行.
