Tie2突变与儿童静脉畸形相关性研究
2022-01-11徐文婵刘珍银陈钦谕张靖
徐文婵 刘珍银 陈钦谕 张靖
静脉畸形(venous malformation,VM)旧称海绵状血管瘤,是人体最常见的良性、低流速脉管畸形,属于静脉发育畸形,约占血管畸形总数的95%[1]。VM 发病率为 1∶5 000~1∶10 000,男∶女比例约为1∶1,可发生于身体的任何部位,头颈部与躯干部发病率均约为40%,四肢部约为20%[2]。
目前VM的治疗方式主要包括介入硬化治疗、手术治疗、冷冻治疗、激光治疗以及放射性核素敷贴等,其中手术切除现已成为辅助治疗手段,如应用于硬化剂治疗多次效果仍不明显,而病灶体积巨大严重影响外观与功能者等;放射性核素敷贴效果欠佳且遗留明显的色素沉着,目前已很少应用;激光治疗深部病灶如腮腺内、咬肌区的VM时,皮肤吸收较多激光而深部病灶并不能得到很好的治疗,一旦增加功率又会给皮肤带来较大损伤,因此不作为治疗首选;血管内硬化介入治疗是目前国际主流的治疗方式,主要优势为创伤小、疗效明显、可重复多次进行。但仍有部分患者对以上常规治疗并不敏感,疗效不理想,因此国内外专家进行了更深入的发病机制研究,希望能在基因层面寻找到突破口。
研究者早期即发现血管紧张素受体酪氨酸激酶(tyrosine kinase,TEK,又称Tie2),分布在血管内皮细胞、造血干细胞和促血管生成单核细胞中[3-4],但主要是在内皮细胞中表达,其与配体ANG2发生特异性结合后对血管内皮平滑肌细胞的通讯起着关键性的调节作用。随着进一步的基因靶向研究表明,Tie2/ANG2信号通路在胚胎期、成人期的血管发育中均起着重要的调节作用,各种原因引起的基因突变可导致Tie2磷酸化水平升高,致使Tie2促血管生成的活性升高,从而导致畸形血管的发生;例如家族性皮肤黏膜静脉畸形(venous malformation,cutaneuos and mucosal,VMCM)和约50%的散发性VM是由受体Tie2突变引起的[5-9]。基于此,本研究的目的是针对Tie2突变位点与VM发生的相关性进行初步探讨。
资料与方法
一、研究对象
该项研究获得广州市妇女儿童医疗中心医学伦理委员会的批准和参与者的知情同意。本试验VM病例组共纳入VM患者56名,为2018年就诊于广州市妇女儿童医疗中心的患者,均符合国际诊断标准,年龄从1~10岁,平均年龄(4.5 ± 2.3)岁,男∶女比例为1∶1,病灶部位及数目详见表1;健康对照组血液标本来自于30名健康人群,男∶女为1∶1,年龄从1~10岁,平均年龄(4.3 ± 1.2)岁。VM病例组纳入标准:(1)VM患儿疾病诊断依据符合“血管瘤和脉管畸形诊断和治疗指南(2016版)”;(2)获得知情同意;(3)资料完整。排除标准:(1)资料不完整,失访;(2)既往接受其他治疗。
二、DNA提取、准备与纯化
(一)主要试剂
(1) 基 因 组DNA提 取 试 剂;(2)PCR扩增试剂:引物(上海生工);(3)琼脂糖凝胶电泳试剂:DNA分子(Marker莱枫生物有限公司),TE缓冲液(上海生工);(4)引物合成:PCR引物和测序引物合成由上海生工完成,针对Tie 2 基因13号外显子的PCR正向引物F 5'-TCTGTCTGTGCCACTCTT-3',反 向 引 物R 5'-CACGGTAATCCTATGTAA-3',测 序 引 物5'-CACGGTAATCCTATGTAA-3';(5) 测 序 试 剂:SAP酶(ABI公司),BDT(ABI公司),无水乙醇(上海生工)。
(二)主要步骤
1.提取外周血白细胞DNA
取外周血2 mL,用DNA提取试剂盒提取外周血白细胞DNA,所有离心操作均在室温下进行。用洗脱缓冲液TE溶解,以紫外分光光度仪测定所有DNA样品的纯度和浓度,并保存于-80℃ 。
2.针对Tie2基因的13号外显子进行引物设计
本试验所设计的Tie2基因的聚合酶链式反应(polymerase chain reaction,PCR)引物见表1,PCR扩增条件流程见图1。

表1 PCR反应体系

图1 PCR扩增条件流程
(三)纯化
利用琼脂糖凝胶电泳方法将PCR扩增的产物按照不同分子量分开,将含有目的产物的条带用刀片切下来,用溶剂把凝胶溶解后再浓缩,然后回收溶液中的目的DNA片断。
三、测序及结果处理与分析
采用直接测序法,即一代测序,由上海生工完成。测序结果用Chromas软件分析核酸序列,在NCBI网站与已知序列进行比对。把所有个体的情况录入预先设计Excel统计表中。将各组标本的Tie2突变情况(如表2),采用SPSS 13.0统计软件进行统计分析。

表2 56例病例样本—VMs的临床特征以及Tie2基因13号外显子突变结果
结 果
本次研究中的所有数据均使用SPSS 13.0进行统计分析。其中VM病例组与健康对照组间在年龄(t检验,P> 0.05)与性别(男∶女均为1∶1)方面均无统计学意义,数据具有可比性。本次试验中纳入的30例正常人血液标本中检测Tie2基因的13号外显子突变率仅为3.3%(1/30),VM病例组突变率为57.1%(32/56)。
VM病例组内进行卡方检验(校正公式,部分实际频数< 5),χ2和P值如表3所列,P值均>0.05,无统计学意义;即不能认为VM的Tie2基因13号外显子突变率与性别有关,不能认为患者出生时即有病灶还是出生后才有病灶有差别,不能认为病灶位于身体不同部位的突变率有差别VM病例组与健康对照组(总数n< 40)组间突变率的比较使用Fisher确切概率法(见表4)进行分析,发现两组之间突变率不同,VM病例组突变率高于健康对照组(P< 0.05),具有统计学意义。
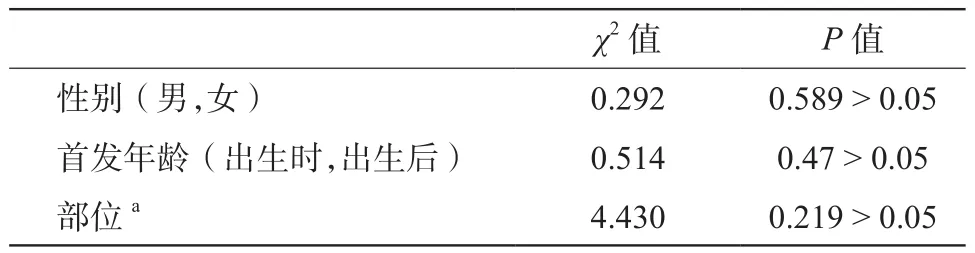
表3 VMs组内突变率的比较
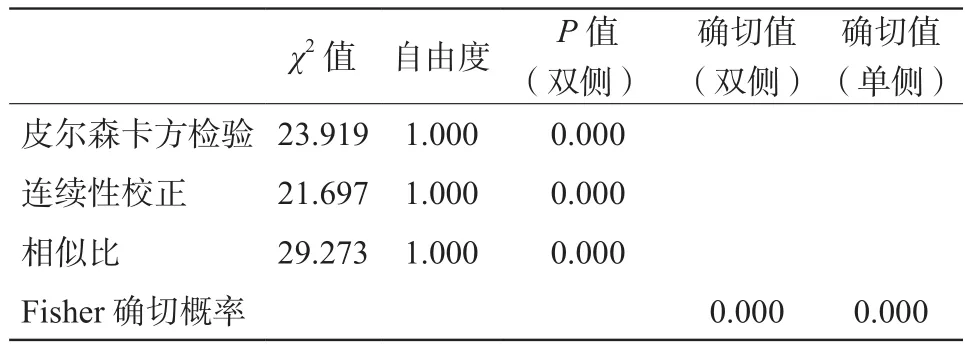
表4 VM病例组与健康对照组间突变率的比较
讨 论
VM患者最主要的症状就是疼痛,由于病灶具有侵蚀性,能跨组织生长,如同时累及皮肤软组织与深部肌肉群甚至侵犯骨膜,因此无论是硬化治疗还是手术切除,都只是限制病灶的继续生长,而无法将病灶畸形血管完全清除。为此,针对这些介入硬化、手术治疗、激光治疗等现有的治疗方式不敏感的难治性VM,科学家们在分子机制与靶向治疗上进行了一系列更深入的研究。
VM是由血管发育畸形导致的疾病,以血管发育原理为重点的研究揭示了生长因子家族和细胞信号传导机制(包括Ang/Tie2、Notch家族、TGFB/ALK1、FGF、S1P/EDG1、信号素 /神经丛素、Netrin/UNC5B、细胞基质/整合素信号传导,以及其他调节血管生成性甲酚酶的途径)对血管和淋巴管的形态发生、发育、成熟及稳态都至关重要。研究证实Tie/ANGPT是内皮细胞信号主要传导途径之一,Tie/ANGPT家族包括Tie1、Tie2 2种受体和 Angpt1、Angpt2 和 Angpt4 3 种 配 体[10-11],Tie2分别与Angpt1和Angpt2结合从而介导血管成熟和血管生成[12-15]。如果在小鼠基因中敲除Tie2或Angpt-1会导致血管分支畸形改变,管壁平滑肌细胞严重覆盖不足[15-16]。在发育的胚胎中,Angpt-1的缺失会导致血管网紊乱,畸形扩张的血管数量也会增加[17]。
Ang/Tie2信号通路在协调内皮细胞行为、形成和重塑血管网络的多个方面起着至关重要的作用。Tie2基因的突变可以引起血管畸形的发生,此类突变所致的VM共同点就是Tie2均有磷酸化(即活化),只是水平不等,但是目前的研究中包括本次研究均没有发现突变率与任何临床特征(性别、发病年龄、病灶数量、严重程度、类别或复发率)之间存在明显的关联。Ye等[18]鉴定出Tie2 17号外显子的7个错义突变,之前也有学者在散发性VM中报道过,但是57.1%(20/35)单突变率与L914F有关,与Limaye报道的100%(24/24)相差较远,认为可能与人群种族不同、样本大小不同等因素有关。Boscolo等[19]通过向免疫缺陷的小鼠注射最常见的引起VM突变类型L914F的HUVECs(人脐静脉血管内皮细胞),从而建立小鼠VM模型,检测雷帕霉素与Tie2抑制剂(Tie2-TKI)对小鼠VM的影响,发现雷帕霉素能够有效降低突变体诱导的Tie2-Akt信号传导,虽然确切机制不明但阻止VM进展的疗效明显;Tie2-TKI虽然是靶向抑制Akt信号传导,但是作用弱,而且对Tie2具有剂量依赖性。在此基础上Boscolo等又进行了一项前瞻性临床试验,对6名标准治疗方式无效的VM患者采取雷帕霉素口服治疗,发现雷帕霉素可明显减轻疼痛、出血、病变大小、功能和美学损伤以及血管内凝血障碍,第一次实现了VM的分子水平的试探性治疗[19]。但是后期带来的众多二级临床并发症不得不纳入考虑范围,而且口服雷帕霉素对于病灶局限的VM患者疗效与剂量也未知,虽然给我们提供了新的研究方向,但是目前并不建议临床推广使用。
本研究中静脉畸形患者Tie2 13号外显子突变率较正常人群显著升高,这为对标准疗法不敏感的难治性VM提供了新的思路。虽然关于此类脉管性畸形疾病的具体发病机制尚不明确,但是相信随着分子生物学研究的进一步深入,在不久的将来分子治疗领域一定能获得突破性进展,不仅有利于疾病治疗,更有利于此类疾病的产前诊断与预防。
