膳食纤维对肠道菌群紊乱及脂代谢异常的修复作用
2022-01-10方城杰吴漫漫于海宁
方城杰,吴漫漫,于海宁
(浙江工业大学药学院 杭州 310014)
大量的研究证实,肠道菌群的数量和种类影响着多种代谢性疾病的发生和发展[1-2]。肠道菌群调节机体众多代谢过程,包括能量稳态、葡萄糖代谢和脂质代谢等[3]。肠道菌群对机体的调控依赖于腺苷酸活化蛋白激酶 (adenosine monophosphate activated protein kinase,AMPK)通路、胆汁酸、短链脂肪酸(short chain fatty acids,SCFAs)和三甲胺通路。其中,胆汁酸在肝脏中产生,并被肠道菌群的酶代谢,对维持健康的肠道菌群,平衡脂代谢等至关重要[4]。胆汁酸主要通过法尼酯X 受体(farnesoid X Receptor,FXR) 和G 蛋白偶联胆汁酸受体(G protein bile acid receptor-1,TGR5)信号通路来调节机体脂代谢[5]。FXR 信号通路不仅控制胆汁酸的合成,还可以通过调控胆固醇调节元件结合蛋白1c (sterol-regulatory element binding proteins 1c,SREBP-1c)的表达来影响脂肪酸合成酶(fatty acid synthetase,FAS)、乙酰辅酶A 羧化酶(acetyl CoA carboxylase,ACC)和硬脂酰辅酶A去饱和酶1 (stearoyl-CoA desaturase 1,SCD1)等脂代谢基因。
目前,由于抗生素的大量使用或高脂饮食的影响,机体肠道菌群遭到极大破坏。许多研究表明,抗生素处理后肠道菌群发生显著改变,影响机体胆汁酸组成,最终会导致脂代谢异常,引发糖尿病等疾病[6-7]。机体营养状态是防治疾病重要的影响因素,营养干预对肠道菌群有改善作用,也是防治疾病的重要作用机制[8]。膳食纤维是不易消化碳水化合物和木质素的总称[9]。在高脂饮食模型中,膳食纤维不仅能改善肠道菌群结构,增加拟杆菌(Bacteroidetes)丰度,提高SCFAs 含量,还能改善脂肪酸组成,调节脂代谢[10]。也有研究者认为,可溶性膳食纤维通过AMPK 和三甲胺实现对机体脂代谢的调节[11]。菊粉(inulin,SS)作为一种膳食纤维营养补充剂,被应用多种营养强化食品,具有调节肠道菌群和改善机体脂质平衡的功能[12-13]。
高脂饮食模型能引起肠道菌群紊乱,其含有的脂类物质对机体代谢也能产生直接的影响。采用头孢曲松钠灌胃,利用其不入血的特点,构建单纯的肠道菌群紊乱模型,对研究肠道菌群紊乱与脂代谢的关系更具优势。而膳食纤维是否能修复肠道菌群紊乱所致脂代谢异常,至今未见报道。
本文以菊粉为材料,通过灌胃头孢曲松钠(ceftriaxone,CRO),建立小鼠肠道菌群紊乱模型,探究其改善肠道菌群及修复脂代谢的作用,以期为膳食纤维的应用提供新的理论和试验依据。
1 材料与方法
1.1 实验动物与模型建立
SPF 级BALB/c 小鼠30 只,购自上海医科院,5 周龄,体重18~20 g,雌雄各半。小鼠在受控的环境条件(温度20~24 ℃;湿度40%~60%;12 h 光照/黑暗周期) 下适应1 周。随机分为3 组:正常组(CK 组),头孢曲松钠组(CRO 组)和菊粉组(SS组),每组10 只,雌雄各半。除CK 组外其余2 组灌胃CRO 10 d 构建肠道菌群紊乱模型。构建成功后,CRO 组自然恢复10 d;SS 组喂养菊粉10 d,剂量为0.04 g/只/d。
在处理前、建模成功、试验结束3 个时间点收集每只小鼠的粪便样本。试验结束后,小鼠禁食但不禁水12 h,采用摘除眼球的方式取血,随后脱颈处死,并取肝脏样本。全血室温静置30 min 后,3 500 r/min 4 ℃离心15 min,吸取上层血清于洁净离心管中。所有样本收集后,做好标记,及时放于-80 ℃冰箱中保存。所有试验程序均按照浙江工业大学实验室动物护理和使用指南进行,并符合美国国立卫生研究院实验室动物护理和使用指南(第85-23 号出版物,1996年修订)。
1.2 肠道菌群宏基因分析
粪便样品由浙江天科高新技术发展有限公司完成宏基因组测序。针对样品16S rRNA 基因V3-V4 区,采用通用引物进行PCR 扩增及测序;对测序结果进行多样性及菌群结构分析。
1.3 血脂测定
血清中总甘油三酯 (total triglycerides,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇 (high density lipoprotein cholesterol,HDLC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C) 和载脂蛋白B48(apolipoprotein B48,APO-B48)均采用试剂盒(南京建成)进行测定。
1.4 粪便SCFAs 测定
称取干燥后粪便100 mg,加入1.6 mL 纯水溶解,充分涡旋振荡2 min 后,再加入0.4 mL 50%硫酸溶液及1.5 mL 乙醚,放置到摇床中,250 r/min振荡30 min,取出后,3 000 r/min 离心5 min,取上清于离心管中,加入无水氯化钙脱水,过0.22 μm滤膜后,乙醚定容至1 mL,取1 μL 进行气相色谱分析。
1.5 肝脏与血清脂肪酸谱测定
在100 mg 肝组织中加入1 mL 生理盐水并在0 ℃下全速匀浆5 min,通过与氯仿和甲醇(体积比2∶1) 混合将样品萃取两次。在4 ℃下以3 000 r/min 离心10 min 后,分离出有机相。除去上层相并收集下层相,将脂质提取物在氮气流中干燥。
血清样本取100 μL,加入氯仿和甲醇(体积比2∶1),将样品萃取两次。在4 ℃下以3 000 r/min离心10 min 后,分离出有机相。除去上层相并收集下层相,将脂质提取物在氮气流中干燥。并进行衍生化:取1 mL 0.5 mol/L KOH-甲醇放入用氮气密封的干燥管中,在60 ℃水浴中加热10 min;通过添加1.5 mL 的13%BF3-甲醇并在60 ℃水浴中温育40 min 进行甲基叔丁基醚衍生化。加入1.5 mL 正己烷,涡旋1 min,然后加入饱和氯化钠溶液并以3 000 r/min 离心15 min 后收集样品。采用气相色谱进行脂肪酸谱测定。
1.6 粪便胆汁酸测定
1) 取0.1 g 冻干粪便样本,加入2 μL 内标液(23-nor-5b-cholanoic acid-3a,12b-diol at 1 mg/mL)。
2) 1 mL 样本加入4 mL 0.4 mol/L 碳酸铵。孵育30 min,60 ℃。
3) 加入4 mL 水,均质化30 s。
4) 离心20 min,20 000 r/min,4 ℃。
5) 固相萃取:采用反相二氧化硅C18 色谱柱,色谱柱依次通过5 mL 甲醇和5 mL 水活化,加入离心后上清液,之后依次使用20 mL 水、10 mL己烷、20 mL 水、10 mL 己烷、20 mL 水洗脱,最后使用甲醇洗脱胆汁酸。
6) 将含有胆汁酸的甲醇溶液使用氮气吹干,50 ℃。
7) 使用150 μL 甲醇重溶,采用液质联用进行检测。
1.7 统计学分析
采用Graph Pad Prism 8.0 软件对试验数据进行单因素方差分析,结果以平均数±标准误表示。
2 结果
2.1 菊粉对肠道菌群的修复作用
CRO 处理后小鼠肠道菌群结构发生明显改变,通过SS 干预能够促进部分肠道菌群丰度的恢复(图1a 和1b)。通过Shannon 指数和Simpson 指数可知(图1c 和1d),小鼠的肠道菌群多样性经CRO 处理后明显降低,SS 干预后仍低于处理前。由此,SS 干预能促进部分有益菌丰度的显著增加,并不能快速提高小鼠肠道菌群的多样性。由图1e 和1f 可知,经SS 干预后,头孢曲松钠处理导致的门水平拟杆菌门、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)的改变均得到显著修复。这3类菌群是小鼠肠道菌群的主要微生物群类,占总菌的90%以上,而其中变形菌门被认为是一种致病菌[14],该菌门丰度的增加往往意味着肠道菌群紊乱,同时它也是肥胖等疾病的潜在诊断标准[15-16],SS 能够显著降低变形菌门的丰度。同时,拟杆菌和厚壁菌参与了脂类和胆汁酸代谢,维持宿主体内能量平衡。拟杆菌和变形菌都能产生胆汁酸水解酶(bile salt hydrolase,BSH),能够水解共轭胆汁酸[17-19]。SS 能够明显增加这两种菌门的丰度。因此,SS 可能通过修复肠道菌群紊乱改善胆汁酸代谢,并改善脂代谢异常。此外拟杆菌和厚壁菌比例的失调可能会增加肥胖的概率[20-21]。从属水平上看,拟杆菌属为拟杆菌门,它们除了能够代谢共轭胆汁酸为游离胆汁酸外,还具有较高的7α-/7β-脱羟基酶活性,能够在肠道中将初级胆汁酸代谢为次级胆汁酸[22]。拟杆菌属(Bacteroides)也被认为是一类有益的肠道菌群[23-24]。SS 的干预能显著提高拟杆菌属的丰度,从而增加BSH 活性并减少共轭胆汁酸含量,促进初级胆汁酸代谢,改善机体代谢。
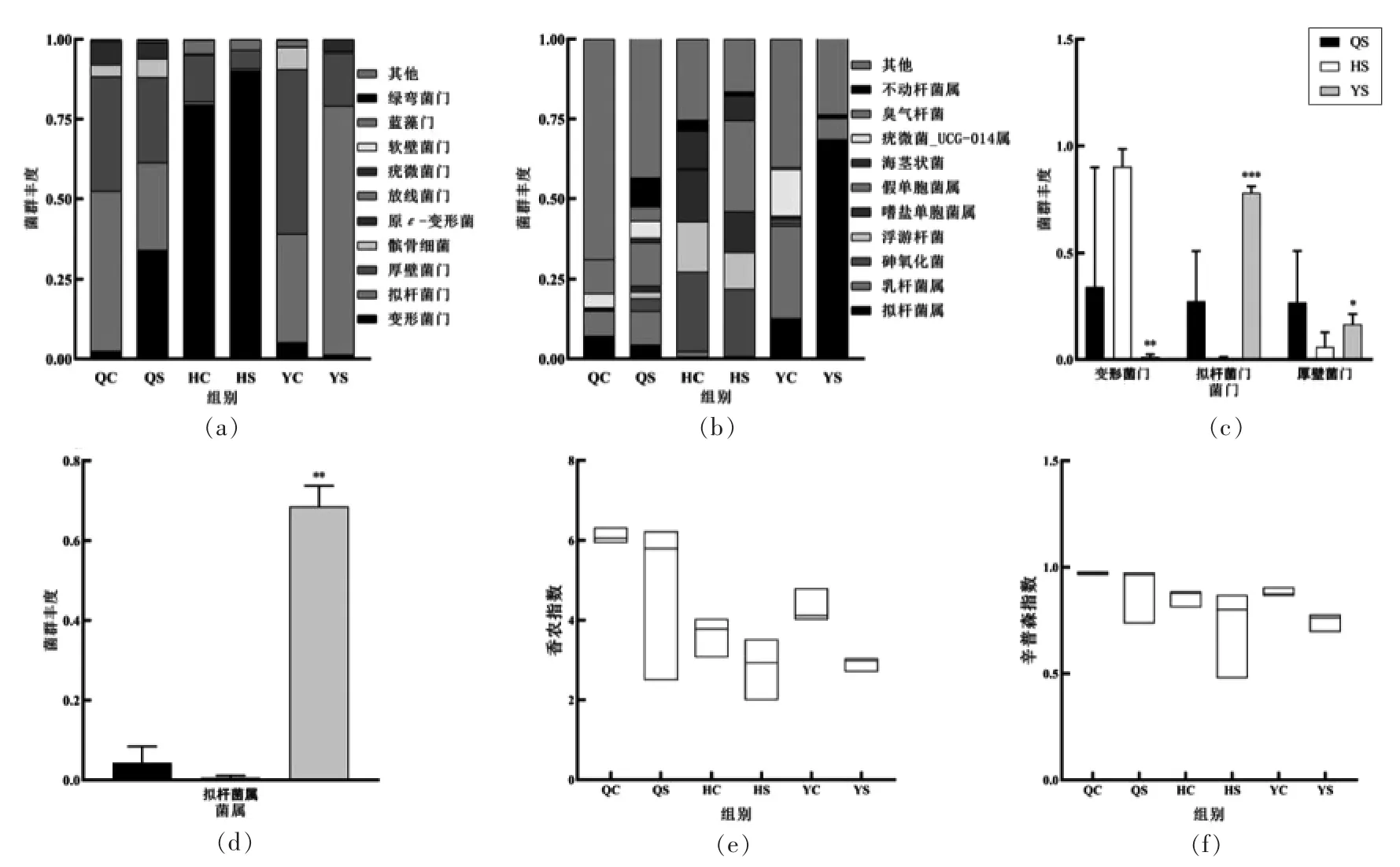
图1 小鼠肠道菌群丰度变化Fig.1 Changes of gut microbial community profiles in mice
2.2 菊粉对血脂指标的修复作用
由图2可知,与CRO 组相比,SS 干预能显著降低TG、TC 水平,并提高HDL-C 水平。因此,SS干预对肠道菌群紊乱引起的血脂异常具有修复作用。由APO-B48 测定结果可知(图2e),SS 干预能降低乳糜微粒含量,改善小鼠体内的脂质转运。
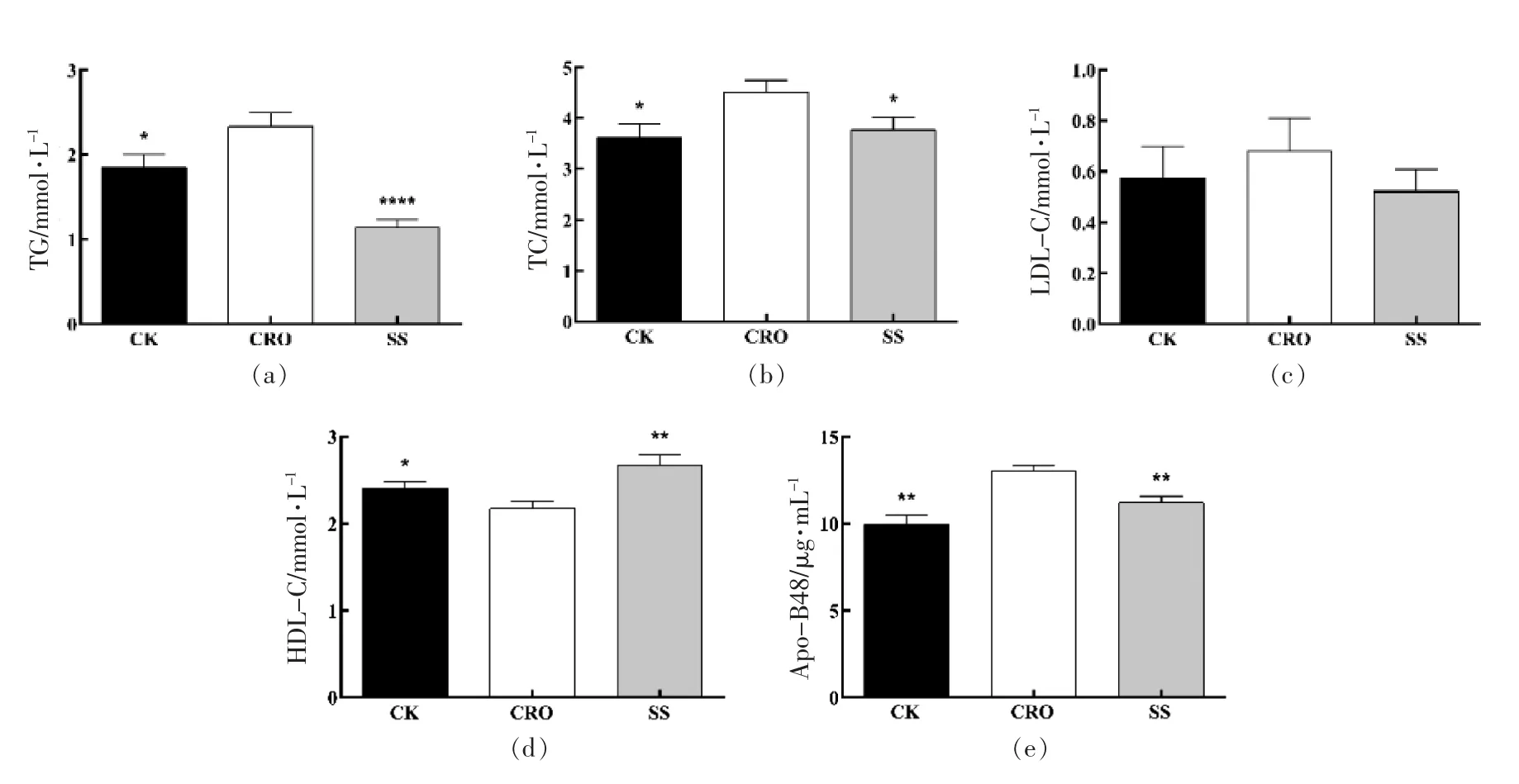
图2 膳食纤维对小鼠血脂的影响Fig.2 Effects of SS on lipids metabolism shifts in mice
2.3 菊粉对小鼠粪便中SCFAs 含量的影响
肠道菌群发生显著改变,而肠道菌群的这种变化会直接导致SCFAs 含量明显降低。从图3的结果可知,CRO 的处理会导致肠道短链脂肪酸含量显著降低,经过SS 营养干预7,14 d,丙酸、丁酸和戊酸水平的提高均快于CRO 处理后的自然组。因此,SS 干预能够促进CRO 处理后短链脂肪酸水平的恢复,可见其对肠道菌群紊乱的修复功能。
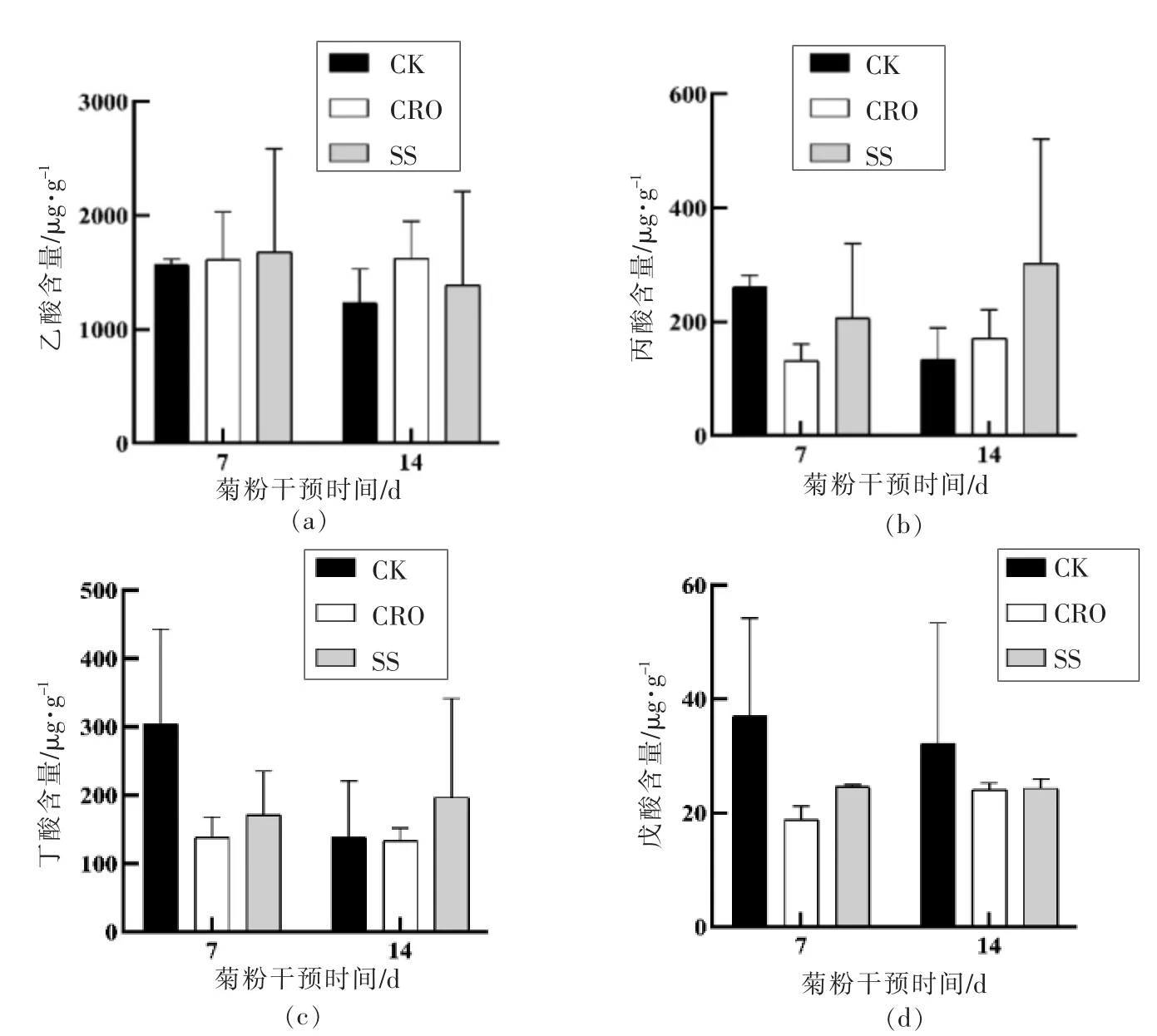
图3 膳食纤维对小鼠粪便SCFAs 的作用Fig.3 Contents of SCFAs in feces of mice
2.4 菊粉对肝脏与血清脂肪酸谱的调节作用
CRO 处理后,自然恢复组小鼠肝脏与血清脂肪酸与对照组相比仍显著不同(表1和表2),CRO的处理可导致棕榈烯酸、油酸和神经酸含量显著上升,而硬脂酸、亚油酸、二十碳五烯酸(eicosapentaenoic acid,EPA)和花生四烯酸的含量显著降低。SS 干预降低了棕榈烯酸的含量,并使它们恢复到了正常水平。同时,SS 干预提高了硬脂酸、亚油酸、花生四烯酸、EPA 和二十二碳六烯酸(docosahexaenoic acid,DHA)的含量。总体来说,SS干预能显著修复肠道菌群紊乱引起的脂肪酸谱的改变。

表1 肝脏脂肪酸谱Table 1 Contents of fatty acids in liver
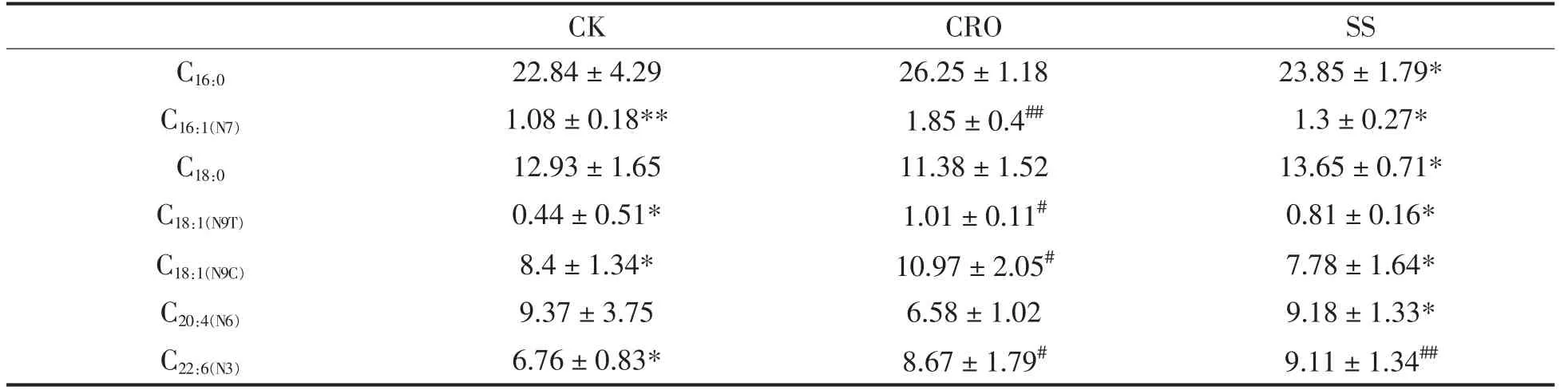
表2 血清脂肪酸谱Table 2 Contents of fatty acids in serum
2.5 菊粉对胆汁酸的调节作用
SS 干预能促进TG 和TC 修复,胆固醇是胆汁酸合成前体物质,我们推测SS 能够影响胆汁酸代谢,因此采用液质联用法测定了小鼠粪便中胆汁酸含量。由图4a 可知,CRO 处理提高了牛磺共轭胆汁酸的含量,而降低了牛磺初级胆汁酸的含量;SS 的干预促进了牛磺石胆酸含量的恢复,而对其余牛磺胆汁酸的含量则无此作用。由图4b 可知,除了甘氨熊脱氧胆酸外,其余甘氨胆汁酸含量均受到CRO 处理的影响,以甘氨胆酸的含量增加最为显著;在SS 干预下,其含量恢复到了正常水平。由图4c 可知,CRO 处理提高了胆酸和鹅脱氧胆酸含量,降低了熊脱氧胆酸、脱氧胆酸和石胆酸的含量。在SS 的干预下,胆酸得到了完全的恢复,而其它游离胆汁酸改善则不明显。总结胆汁酸的结果可知(图4d),SS 的干预主要降低了甘氨胆汁酸、游离胆汁酸和初级胆汁酸的含量,其并未完全修复CRO 引起的胆汁酸含量改变,但其能够修复甘氨胆酸和游离胆酸含量,并降低游离胆汁酸和初级胆汁酸含量。
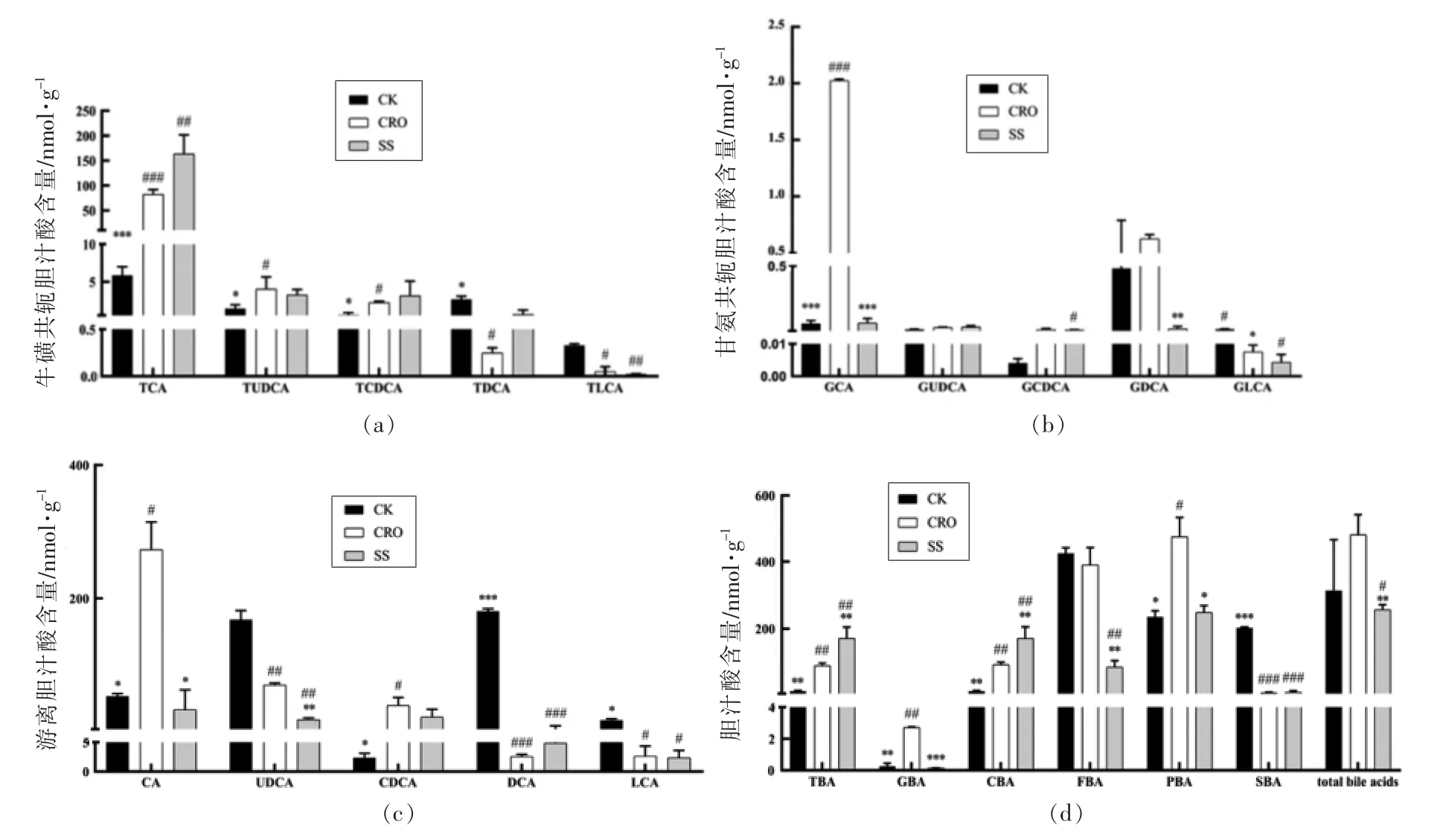
图4 膳食纤维对粪便中胆汁酸含量的影响Fig.4 Effects of dietary fiber on bile acids contents in fecal samples
3 讨论
根据肠道菌群结果可知,CRO 降低了代谢胆汁酸的菌群丰度,结合胆汁酸的结果可以发现,共轭胆汁酸和初级胆汁酸的含量明显增加,而胆汁酸谱的改变会引起FXR 信号通路发生显著改变,FXR 信号通路可以调节脂代谢过程,因此CRO 引起的脂代谢异常是通过肠道菌群诱发胆汁酸谱改变来实现的。SS 能够显著增加拟杆菌和厚壁菌门以及拟杆菌属的丰度,它们不仅能够产生BSH 水解共轭胆汁酸[17-18,25],还具有一定的代谢初级胆汁酸的能力。因此我们认为SS 能够增加特定的肠道菌群丰度,调节胆汁酸谱结构,影响了FXR 信号通路。从肝脏脂肪酸谱分析结果可知,CRO 处理引起了小鼠肝脏脂肪酸组成的显著变化,而这些变化可能是通过改变脂肪酸合成过程中的关键基因(如FAS、ACC 和SCD1 等)来实现的。结合上述结果推测,SS 改善了肠道菌群,通过胆汁酸-FXR信号通路调节胆汁酸代谢和脂肪酸代谢 (图5),最终修复了由于肠道菌群紊乱引起的脂代谢异常。
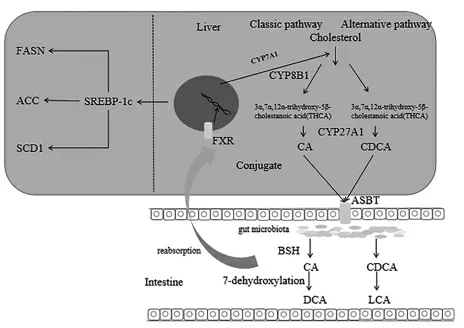
图5 膳食纤维改善肠道紊乱小鼠脂代谢的机制图Fig.5 The repair mechanism of SS on lipid metabolism shift caused by gut microbiome
