发酵豌豆蛋白肽对盐酸林可霉素诱导的小鼠肠道菌群紊乱的调节作用
2022-01-10严建刚李明亮蔡木易谷瑞增
朱 艳,魏 颖*,严建刚,李明亮,陆 路,凌 空,蔡木易,谷瑞增
(1 中国食品发酵工业研究院有限公司 北京 100015 2 完美(广东)日用品有限公司 广东中山 528403)
人体肠道微生物是一个庞大而复杂的生态系统。成年人肠道微生物多达500~1 000 种[1],数量更是达到1 000 亿。研究表明,肠道菌群数量与人体细胞数量间的比例接近于1∶1[2]。如此庞大的肠道微生物生态系统已成为与机体不可分割的重要“器官”[3]。厚壁菌门 (Firmicutes) 和拟杆菌门(Bacteroidetes) 细菌是人体肠道中主要的两大菌门,含量超过总数的90%[4]。此外,还含有少量的放线菌门和变形菌门细菌等。不同的菌群会聚集在不同的部位,形成特定的菌群结构,通过代谢产物影响机体的代谢,以维持机体内环境的稳态[5]。正常情况下,肠道菌群与机体之间形成相互依存、相互制约的共生关系,并处于动态平衡之中。当机体内、外环境稳态发生变化,原有的动态平衡就会被打破,原先的生理性菌群组合被破坏并生成病理性菌群组合,最终引起肠道菌群紊乱失调[6-7]。肠道微生态与宿主健康密切相关,涉及众多疾病的发病机制,如肥胖[8]、糖尿病[9]、高血压[10]、阿尔兹海默症等[11]。引起机体肠道菌群紊乱的因素有很多,如饮食、年龄、药物等,然而长期大量使用抗生素是导致肠道菌群失调的最常见原因[12]。WHO 调查数据显示[13],我国住院患者抗生素类药物使用率高达80%,远超国外的30%。抗生素的滥用不仅会杀灭肠道中具有屏障作用的益生菌,甚至会继发真菌感染,引起腹泻、腹痛等临床症状,严重威胁机体的健康。
发酵豌豆蛋白肽是以豌豆蛋白为原料,通过微生物发酵后得到的含有豌豆肽、豌豆蛋白以及微生物代谢产物的物质。其能够降低蛋白中抗营养因子的含量,提高营养价值[14],而且在微生物发酵过程中没有添加任何化学物质,从而形成了一个复杂而稳定的具有多元功能的微生态系统[15],具有一定的调节肠道菌群失调的潜力。本试验中利用盐酸林可霉素建立肠道菌群失调模型,通过对比添加和不添加益生菌的豌豆蛋白、豌豆肽、豌豆适度水解蛋白,探究发酵豌豆蛋白肽调节肠道菌群的效果。
1 材料与方法
1.1 材料与设备
健康雄性昆明鼠(许可证:SCXK (京)2016-0006),北京维通利华实验动物技术有限公司。
豌豆蛋白、豌豆肽、酶解豌豆蛋白粉、发酵豌豆蛋白肽、益生菌粉,北京中食海氏生物技术有限公司(SEA SON);IL-2 酶联免疫检测试剂盒、IgG酶联免疫检测试剂盒,北京百智生物科技有限公司;盐酸林可霉素,北京索莱宝生物科技有限公司。
多功能酶标仪,美国Dynex 公司;生物安全柜,新加坡艺思高科技有限公司。
1.2 试验方法
1.2.1 样品成分检测 采用常压干燥法测定样品中水分含量(GB 5009.3-2016),采用凯式定氮法检测蛋白质含量(GB 5009.5-2010),采用高温灼烧法测灰分含量(GB 5009.4-2010)。
1.2.2 肠道菌群失调模型建立于动物分组 小鼠适应性喂养1 周后,按照表1进行分组。除空白组,其余各组每天灌胃300 mg/mL 的盐酸林可霉素0.2 mL,空白组灌胃等量的生理盐水,持续3 d进行造模。建模完成后,各组小鼠每天1 次灌胃相应样品,空白组和模型组灌胃等量的生理盐水,连续14 d,最后一次灌胃后,小鼠断食不断水12 h,进行后续相关指标的检测。
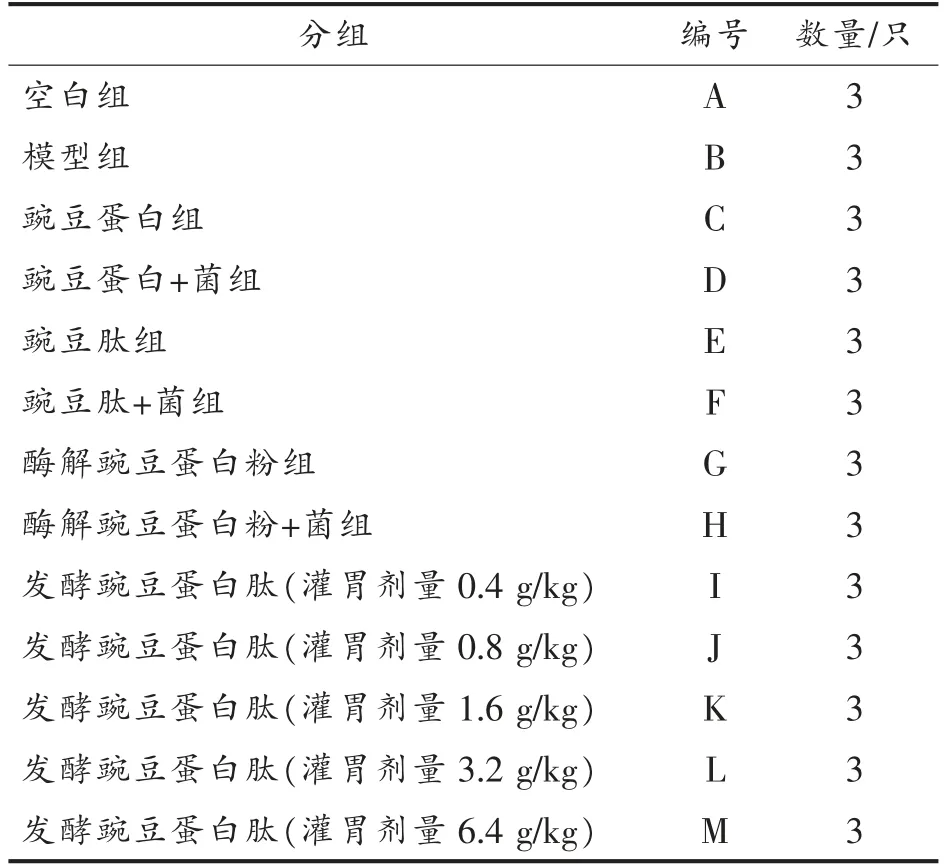
表1 小鼠分组Table 1 Groups of mice
1.2.3 基于16s rRNA 技术分析样品对小鼠肠道菌群的影响
1.2.3.1 小鼠粪便取样 小鼠于最后一次灌胃后,断食不断水12 h,无菌收集小鼠粪便,液氮速冻后于-80 ℃冰箱中保存。
1.2.3.2 16s rRNA 细菌检测 提取样本基因组DNA,并用琼脂糖凝胶电泳检测DNA 的纯度和浓度,取适量的样本DNA 于离心管中,使用无菌水稀释样本至1 ng/μL。以稀释后的基因组DNA 为模板,根据测序区域的选择,使用带Barcode 的特异引物和高效高保真酶进行PCR 并对产物进行电泳检测。使用TruSeqRDNA PCR-Free Sample Preparation Kit 建库试剂盒进行文库构建,构建好的文库经Qubit 和Q-PCR 定量,文库合格后,使用NovaSeq6000 进行测序。
1.2.3.3 生物信息学分析 根据Barcode 序列和PCR 扩增引物序列得到双端测序数据,截去Barcode 和引物序列后对每个样本进行拼接,得到原始Tags 数据(Raw Tags)。原始Tags 数据通过过滤、除去嵌合体得到有效数据(Effective Tags)。利用Uparse v7.0.1001 软件以97%的一致性对所有样本的有效数据进行可分类操作单元 (OTUs)聚类分析和物种注释。将OUT 代表序列与相应微生物数据库进行对比,得到各样本的物种分类信息和各水平注释信息。基于聚类结果进行多样性分析以及得到各分类水平的物种组成信息。
1.2.4 小鼠结肠切片病理分析 取小鼠结肠2~3 cm 新鲜组织,用生理盐水清洗结肠内容物后迅速浸泡于4%甲醛溶液中进行固定,并进行HE 染色,观察结肠病理变化。
1.3 数据处理
采用Origin8.5 统计软件对数据进行处理,试验结果以均值±标准偏差(±s)表示。采用组间t检验,P<0.05 具有显著性差异。
2 结果与分析
2.1 样品理化性质
如表2所示为各样品的基础理化性质鉴定结果,豌豆蛋白、豌豆肽、酶解豌豆蛋白粉以及发酵豌豆蛋白肽粉中蛋白质含量居于首位,分别占据84.32%,86.47%,83.95%和84.94%,4 个样品的灰分含量均在5%以下。因此,可以认为样品中发挥生物功能的主要是蛋白质类物质。
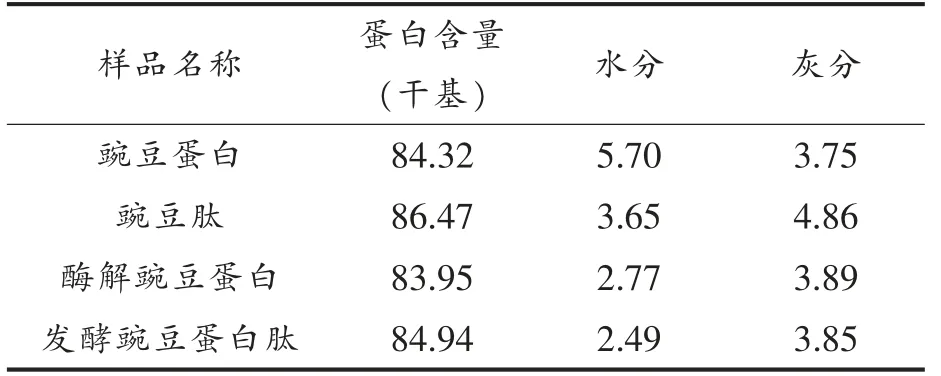
表2 样品的基础理化性质(%)Table 2 Basic physical and chemical properties of samples (%)
2.2 OUT 聚类分析
2.2.1 基于门分类水平的物种丰富度分析 通过对各样本OUT 序列进行物种注释,得到每个样本在各分类(门、纲、目、科、属、种)水平上最大丰度排名前十的物种,生成相对丰度柱形图,如图1所示为门分类水平下的相对丰度柱形图。可以看出,各组样本生成的OUT 中丰度排名前十的物种分别为:厚壁菌门 (Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、蓝藻门(Cyanobacteria)、衣原体门(Chlamydiae)、螺旋体门(Spirochaetes)、酸杆菌门 (Acidobacteria)、未鉴别的细菌门(unidentified_Bacteria)、疣微菌门(Verrucomicrobia),其 中厚壁菌门和拟杆菌门占90%左右,是肠道中的绝对优势菌[16]。B 模型组的厚壁菌门相对于空白组A增加了73.16%,拟杆菌门、变形菌门、放线菌门相比于空白组A 分别降低了70.38%,2.57%,0.2%。肠道中的厚壁菌门细菌担任着分解纤维素,产生挥发性脂肪酸,提高宿主营养利用率的责任,拟杆菌则帮助机体分解碳水化合物、蛋白质等物质[17],因此厚壁菌门与拟杆菌门的比值(F/B)常与体重呈正相关[18]。A 和B 组F/B 值分别为330 和0.37,可知,盐酸林可霉素导致厚壁菌门与拟杆菌门细菌比例改变,从而引起群落结构改变,这种改变可能会增加机体肥胖的风险。豌豆蛋白、豌豆肽、酶解豌豆蛋白粉以及发酵豌豆蛋白肽,均能降低F/B值。其中随着发酵豌豆蛋白肽浓度升高,F/B 值一直处于下降状态,以6.4 g/kg 灌胃发酵豌豆蛋白肽(M 组)的小鼠肠道菌中F/B 值最小为0.23。向未发酵的豌豆肽和酶解豌豆蛋白粉中添加益生菌相比于不添加,其F/B 值降低,而豌豆蛋白则相反。因此可见豌豆蛋白、豌豆肽、酶解豌豆蛋白粉以及发酵豌豆蛋白肽均能起到调节肠道菌群中厚壁菌门和双歧杆菌门细菌比例的作用,因此它们在帮助机体减肥方面具有较大的潜力。
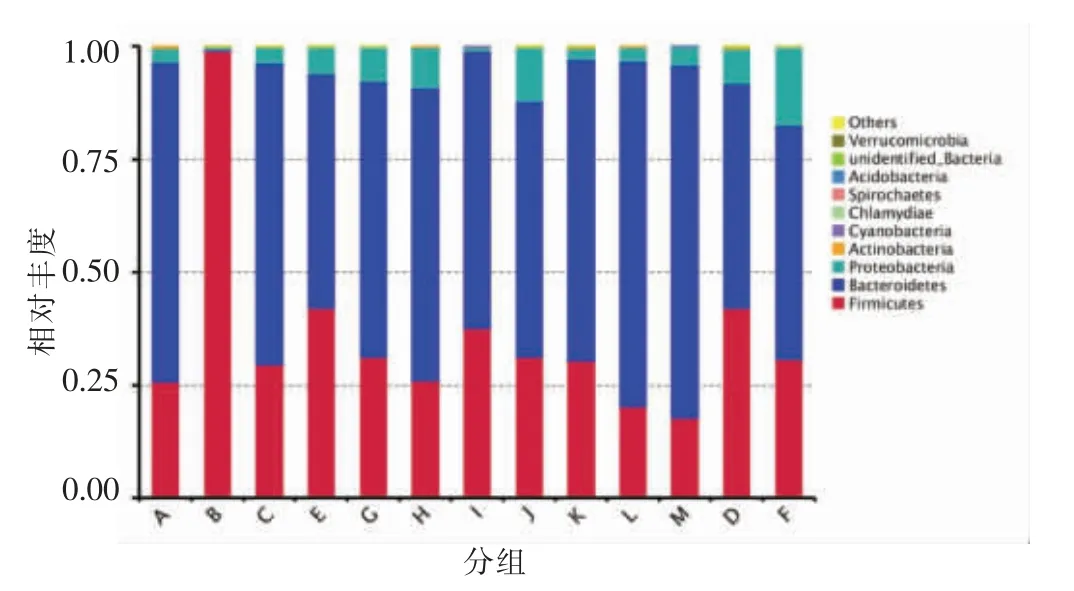
图1 小鼠肠道菌群门水平相对丰度柱形图Fig.1 Histogram of relative abundance of intestinal flora in mice at the phylum level
2.2.2 基于属分类水平的物种丰富度分析 根据所有样本在属水平上的物种注释和丰度信息,选取丰度排名前35 的属,根据其丰度信息,从样本和物种两个层面进行聚类,绘制热图,以便发现物种在样本中的聚集信息,结果如图2所示。在丰度排名前35 的属中,厚壁菌门下的属占62.86%,拟杆菌门下的属占14.29%,放线菌门下的属占5.71%,变形菌门下的属占17.14%,蓝细菌门下的属占2.86%。B 组厚壁菌门下的艰难梭菌(Clostridioides)、粪肠球菌(Enterococcus)、咸海鲜球菌属(Jeotgalicoccus)、罗姆布茨菌(Romboutsia)、葡萄球菌(Staphylococcus)、未鉴别的梭菌(unidentified_Clostridiales)相对于A 组丰度分别增加了0.23%,57.02%,0.13%,0.13%,0.01%,37.44%,丁酸弧菌属(Anaerostipes)、布劳特氏菌属(Blautia)、芽孢菌(Coprobacillus)、瘤胃梭菌属(Lachnoclostridium)、未鉴别的毛螺旋菌属(unidentified_Lachnospiraceae) 丰度分别降低了0.52%,5.04%,0.73%,8.82%,0.1%;B 组小鼠肠道中拟杆菌门下的细菌丰度均发生降低,其中拟普雷沃氏菌属(Alloprevotella)、副杆菌属(Parabacteroides)、增效丁酸蓖麻单胞菌(Butyricimonas)丰度降为0,黄杆菌丰度降低了50.98%。艰难梭菌是一种经粪-口传播的厌氧芽孢杆菌,它产生的毒素会攻击机体肠道免疫细胞,导致细胞病变,并引起腹泻和结肠炎[19];粪肠球菌可作为一类益生菌,抑制其它病原菌的生长,同时增强机体免疫力[20],但是它也是一类致病菌,粪肠球菌大量生长会引发机体尿道感染和肠道感染等疾病[21];布劳特氏菌属是醋酸盐的生产者,研究表明,肥胖儿童中布劳特氏菌属显著减少,且其特定的OUT 具有抗炎作用[22];瘤胃菌属成员能够抑制机体感染霍乱弧菌,向小鼠体内移植瘤胃菌,能够改善其生长和代谢异常,而且它在长寿者粪便中含量较高,可作为长寿信号之一[23-24]。发酵豌豆蛋白肽能够提高小鼠肠道菌群的多样性,并促进一些益生菌如布劳特氏菌、瘤胃菌、毛螺菌等的生长。B 组拟杆菌属和变形菌属细菌丰度和多样性大大降低,发酵豌豆蛋白肽使得小鼠肠道中副杆菌属、黄杆菌丰度相对于B 组分别上升了0.03%,61.25%,并增加了变形菌门下各属的丰度。
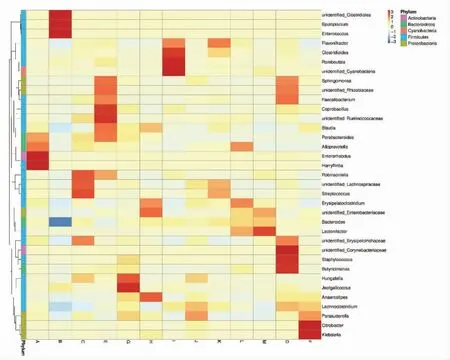
图2 小鼠肠道菌群属水平热图Fig.2 Heatmap of intestinal flora in mice at the genus level
2.3 小鼠粪便菌群α 多样性分析
2.3.1 小鼠粪便菌群稀释曲线分析 稀释曲线一方面可以反映测序数据量的合理性,同时也能间接反映出物种的丰富度[26]。如图3所示,小鼠粪便菌群的稀释曲线随着测序量的增加而趋于平缓,说明测序结果已经足以代表当前样本中所包含的多样性。在同一测序深度下,D、E、C、K、J 组丰富度相对于B 组增高,其余各组丰富度则相对于B 组降低。豌豆蛋白、豌豆蛋白+菌、发酵豌豆蛋白肽在灌胃剂量为0.4,0.8,1.6 g/kg 时,均能增加小鼠肠道菌群的丰富度,且豌豆蛋白效果更强。
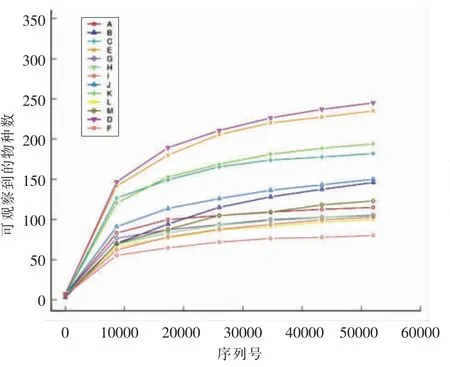
图3 小鼠肠道菌群稀释曲线Fig.3 Rarefaction curve of intestinal flora in mice
2.3.2 小鼠粪便菌群等级聚类曲线分析 等级聚类曲线是从丰富度和均匀度两方面揭示物种多样性的一种方法[26]。在水平方向上,曲线的宽度代表物种的丰富度,丰富度越高,在横轴上的跨度越大;在垂直方向上,曲线的平滑程度代表物种的均匀程度,曲线越平缓,物种分布越均匀。如图4所示,D、E、C、K 组丰富度最高,F、L、I、H 组丰富度最低。图中各样品曲线平滑度较好,整体趋势趋于平缓,仅有末端略微曲折,表明样品中物种分布较为均匀。
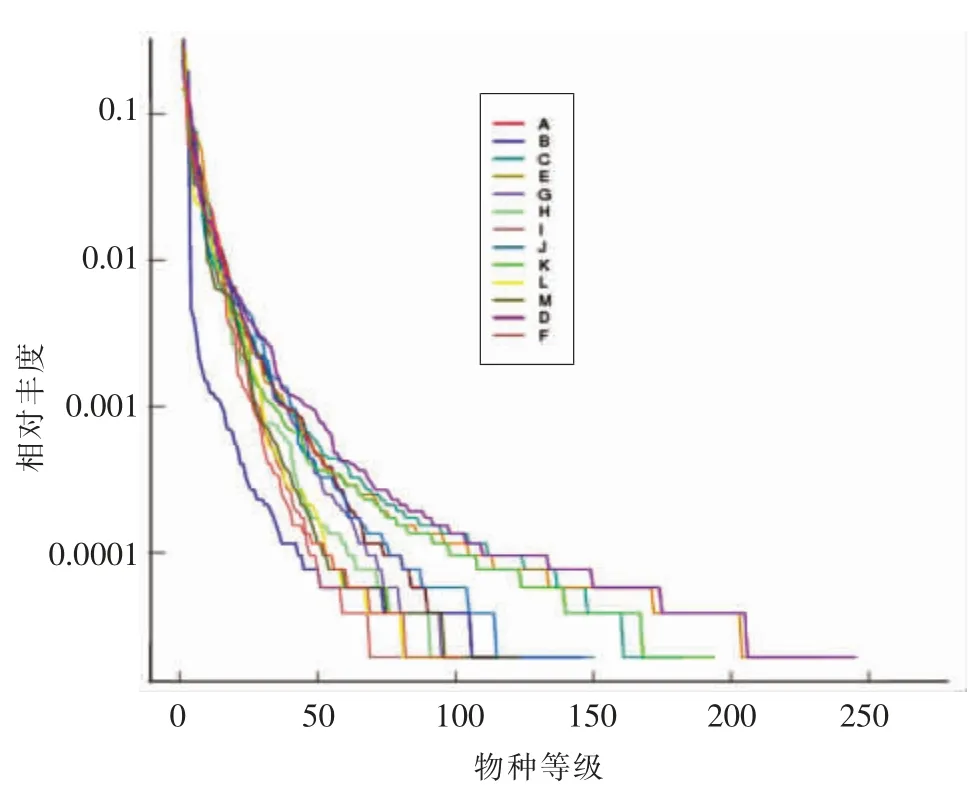
图4 小鼠肠道菌群等级聚类曲线Fig.4 Rank abundance of intestinal flora in mice
2.3.3 小鼠粪便菌群中α 多样性指数分析 α 多样性可以衡量微生物群落的多样性和丰富度,度量标准常包括ACE 指数、Chao1 指数、shannon 指数和simpson 指数,它们的大小与微生物群落构成的多样性呈正相关[27]。其中ACE 和Chao 指数大小用来反映群落的丰富度,shannon 和simpson 指数用来反应群落构成的多样性[28]。如表3所示,B组小鼠ACE 指数和Chao 指数相对于A 组显著提高(P<0.05),但是shannon 指数和simpson 指数显著降低(P<0.05),这说明抗生素的使用增加了小鼠肠道中微生物的丰富度,但却使其多样性降低,这可能与小鼠肠道中厚壁菌门细菌大量增加有关。发酵豌豆蛋白肽能够显著增加小鼠肠道中微生物群落的多样性(P<0.05),并降低物种丰富度,与空白组无显著差异,而且随着灌胃浓度升高,小鼠肠道菌群多样性和丰富度降低,剂量为1.6 g/kg时,小鼠肠道菌群丰富度和多样性均较高,与空白组无显著差异。
表3 小鼠肠道菌群α 多样性指数(n=3,±s)Table 3 The α diversity index of intestinal flora in mice (n=3,±s)
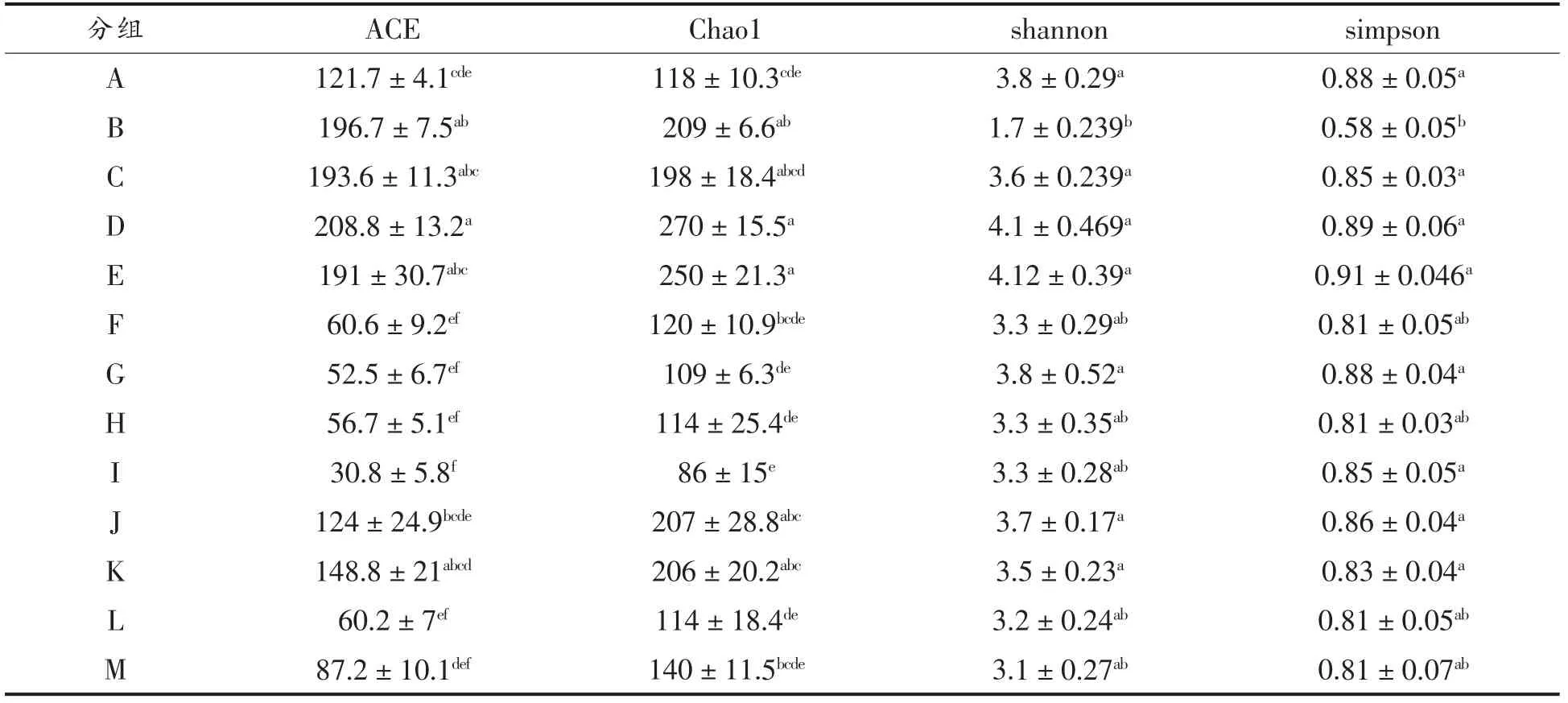
表3 小鼠肠道菌群α 多样性指数(n=3,±s)Table 3 The α diversity index of intestinal flora in mice (n=3,±s)
注:不同字母之间表示具有显著性差异,P<0.05。
分组 ACE Chao1 shannon simpson A 121.7±4.1cde 118±10.3cde 3.8±0.29a 0.88±0.05a B 196.7±7.5ab 209±6.6ab 1.7±0.239b 0.58±0.05b C 193.6±11.3abc 198±18.4abcd 3.6±0.239a 0.85±0.03a D 208.8±13.2a 270±15.5a 4.1±0.469a 0.89±0.06a E 191±30.7abc 250±21.3 120±10.9 109±6.3d 114±25.4 a 4.12±0.39a 0.91±0.046a F 60.6±9.2ef bcde 3.3±0.29ab 0.81±0.05ab G 52.5±6.7ef e 3.8±0.52a 0.88±0.04a H 56.7±5.1ef de 3.3±0.35ab 0.81±0.03ab I 30.8±5.8f 86±15e 3.3±0.28ab 0.85±0.05a J 124±24.9bcde 207±28.8abc 3.7±0.17a 0.86±0.04a K 148.8±21abcd 206±20.2abc 3.5±0.23a 0.83±0.04a L 60.2±7ef 114±18.4de 3.2±0.24ab 0.81±0.05ab M 87.2±10.1def 140±11.5bcde 3.1±0.27ab 0.81±0.07ab
2.4 小鼠粪便菌群β 多样性分析
β 多样性分析是对不同样本中微生物群落构成进行的比较分析,直观的反映出不同样本间微生物群落构成的相似性[29]。PCoA 分析(主坐标分析)是用于评估不同样本间β 多样性的方式之一。基于Unweighted Unifrac 距离的PCoA 分析主要针对于一些稀有物种,而基于Weighted Unifrac距离的PCoA 分析则对丰度较高的物种更加敏感[30]。如图5所示,在Unweighted Unifrac 分析图中,两种主成分对样本差异的贡献值分别是23.03%和27.33%,A 与H、I 组的距离较近,与其余各组的距离较远,且B 组与所有组之间均呈现比较离散的状态,这说明给小鼠灌胃盐酸林可霉素后,小鼠肠道菌群中的一些稀有物种的种类发生改变,当用豌豆蛋白、豌豆肽、酶解豌豆蛋白粉以及发酵豌豆蛋白肽进行干预后,除了A 与H 和I 组具有相似的稀有物种组成外,其余各组之间稀有物种的相似性较低。在Weighted Unifrac 分析图中,A与C、H、K、I 的距离相近,B 依然与其余各组均保持较远的距离,因此,盐酸林可霉素导致小鼠肠道中的优势菌的菌群结构发生较大程度的改变,豌豆蛋白、豌豆蛋白+菌、酶解豌豆蛋白粉+菌以及灌胃剂量为1.6 g/kg 的发酵豌豆蛋白肽的干预使得小鼠肠道中的优势菌构成向正常组靠近。
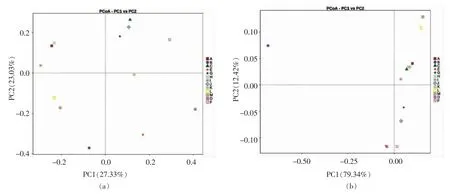
图5 基于Unweighted Unifrac 距离(a)和Weighted Unifrac 距离(b)的PCoA 分析Fig.5 PCoA analysis based on the Unweighted Unifrac distance (a) and Weighted Unifrac distance (b)
2.5 功能预测
2.5.1 功能相对丰度分析 KEGG 将代谢通路分为6 大类,分别是代谢(Metabolism)、遗传信息处理(Genetic Information Processing)、环境信息处理(Environmental Information Processing)、细胞进程(Cellular Processes)、人类疾病(Human Diseases)和生物体系统(Organismal Systems),它们的变化情况如图6所示。A 组代谢相关的基因相对丰度分别为新陈代谢(48.16%)、遗传信息处理(22.09%)、环境信息处理(12.2%)、细胞过程(6.92%)、人类疾病(2.95%)、生物体系统(2.05%),B 组新陈代谢(43.92%)、细胞过程(6.27%)、生物体系统(1.38%),这些功能所占比例相对于A 组明显降低,但是遗传信息处理(24%)、环境信息处理(15.53%)、人类疾病(3.38%)功能所占比例明显增加。
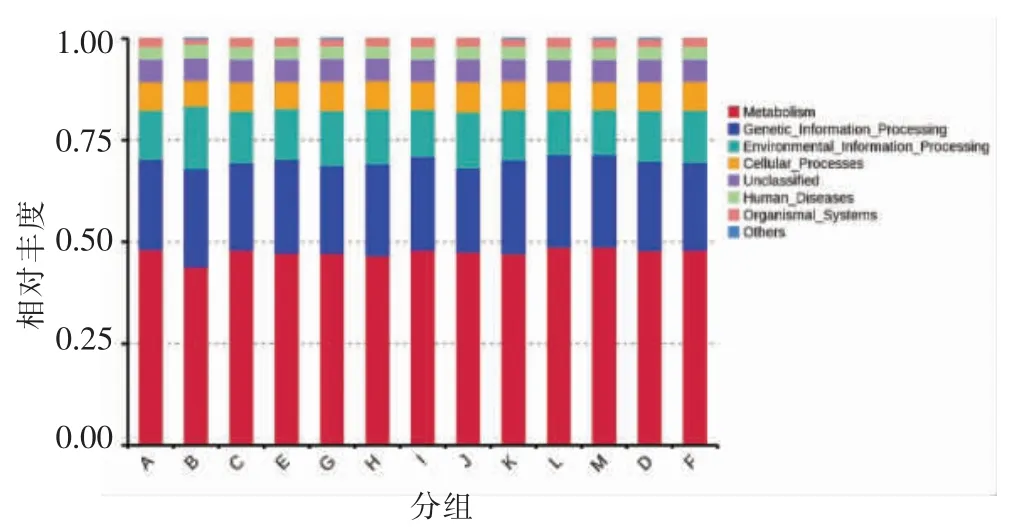
图6 Tax4Fun 功能注释相对丰度柱形图Fig.6 Tax4Fun functional annotation relative abundance histogram
每一个代谢通路又被分为多个等级,以便更详细的反映出不同处理组小鼠肠道菌群的功能差异性。如图7功能注释聚类热图所示,小鼠在连续喂食盐酸林可霉素后,相对于A 组,其肠道菌群基因组中与糖代谢(Carbohydrate metabolism)、脂代谢(Lipid metabolism)、氨基酸代谢(Amino acid metabolism)、辅因子和维生素代谢(Metabolism of cofactors and vitamins)、能量代谢(Energy metabolism)相关基因丰度降低,但是核苷酸代谢(Nucleotide metabolism)基因丰度增高,同时B 组小鼠肠道菌群表现出衰老(Aging) 和传染病(Infectious diseases) 基因丰度增高,免疫系统(Immune system)基因丰度降低,从而增加小鼠罹患疾病的概率,而且糖、脂、氨基酸和能量代谢的降低也会增加小鼠肥胖的风险,这可能跟小鼠肠道菌种厚壁菌门细菌增多,而拟杆菌门细菌数量下降相关。小鼠在喂食各组样品后,一定程度上提高了小鼠的营养物质和能量代谢水平,并降低了核苷酸代谢。核苷酸代谢异常也会引起一系列的疾病,嘌呤代谢过快产生过多的尿酸积累在体内引起高尿酸血症[31]。因此,这些基因功能的改变提示豌豆蛋白、豌豆肽、酶解豌豆蛋白粉以及发酵豌豆蛋白肽能够改善抗生素引起的肠道菌群紊乱。
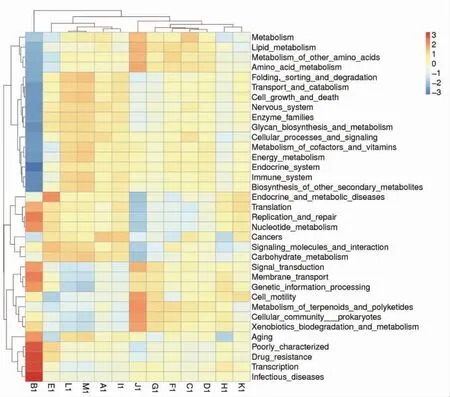
图7 Tax4Fun 功能注释聚类热图Fig.7 Tax4Fun function annotation clustering heatmap
2.5.2 功能注释PCA 分析 基于数据库的功能注释的丰度统计结果对各组样本进行PCA 分析,可以直观的反映出各组小鼠肠道菌群功能组成的相似性。如图8所示A 与B 远远分开,说明A、B两组功能组成差异较大,但是A 与除B 组以外各组分布较为集中,说明经样品处理后的各组小鼠肠道菌群的功能组成与正常组小鼠非常接近。
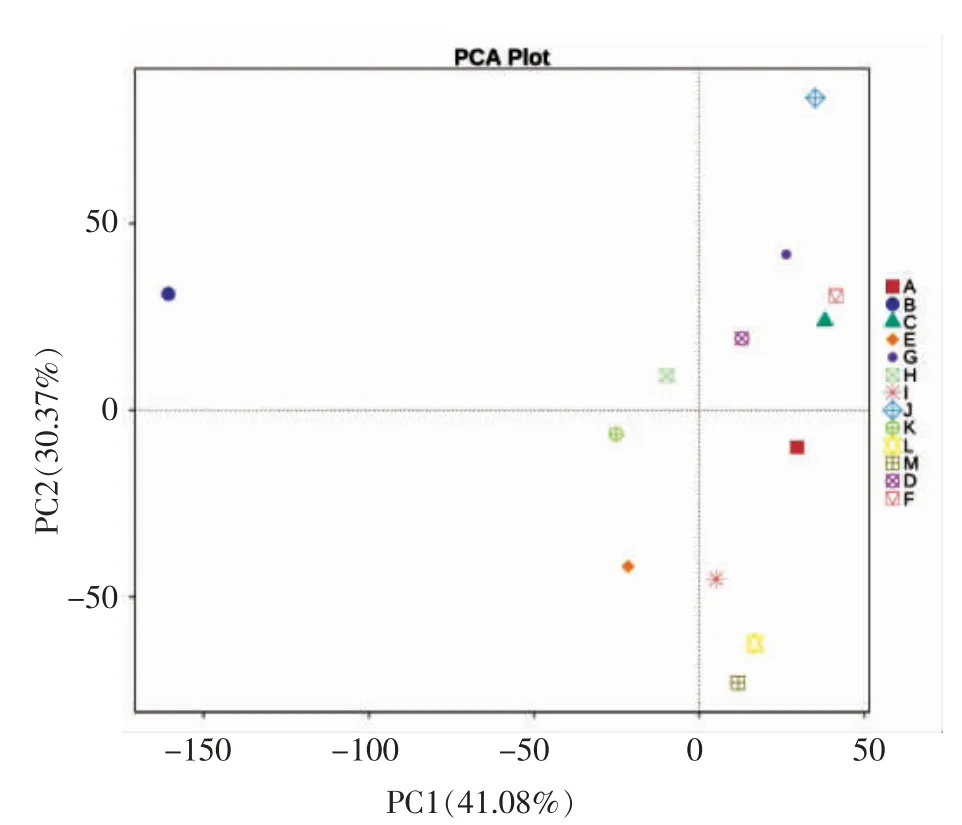
图8 Tax4Fun 功能注释PCA 结果Fig.8 PCA result of Tax4Fun function annotation
2.6 小鼠结肠HE 染色结果分析
如图9所示,A 组小鼠结肠黏膜结构完整,上皮细胞和肠绒毛排列整齐,肠腺内杯状细胞数量丰富,无淋巴细胞浸润现象,形态良好。而在B 组中,肠绒毛排列杂乱无章,边缘出现断裂,并有明显的炎性细胞浸润。部分肠腺之间发生融合,杯状细胞减少,体积增大并出现空泡。杯状细胞主要分布在黏膜上皮,主要行使分泌黏蛋白的功能,形成黏液层,为肠黏膜在受到外源病菌和肠道固有菌侵袭时提供保护屏障[32]。研究表明,在肠炎、结肠癌患者体内,杯状细胞数量显著减少[33]。小鼠食用发酵豌豆蛋白肽后,结肠黏膜受损程度得到不同程度的改善,灌胃剂量为1.6 g/kg 的小鼠结肠绒毛排列整齐,未见炎性细胞浸润,杯状细胞形态正常且数量丰富,灌胃浓度升高和降低,都会出现少量炎性细胞浸润,且浓度降低还出现黏膜下层和肌层间隙增大的现象。豌豆蛋白、豌豆肽以及酶解豌豆蛋白粉也能降低小鼠结肠黏膜受损程度,但在降低炎性细胞浸润、调节杯状细胞形态和数量方面不及灌胃剂量为1.6 g/kg 的发酵豌豆蛋白肽组。

图9 小鼠结肠HE 染色Fig.9 HE staining of the colon of mice
3 结论
本试验通过给小鼠灌胃盐酸林可霉素成功建立肠道菌群紊乱模型,小鼠菌群结构表现为菌群多样性降低,厚壁菌门细菌增多,拟杆菌门细菌数量减少。对小鼠肠道菌群功能进行预测,紊乱小鼠肠道菌总基因组中与葡萄糖代谢、脂代谢、能量代谢、氨基酸代谢、辅因子和维生素代谢相关基因丰度降低,核苷酸代谢相关基因的丰度升高,与人类疾病如衰老、传染病相关的基因丰度升高,而免疫系统基因丰度降低,可见盐酸林可霉素改变了小鼠肠道优势菌的种类和丰度,并引起小鼠代谢异常,增加患病的概率。此外对紊乱小鼠结肠进行HE 染色进行病理观察发现,菌群紊乱小鼠结肠黏膜结构也表现出一定程度的受损,炎症因子大量浸润、杯状细胞减少且出现空泡现象,严重损害了小鼠结肠的肠黏膜屏障,增加了病原菌入侵的几率。给小鼠灌胃发酵豌豆蛋白肽后,小鼠肠道菌群结构以及结肠病理变化得到不同程度的改善,其中当灌胃剂量为1.6 g/kg 时,小鼠与正常组小鼠的菌群多样性和优势物种的丰度和构成极为相近,且相比于灌胃豌豆蛋白、豌豆肽、酶解豌豆蛋白粉在添加和未添加益生菌的小鼠,灌胃剂量的1.6 g/kg 的发酵豌豆蛋白肽组的小鼠结肠黏膜结构完整,绒毛整齐,紊乱小鼠出现的杯状细胞数量减少、肠腺融合以及炎性细胞浸润现象消失,且厚壁菌门/拟杆菌门比例与空白组更为接近,肠道紊乱状态得到更好的恢复。综上所述,发酵豌豆蛋白肽具有良好的调节肠道菌群的效果,能够降低厚壁菌门与拟杆菌门细菌的比例,因此具有一定的减肥功效,并且具有增强结肠黏膜中杯状细胞的数量,巩固黏膜屏障,防止病原菌入侵的作用。
