ARTP诱变钝顶螺旋藻突变体比较组学研究
2022-01-10苏楠吴亦楠陈韵亿金丽华张翀ShimpeiAikawaTomohisaHasunumaAkihikoKondo邢新会
苏楠,吴亦楠,陈韵亿,金丽华,张翀,Shimpei Aikawa,Tomohisa Hasunuma,Akihiko Kondo,邢新会,4,5
(1清华大学化学工程系生物化工研究所,工业生物催化教育部重点实验室,合成与系统生物学中心,北京 100084;2北京电子科技职业技术学院生物技术系,北京 100029;3神户大学工程研究生院,化学科学与工程系,日本 神户 657-8501;4清华大学深圳国际研究生院生物医药与健康工程研究院,广东 深圳 518055;5深圳湾实验室医药健康技术与工程研究所,广东 深圳 518055)
引 言
微藻是一类体积小、单细胞/群体生长、可通过光合作用固定CO2的水生低等生物的总称,在全球碳循环中扮演着重要的角色。研究表明,微藻光合作用所固定CO2的量可达全球总固定量的40%[1]。随着温室效应引起的全球气候问题的日益严峻,微藻因其高光合效率、高碳水化合物含量和高油脂含量等特点,被视为新一代生物柴油、生物乙醇、生物产氢的重要光合细胞工厂[2-3]。此外,微藻还能够利用太阳能直接合成众多高附加值化合物,其大规模培养和应用有助于“碳达峰”和“碳中和”的实现,具有重要的社会及经济效益[4]。因此,微藻育种及后续生物质发酵、应用成为新的研究热点之一。
钝顶螺旋藻(Spirulina platensis)是一种多细胞纤维状微藻,常被发现于碱性湖泊中。因具有倍增速度快、蛋白含量极高(干重的65%~71%)、维生素、矿物质及色素含量丰富等特点,一直被大规模培养并应用于食品[5]、保健品[6-7]、药品[8-9]、化妆品[10-11]和饲料添加剂[4]的工业生产。近年来,因规模化培养技术成熟、碳水化合物含量高(干重的15%)且易水解等优点,钝顶螺旋藻亦被视为第三代生物乙醇发酵生产的理想原料之一[12]。为了进一步推进钝顶螺旋藻在发酵领域的应用,改造和获得具有生长速度快、碳水化合物含量丰富、抗逆性强、易絮凝收集等优势表型的微藻细胞工厂具有重要的研究和应用价值。
尽管钝顶螺旋藻培育历史悠久且在电转化方面取得较大进展[13-15],但由于胞内大量限制酶、修饰酶、插入元件、Ⅱ型内含子及成簇的间隔短回文重复序列(CRISPR)的存在,目前钝顶螺旋藻的分子改造仍受限于可用分子元件的缺失[16]。相较于其他微藻,其改造主要依赖于诱变育种策略。殷春涛等[17]利用亚硝基胍(NTG)作用于钝顶螺旋藻,筛选得到耐低温突变株;李建宏等[18]利用紫外突变,获得了富含藻蓝蛋白且菌体增长的突变株;Fang等[19]利用自主研发的常压室温等离子体(atmospheric room temperature plasma,ARTP)成功诱变钝顶螺旋藻,获得生长速率增强、碳水化合物含量增加或絮凝度增加的代表性菌株;Shirnalli等[20]利用NTG处理钝顶螺旋藻,得到蛋白含量或类胡萝卜素含量增加的突变株;Cheng等[21]利用60Co-γ射线诱变钝顶螺旋藻,得到生长速率和CO2固定速率增加的菌株;Zhu等[22]利用60Co-γ射线诱变钝顶螺旋藻,得到苯酚耐受性增强、可以利用烟道气中CO2的突变株。此外,An等[23]还结合ARTP诱变与β-紫罗酮筛选,成功诱变得到虾青素产量增加的菌株。不同的表型具有不同的工业价值,如抗低温有利于拓宽生产地域;生长速率增强有利于提高固碳效率;菌株目标代谢产物含量和絮凝度增加有利于提高生产效率和降低收集成本等。
优势突变体的产生不仅能够为工业生产提供理想菌株,同时也为胞内代谢网络及其调控机理的深入研究提供了比较素材。随着组学技术(全基因组测序、转录组学、蛋白组学、代谢组学等)与生物信息学技术的发展,近年来,在分子水平解析优势表型产生的机理得以实现,并在大肠杆菌、酿酒酵母等底盘微生物育种中起到重要的作用。然而,尽管已经获得了完整的钝顶螺旋藻基因组[24],钝顶螺旋藻突变体基因型-表型的关联分析仍然鲜有报道。除了Cheng等[25]利用转录组测序解析60Co-γ射线诱变钝顶螺旋藻突变体生长速率增强的原因外,大部分研究主要基于蛋白质组学或转录组学研究钝顶螺旋藻瞬时抗逆响应(抗盐、抗高温、抗低温、抗离子等)产生的代谢网络扰动[26-29]。因此,更多突变表型的组学分析亟待进一步挖掘。
本团队前期利用ARTP诱变得到了三株突变株[19,30]。为模拟钝顶螺旋藻室外培养条件,避免光饱和及光抑制过程,采用“12小时光照+12小时避光”的交替培养方法进行研究。本研究则采用“连续光照+短期培养(7天)”的方式进行培养,在获得实验室可控条件下的最大固碳、生长效率的基础上,研究突变体的表型变化及其产生的可能的分子机制。表型表征表明,三株突变株在强化培养的条件下,具有高絮凝表型及不同的胞内重要化合物含量。随后,通过代谢组学与比较基因组学结合的方法对所观察到表型的分子机制进行初步阐释,以期为未来钝顶螺旋藻表型理性改造提供基础。
1 材料与方法
1.1 实验菌株
钝顶螺旋藻原始菌株FACHB-904购自武汉中科院水生生物研究所淡水藻种库,突变株3-A10,3-B2,4-B3为本实验室前期利用ARTP诱变育种仪(http://www.tmaxtree.com/)诱变筛选获得[19]。在12小时光照+12小时避光的培养条件下,突变体在絮凝度、碳水化合物含量、生长速度或叶绿素含量方面与野生型有显著差异。
1.2 培养基
本研究中的野生型钝顶螺旋藻及ARTP突变菌株,均使用Zarrouk培养基进行培养[19]。
1.3 主要试剂
所有培养基的成分均为分析纯等级,硫酸为化学纯等级。碳酸氢钠、硫酸钾、七水合硫酸镁、七水合硫酸铁、乙二胺四乙酸、硼酸、氢氧化钠、二硝基水杨酸、甲醇和氯仿购自于Sigma公司以及Takara公司。碳酸钠、磷酸氢二钾、硝酸钠、氯化钠、二水合氯化钙、一水合硫酸锰、二水合钼酸钠、五水合硫酸铜、六水合氯化钴、氯化铜、氯化锌、硫酸购自北京益利精细化学品有限公司。
螺旋藻基因组提取纯化试剂盒DNeasy Plant Mini kit购自Qiagen公司。玻璃珠(acid-washed,150~212μm)购自Sigma公司。
1.4 仪器与设备
水 平 摇 床,NC350-HC plant chamber,日 本Nippon Medical and Chemical Instruments;光强测量仪,Testo540,美国Testo;紫外可见分光光度计,UV757CRT,上海精科;毛细管电泳质谱(CE/MS)系统,Agilent G7100CE/Agilent G6224AA LC/MSD time-of-flight system,美 国Agilent;HPLC/QqQ-MS系统,Agilent1200LC/Agilent6460QqQ-MS,美国Agilent;LC/酶标仪,TECAN infinite M200pro,瑞士TECAN;水浴锅;微量玻璃比色皿;研钵/匀浆器。
1.5 培养条件
在200ml三角瓶中加入100ml Zarrouk培养基,高压蒸汽灭菌(115℃,30min)。螺旋藻种子液在(30±2)℃,光强50μmol/(m2·s),100r/min条件下摇床培养5~6d。达到对数生长期后,按照细胞干重比为0.0 3g/L的比例接种至新的Zarrouk培养基中,相同条件下,连续光照培养7d。每24h进行取样,检测藻株培养相关指标。
由于螺旋藻胞内代谢产物受环境、培养条件影响显著,为保证数据准确,本研究将WT、3-A10、3-B2、4-B3置于灯箱内水平摇床上培养(附录图A1)。每批次培养均保持三个生物学平行,并严格控制放置位置,保证各瓶所接受光照强度一致(采用光强测量仪进行光强检测);同时,为避免环境光的干扰,灯箱用黑布作遮光处理。
1.6 检测方法
1.6.1 细胞浓度(细胞干重)及比生长速率的测定 使用紫外分光光度计检测钝顶螺旋藻在560nm处的光密度(OD560)[19,31],根据所测定的OD560(y)和细胞干重(dry cell weight,DCW)(x)标准曲线[式(1),附录图A2]计算钝顶螺旋藻的细胞干重(g/L)。

比生长速率[μ,g/(L·d)]由式(2)计算。
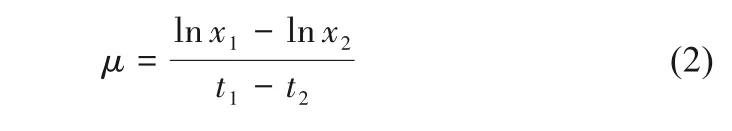
其中,x1和x2分别为t1和t2时刻的细胞干重。
1.6.2 碳水化合物含量测定 螺旋藻碳水化合物提取及含量测定采用Fang等[19]的方法:取5ml藻株培养液,13000g离心10min,用0.9% NaCl溶液清洗3次,弃掉上清液。在沉淀细胞中添加3ml HCl(6mol/L),煮腾15min。冷却后,添加相同体积的NaOH(6mol/L)进行中和并采用DNS方法检测样品处理后所得还原糖浓度(DNS溶液:NaOH16g,二硝基水杨酸1g,酒石酸钠钾300g,蒸馏水定容至1L)。用紫外分光光度计检测标准品和待测样品在波长560nm的吸光度(Abs560),根据测定的Abs560(y)和碳水化合物浓度(x)标准曲线[式(3),附录图A3]计算待测样品的碳水化合物浓度(μg)。
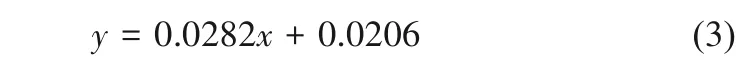
1.6.3 葡萄糖含量测定 采用Solarbio葡萄糖含量测定试剂盒进行检测。取0.1g组织(干重),加入1ml蒸馏水研磨成匀浆,置沸水浴中煮沸10min。冷却后,8000g离心10min。取20μl蒸馏水、标准品、离心所得样品上清液分别与180μl试剂盒测定混合试剂混合,并在96孔内于37℃孵育15min。之后,利用酶标仪测定波长505nm处的吸光度A1、A2和A3,根据式(4)计算葡萄糖含量(y,μmol/mg)。
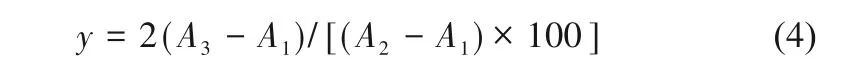
1.6.4 叶绿素含量测定 螺旋藻叶绿素提取及含量测定采用Fang等[19]的方法:取5ml藻株培养液,13000g条件下离心10min,用0.9% NaCl溶液清洗3次,弃掉上清液,在回收的沉淀细胞中添加5ml浓度为90%的甲醇,超声破碎(超声1s,间隔2s,100个循环)后萃取叶绿素。用紫外分光光度计检测样品在665nm和650nm处的吸光度,由式(5)计算待测样品的叶绿素含量(y,mg/L)。
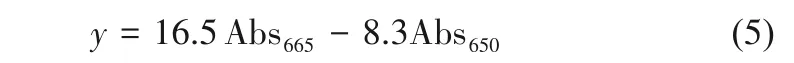
1.6.5 絮凝度测定 将分别培养1、3、5、7d的藻株,于三角瓶中静置24h,后吸取上清液,利用紫外可见分光光度计检测澄清液在560nm的吸光度(As)及混匀后的样品的吸光度(Am)。由式(6)计算得到藻株絮凝度(F)。

生长早期絮凝度检测,则选取培养24h后的藻株进行静置,分别在2、4、6、8、10、12、14和24h节点吸取上清部分,用上述方法进行吸光度检测及絮凝度计算。
1.6.6 胞内代谢产物分析样品处理 量取干重约5~10mg的藻株细胞培养液,使用10μm滤膜(Millipore)过滤,随后用4℃预冷的NaH2CO3(260nmol/L)清洗1次,离心后的藻株细胞立刻加入2ml在-30℃预冷的甲醇溶液(含有PIPES溶液)。振荡重悬。随后,取1ml藻株细胞,加入100μl4℃预冷的超纯水和300μl氯仿(含有浓度为15μmol/L反-β-阿朴-8′-胡萝卜烯醛)。在避光、4℃、1200r/min条件下混匀30min,随后4℃、14000g离心5min。取980μl上清液与440μl超纯水混合,水相与有机相分层后,4℃、14000g离心5min,平行移取两份水相溶液(450μl/份)至洁净的样品管。随后用5kDa的滤膜移除可溶蛋白组分,将水相层提取物进行冻干,-80℃存放备用,或用超纯水溶解后直接进行CE/MS和LC/QqQ-MS分析。
1.6.7 CE/MS代谢物分析 将冻干的胞内代谢产物提取物溶于20μl超纯水后利用CE/MS系统进行CE/MS分析。CE分离系统介质为融合二氧化硅的毛细管(1m×50μm i.d.),装填1mol/L甲酸(pH=1.8)或50mmol/L醋酸铵(pH=9)作为电解液进行阳离子或阴离子代谢物分析。CE电极以电解液输入端为阳极,离子化输出端作为阴极。样品注入CE系统时,选用50mbar(1bar=105Pa)、10s的条件分析阳离子或阴离子代谢物。CE系统电压设置为30kV,斜坡时间0.3min。对于阴离子代谢产物分析,使用空气泵将电解液注入毛细管,压力先设置为10mbar(进样时间为0.4 ~30min)再设置为100mbar(进样时间为30.1 ~49.5min)。鞘流液的流速设置为8μl/min。ESI-MA分析可以在阳离子或者阴离子模式进行,对应的毛细管压力设定为-3.5 kV或者3.5 kV。TOF-MS划分器、分离器以及八极性分离电压分别设定为100V、65V和750V。1.6.8 LC/QqQ-MS代谢物分析 冻干的胞内代谢产物提取物使用50μl超纯水溶解后利用LC/QqQ-MS系统配合MassHunter Workstation Data Acquisition v.B.04.01 软件进行代谢物分析。本实验使用质谱多反应监测(MRM)进行数据采集。
1.6.9 螺旋藻基因组提取及测序 取50ml培养10d的螺旋藻菌液,利用缩水滤纸减压过滤。分离出来的藻体用0.9%NaCl洗涤三次后,移到1.5ml管。加入1ml重悬溶液(0.1mol/L EDTA,0.1 5mol/L NaCl)并重悬。接着,先利用液氮快速冷冻重悬菌液30s,后放入37℃培养箱孵化至溶解。重复速冻与融化3次。离心去掉上清液,利用植物基因组提取试剂盒进行基因组提取。提取的基因组先用微量紫外分光光度计进行浓度检测。将符合测序标准的基因组样品交由上海美吉生物医药科技有限公司进行测序和后续的突变分析。
2 实验结果与讨论
2.1 藻株培养及表型分析
连续光照培养有助于强化藻株的光合作用,实现更加高效的固碳。为了探究强化光照培养下藻株的表型,本实验在实验室可控的连续光照培养下,对原始菌株及突变株的生长及重要化合物含量进行了表征。
2.1.1 比生长速率测定 在间歇光照培养(12h+12h)情况下,3-A10、3-B2、4-B3和野生型(WT)的比生长速率分别为(0.0583 ±0.016 )、(0.0786 ±0.016 )、(0.0930 ±0.025 )和(0.0842 ±0.018 )g/(L·d)[19]。3-A10远低于WT,3-B2接近于WT,4-B3则较WT有所提升。在强化光照条件下,3-A10、3-B2、4-B3和WT的比生 长 速 率 可 达(0.4349 ±0.0059 )、(0.4350 ±0.0016 )、(0.4521 ±0.0063 )以及(0.4531 ±0.0064 )g/(L·d),分别提高了6.5 倍、4.5 倍、3.9 倍和4.4 倍(图1)。强化的光照条件促进了藻株的生长,但同时弱化了各藻株之间的生长差异。

图1 野生和三株突变藻株在连续光照培养条件下的生长曲线Fig.1 Growth curves of wild-type S.platensis and the three mutants under the continuous light irradiation culture
2.1.2 絮凝度分析 在絮凝方面,间歇光照培养(12h+12h)情况下,仅3-B2相较于WT具有更好的絮凝表型[19]。然而,在本实验的强化光照培养条件下,相较于WT,尽管生长速度相似,3-A10、3-B2、4-B3均表现出了易絮凝表型[图2(a)、(b)]。在生长早期,细胞密度较低时,3-A10、3-B2、4-B3就具有较高的絮凝度,并于第3天均达到了最大值。从培养1d后的絮凝度来看,3株突变体间也有所差异,3-B2>4-B3>3-A10[图2(b)、(c)]。可以推测,絮凝度表型的差异来源于各突变体基因型的不同以及环境变化所引起的代谢网络的改变。
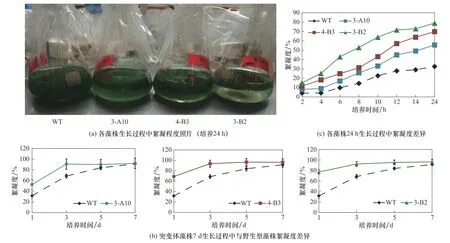
图2 突变体藻株在生长过程中的絮凝度变化:(a)各藻株摇床培养24h后,静置5min时的照片;(b)各藻株摇床7d培养过程中的絮凝度变化;(c)经24h摇床培养的藻株,静置培养不同时间后的絮凝度Fig.2 Change of flocculation over culture time.(a)Pictures of S.platensis strain cultures after24h incubation in the shaker;(b)The change of flocculation of strain cultures during7d of incubation in the shaker;(c)The change of flocculation of strain cultures(harvested after24h of incubation in the shaker)after stationary sedimentation in tubes for different time periods
2.2 藻株重要组分分析
除了上述表观的生长、絮凝度的表征,对不同藻株的重要基本组分(叶绿素含量、总碳水化合物含量、葡萄糖含量)也进行了分析。
2.2.1 叶绿素含量测定 各藻株在第1天的叶绿素含量均为最高水平且WT>3-A10>3-B2>4-B3(图3)。随着光照培养时间的延长,有所下降。WT的叶绿素含量则持续降低,3-A10与3-B2的叶绿素含量在培养过程中先降低后又部分恢复,并在第7天高于WT。突变株4-B3叶绿素含量整体变化最小,始终维持在较低水平。
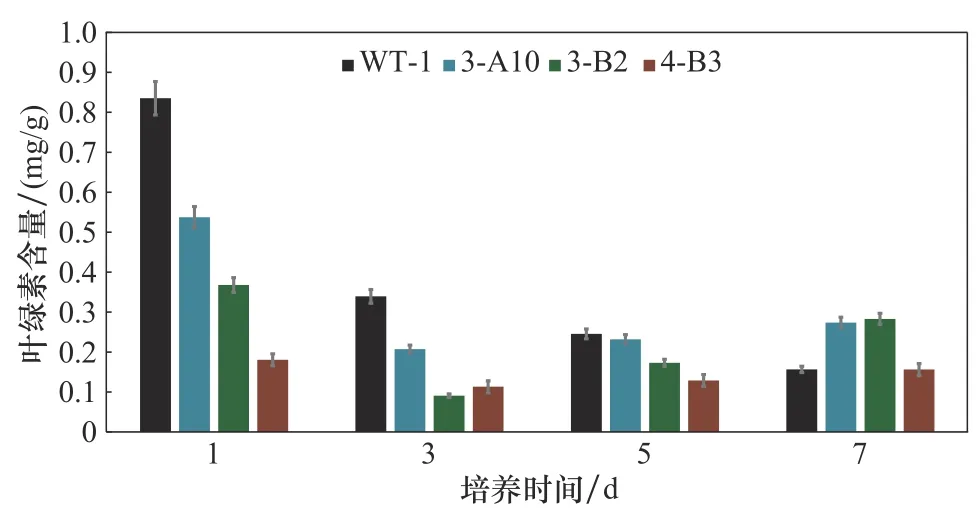
图3 各藻株在生长过程中的叶绿素含量测定Fig.3 Change of chlorophyll concentrations over time
2.2.2 碳水化合物含量测定 藻株内的碳水化合物是生产生物燃料的重要原料,因此,总碳水化合物含量也是微藻的一个重要生理指标。第1天各藻株的总碳水化合物含量都相对比较高,随着培养过程的进行,各藻株都有不同程度的下降,至第7天时各藻株总碳水化合物含量基本维持在相似水平(图4)。该结果表明在该段培养时间内,糖合成途径总体上得到了增强。突变株3-A10和4-B3与野生型的差异不明显,但3-B2在培养周期的前3天都表现出明显的高总碳水化合物含量。结合3-B2在培养前期絮凝度最高的表型,该突变株高碳水化合物有可能参与形成胞外多糖(EPS),使得细胞之间产生更为紧密的相互作用。
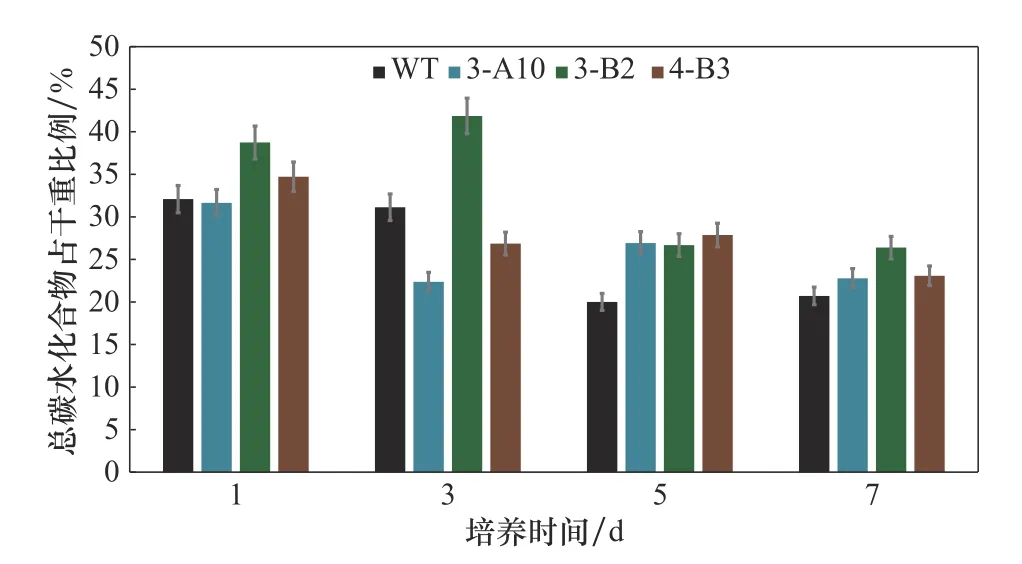
图4 各藻株在生长过程中的总碳水化合物含量测定Fig.4 Change of total carbohydrate concentrations over time
2.2.3 葡萄糖含量测定 作为原核生物中糖原合成的前体,螺旋藻在生长过程中葡萄糖含量直接决定了其糖原的合成量,本研究也对几个藻株碳水化合物中的葡萄糖的含量进行了测定(图5)。

图5 各藻株在生长过程中的葡萄糖含量测定Fig.5 Change of glucose concentrations over culture time
野生型的葡萄糖含量水平基本保持稳定,没有显著差异,相比之下,突变体的葡萄糖含量则有比较明显的变化。在生长的起始阶段,突变体的胞内葡萄糖含量为野生型的175%~225%,而突变体之间的胞内葡萄糖含量则没有特别明显的差异,这可能为后期突变体絮凝度增加所需的糖原合成奠定了基础。在第3天,突变体的胞内葡萄糖含量迅速降为和野生型基本一致的水平,而此时三个突变体的絮凝度则显著上升,可能表明细胞表面的糖蛋白合成消耗了大量的葡萄糖。在第4~7天,突变体3-A10和3-B2的葡萄糖含量保持稳定状态,对应其絮凝度也达到了平台期。突变体4-B3在这个时期内,虽然絮凝度未再有显著的提升,但其胞内葡萄糖的含量却有了大幅度的增加,表明该突变株在该时期内的葡萄糖合成途径得到了迅速的加强,其上游的中间代谢产物有可能也会有比较明显的含量变化。
2.3 藻株重要代谢中间物含量与表型关联分析
相较于WT,三株螺旋藻突变体具有明显的高絮凝表型,同时,在生长特定阶段,在叶绿素含量、碳水化合物含量以及葡萄糖含量方面也与WT具有差异。为了深入解析三个突变体在表型上的显著特点,在不同时间节点对连续光照培养过程中各藻株的16种重要胞内代谢产物进行测定(图6)。这16种代谢物分布在与螺旋藻生长发育密切相关的糖酵解途径、三羧酸循环途径(TCA cycle)、糖代谢途径以及固碳/氮途径中,包括磷酸烯醇式丙酮酸(PEP)、D-3-磷酸甘油酸(3PGA)、甘油醛-3-磷酸(GAP)、D-果糖-6-磷酸(F6P)、D-葡萄糖-1-磷酸(G1P)、D-葡萄糖-6-磷酸(G6P)、UDP-D-葡萄糖(UDP-GLC)、ADP-D-葡 萄 糖(ADP-GLC)、柠 檬 酸(CA)、α-酮 戊 二 酸(αKG)、琥 珀 酸(SUCC)、苹 果 酸(MAA)、D-景天庚酮-7-磷酸(S7P)、D-2-磷酸甘油酸(2-PGA)、乳 酸(LAC)、GDP-D-葡 萄 糖(GDPGLC)(图7)。
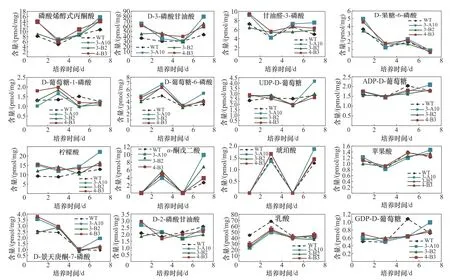
图6 各藻株胞内主要代谢产物含量测定Fig.6 Change of the concentrations of import metabolites over time
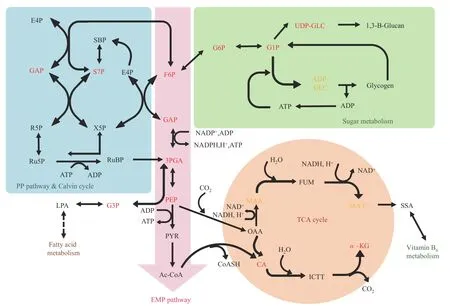
图7 测定中间代谢产物在各代谢途径中的分布Fig.7 Location of detected important metabolites in strain metabolic networks
上述16种主要代谢产物的测定中,在持续光照培养条件下,三种突变体大部分胞内代谢产物含量随时间变化趋势与WT差异不大。但可以看到,随着生长过程的进行,突变体在上述途径中处于核心位置的代谢中间产物的含量均存在明显的变化。
在糖原合成/糖酵解平衡途径中,上游处于核心位置的PEP、3PGA以及GAP,在生长初期突变体含量显著比野生型高,随着培养时间的进行,逐渐与野生型一致,在生长后期又出现高于野生型的现象(图6);F6P在培养前期的含量高于野生型,在培养中后期基本与野生型保持在同一水平,并未有突变体含量再次升高的现象。在F6P向G6P和G1P转化过程中,G6P和G1P含量变化趋势与PEP、3PGA、GAP含量变化趋势有比较明显的相反的表现,即突变体在早期(如培养1d)PEP、3PGA、GAP含量高于野生型时,G6P和G1P含量与野生型差别不大;在3~5d突变体PEP、3PGA、GAP含量接近野生型时,G6P和G1P含量则出现明显高于野生型的表现,随后再逐步趋于与野生型相似水平。这个趋势显著表明代谢流在向着糖原合成的方向进行,并且这个趋势有周期性变化的特征(即有可能随着培养时间的延长连续、顺次出现)。在进入糖代谢循环后,突变体ADP-GLC和UDP-GLC的含量与野生型差异不明显(只有突变体3-A10的ADP-GLC在培养末期有显著升高的趋势),说明糖原合成途径处于比较高效的状态,终产物糖原与葡聚糖的合成量均得到提高(本研究中总碳水化合物含量测定也证实该推论)。螺旋藻合成的糖原/葡聚糖除了供给本身的生长需求外,还能够以胞外多糖(ESP)的形式存在于细胞壁表面。推测细胞间ESP含量增加造成相互之间的互作力增强,从而可以使得螺旋藻絮凝度和沉降度都得到增强。
三羧酸循环中,突变体CA和α-KG的含量在整个培养周期内都显著高于野生型,而MAA和SUCC的含量与野生型保持一致,说明在代谢流从PEP向OAA传递后,琥珀酸合成途径并没有变化,主要是α-KG途径得到了显著加强。α-KG作为三羧酸循环中重要的代谢中间产物,是生物体内L-谷氨酸、L-谷氨酰胺、L-脯氨酸、L-精氨酸等多种氨基酸、维生素和有机酸的生物合成前体。α-KG又可在α-酮戊二酸脱氢酶的作用下进一步代谢成琥珀酰-CoA,进入碳代谢节点,在这一过程中伴随着电子传递和能量产生,该过程能够为螺旋藻的生长繁殖提供大量碳源物质和能量;此外,α-KG还可通过转氨基作用形成L-谷氨酸,进入氮代谢。因此,突变体中α-KG含量的增加,表明藻株的碳代谢和氮代谢都同时得到了加强(突变体处于N代谢途径中心位置的S7P含量在生长早期显著高于野生型)。
2.4 藻株比较基因组分析
进一步,对野生型和突变体藻株的基因组进行了提取和重测序,以期在基因组层面上探讨ARTP突变体产生表型差异的可能原因。利用已有的Arthrospira platensisNIES-39基因组,对基因序列进行Clusters of Orthologous Groups of proteins(COG)注释,预测得到编码蛋白量约3900个。与WT相比,三株突变体3-A10、3-B2和4-B3的基因组上分别存在1591、1059和1823个错译单碱基突变以及82、56和81个错译插入/缺失突变。通过Gene Ontology(GO)注释分析,对上述突变基因编码蛋白的功能进行聚类分析(表1,附录图A4~A6)。突变体分布在三大类突变基因的数量差异较大(附录表A1),与生物途径和分子功能相关基因改变的数量较多,分别达到900和660个以上,是突变体产生多种表型差异的主要原因;但相对地,发生在细胞主要组件相关基因上的突变只有100个左右,表明突变体在与生长发育相关的关键途径/网络的变化相对较小,这与之前表征所得,突变体生长速度与野生型相近的结果相吻合。
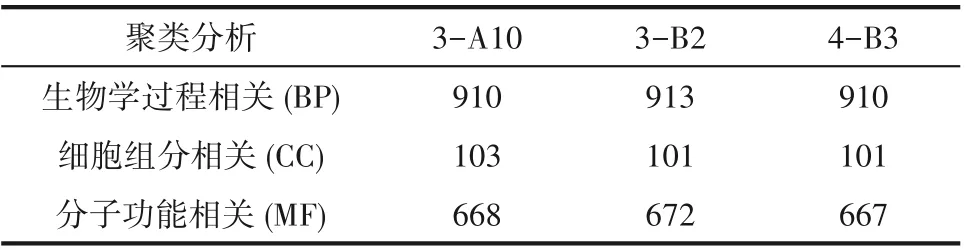
表1 突变体突变基因GO聚类分析Table1 Gene Ontology clustering analysis of mutated strains
使用KEGG数据库(https://www.kegg.jp/)中代谢网络分析功能,对突变体相对野生型有显著差异(差异性大于0.1%)的基因进行所属代谢网络的归类(附录表A2)。可以看到,显著突变基因涉及的代谢途径多达68条,表明ARTP诱变可以在系统层面上造成螺旋藻基因组的大规模突变。相比于WT,突变体在嘌呤代谢、氨基酸生物合成、叶绿素代谢、光合作用/固碳、氮元素代谢途径、糖类合成/代谢相关的途径出现了较多的突变基因。这些突变可能对突变株表型的改变起到了重要的作用。由于缺乏有效的基因改造工具,目前,对这些基因突变的功能暂时无法进行回补验证。随着新的微藻分子生物学工具的开发,这些潜在的作用位点将有助于微藻基因型-表型关联的进一步深入研究。
3 结 论
螺旋藻的诱变育种及表型解析具有重要的工业价值。本研究对本团队前期研究获得的三株螺旋藻突变株的表型,在强化培养的条件下进行了详细表征。结果表明,强化培养下,突变株与野生型菌株的生长差异较小,但均具有高絮凝表型。此外,在特定的生长阶段,突变株胞内的重要化合物含量(叶绿素、碳水化合物总量、葡萄糖)与野生型具有明显差异。进一步,通过代谢组学,测定了藻体内16种重要代谢物的含量变化情况,对突变株的表型进行了初步解析。结果表明,突变株的高絮凝表型根源于生长早期糖合成过程的强化。最后,通过全基因组测序和比较基因组学分析,得到三株突变体3-A10、3-B2和4-B3基因组上1591、1059和1823个错译单碱基突变以及82、56和81个错译插入/缺失突变。初步的功能聚类分析表明,显著突变基因涉及的代谢途径多达68条,涉及嘌呤代谢、氨基酸生物合成、叶绿素代谢、光合作用/固碳、氮元素代谢途径、糖类合成/代谢等众多重要的生理过程。随着未来螺旋藻分子工具的增加,验证和解析这些突变的具体功能将成为可能。
