miR-206-3p靶向调控S100A9对缺氧/复氧诱导的心肌细胞损伤的影响
2022-01-10单会艳俞艳华赵瑞彪
单会艳,俞艳华,赵瑞彪
心肌缺血再灌注损伤是指心肌组织缺血后恢复血流,血液的再灌注加重其结构损伤和功能障碍的病理生理过程,最终可能导致心肌梗死、纤维化、心肌肥厚和心力衰竭等多器官功能障碍[1]。因此,深入研究其发生发展机制,抑制心肌细胞凋亡,对防治心肌缺血再灌注损伤具有重要作用。研究报道,miR-206在低氧诱导的心肌细胞损伤和凋亡过程中发挥了保护心肌细胞的作用[2]。miR-206通过靶向蛋白酪氨酸磷酸酶1B(protein tyrosine phosphatase 1B,PTP1B)对急性心肌梗死诱导的心肌细胞凋亡具有保护作用[3]。miR-206还可通过靶向CC趋化因子配体2(CC motif chemokine ligand 2,CCL2)抑制癫痫发作诱发的脑损伤[4]。S100钙结合蛋白A9(S100 calcium-binding protein A9,S100A9)是S100蛋白家族成员,在小鼠脑缺血再灌注损伤模型中高表达[5]。S100A9是早期再灌注阶段上调最明显的基因,敲除S100A9使心肌细胞凋亡明显减少,并改善心脏功能[6]。S100A9还参与了儿童急性肺损伤[7]。然而miR-206-3p和S100A9对缺氧/复氧(H/R)诱导的心肌细胞损伤的影响还尚未清楚。本实验旨在研究miR-206-3p和S100A9对H/R诱导的心肌细胞损伤的影响,且miR-206-3p是否通过靶向调控S100A9表达影响H/R诱导的心肌细胞损伤。
1 材料与方法
1.1 实验材料 大鼠心肌细胞H9C2购自美国ATCC公司;胎牛血清、DMEM高糖培养基购自美国Hyclone公司;Trizol试剂、cDNA试剂盒、实时荧光定量聚合酶链式反应(RT-qPCR)试剂盒均购自日本Takara公司;BCA试剂盒购自上海羽朵生物科技有限公司;超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和丙二醛(MDA)试剂盒均购自上海沪震实业有限公司;Annexin V-FITC/PI凋亡检测试剂盒购自上海翊圣生物科技有限公司;双荧光素酶报告实验试剂盒购自上海英拜生物科技有限公司。
1.2 实验方法
1.2.1 H/R细胞模型的建立 将无血清DMEM培养基先置于含95%N2、5%CO2密闭培养箱中3 h,进行缺氧处理,将大鼠心肌细胞H9C2接种于上述培养基中继续缺氧处理3 h,然后换成含10%胎牛血清的DMEM培养基,在37 ℃含95%O2、5%CO2的培养箱中复氧处理4 h。
1.2.2 细胞分组与处理 将心肌细胞随机分为正常对照(Con)组、H/R组;H/R+miR-NC组、H/R+miR-206-3p组、H/R+si-NC组、H/R+si-S100A9组、H/R+miR-206-3p+pcDNA组、H/R+miR-206-3p+pcDNA-S100A9组。Con组细胞常规培养;H/R组构建H/R细胞模型;H/R+miR-NC组、H/R+miR-206-3p组、H/R+si-NC组、H/R+si-S100A9组将miR-NC、miR-206-3p、si-NC、si-S100A9转染至心肌细胞H9C2中后进行H/R处理;H/R+miR-206-3p+pcDNA组、H/R+miR-206-3p+pcDNA-S100A9组将miR-206-3p分别与pcDNA、pcDNA-S100A9共转染至心肌细胞H9C2中后进行H/R处理。
1.2.3 miR-206-3p和S100A9 mRNA表达水平的检测 RT-qPCR检测miR-206-3p和S100A9 mRNA的表达水平。提取细胞总RNA,合成cDNA,进行PCR,相对表达量用2-△△Ct法计算。miR-206-3p和S100A9分别以U6和GAPDH为内参,miR-206-3p正向引物序列:5′-AGCTCGATTAAGGTGGAATGTAAGGAAGT-3′,反向引物序列:5′-CTCAACTGGTGTCGTGGAGTCGG-3′;U6正向引物序列:5′-CGCTTCGGCAGCACATATACTA-3′,反向引物序列:5′-CGCTTCACGAATTTGCGTGTCA-3′;S100A9正向引物序列:5′-ACCCAGACACCCTGAACC-3′,反向引物序列:5′-AGCATGATGAACTCCTCGA-3′;GAPDH正向引物序列:5′-CTGGGACGACATGGAGAAAA-3′,反向引物序列:5′-AAGGAAGGCTGGAAGAGTGAC-3′;引物均由上海生工生物工程公司合成。
1.2.4 S100A9、B细胞淋巴瘤/白血病-2(Bcl-2)、Bcl-2相关x蛋白(Bax)蛋白表达的检测 蛋白免疫印迹(Western Blot)法检测S100A9、Bcl-2、Bax蛋白表达。提取总蛋白采用蛋白质定量试剂盒(BCA法)测定蛋白浓度。蛋白样品经聚丙烯酰胺凝胶电泳、转膜、脱脂奶粉封闭后加入一抗,4 ℃孵育过夜,加入二抗室温孵育2 h,用ECL发光液显影,用Quantity One测定蛋白条带灰度值,以目的条带和GAPDH条带灰度值比值作为蛋白相对表达水平。
1.2.5 SOD、GSH-Px活性和MDA含量的检测 应用试剂盒检测细胞SOD、GSH-Px活性和MDA含量。细胞培养48 h,收集各组细胞,按试剂盒说明书进行操作。
1.2.6 细胞凋亡的检测 流式细胞术检测细胞凋亡。各组细胞用预冷的磷酸缓冲盐溶液(PBS)漂洗2次,与500 μL的结合缓冲液混匀,加入10 μL的Annexin V-FITC、5 μL的PI,混匀后避光孵育10 min,用流式细胞仪检测细胞凋亡率。
1.2.7 miR-206-3p对S100A9的靶向调控的检测 荧光素酶报告实验检测miR-206-3p对S100A9的靶向调控。TargetScan数据库显示,miR-206-3p与S100A9存在结合位点。构建S100A9野生型和突变型荧光素酶表达载体WT-S100A9和MUT-S100A9,将其分别与miR-NC和miR-206-3p共转染至心肌细胞中,按说明书检测荧光素酶活性。将miR-NC、miR-206-3p、anti-miR-NC、anti-miR-206-3p转染至心肌细胞中检测S100A9表达水平。

2 结 果
2.1 Con组与H/R组miR-206-3p和S100A9表达比较 与Con组比较,H/R组心肌细胞中miR-206-3p表达水平明显降低,S100A9 mRNA和蛋白表达水平明显升高,差异均有统计学意义(P<0.05)。详见图1、表1。

图1 Con组与H/R组S100A9蛋白表达条带图

表1 Con组与H/R组miR-206-3p和S100A9表达比较 ()
2.2 miR-206-3p过表达对H/R诱导的心肌细胞损伤的影响 与Con组比较,H/R组心肌细胞中miR-206-3p表达水平、SOD和GSH-Px活性、Bcl-2蛋白表达水平明显降低,差异均有统计学意义(P<0.05);细胞凋亡率、Bax蛋白表达水平、MDA含量明显升高,差异均有统计学意义(P<0.05)。与H/R+miR-NC组比较,H/R+miR-206-3p组心肌细胞中miR-206-3p表达水平、SOD和GSH-Px活性、Bcl-2蛋白表达水平明显升高,差异均有统计学意义(P<0.05);细胞凋亡率、MDA含量、Bax蛋白表达水平明显降低,差异均有统计学意义(P<0.05)。详见图2、图3、表2。
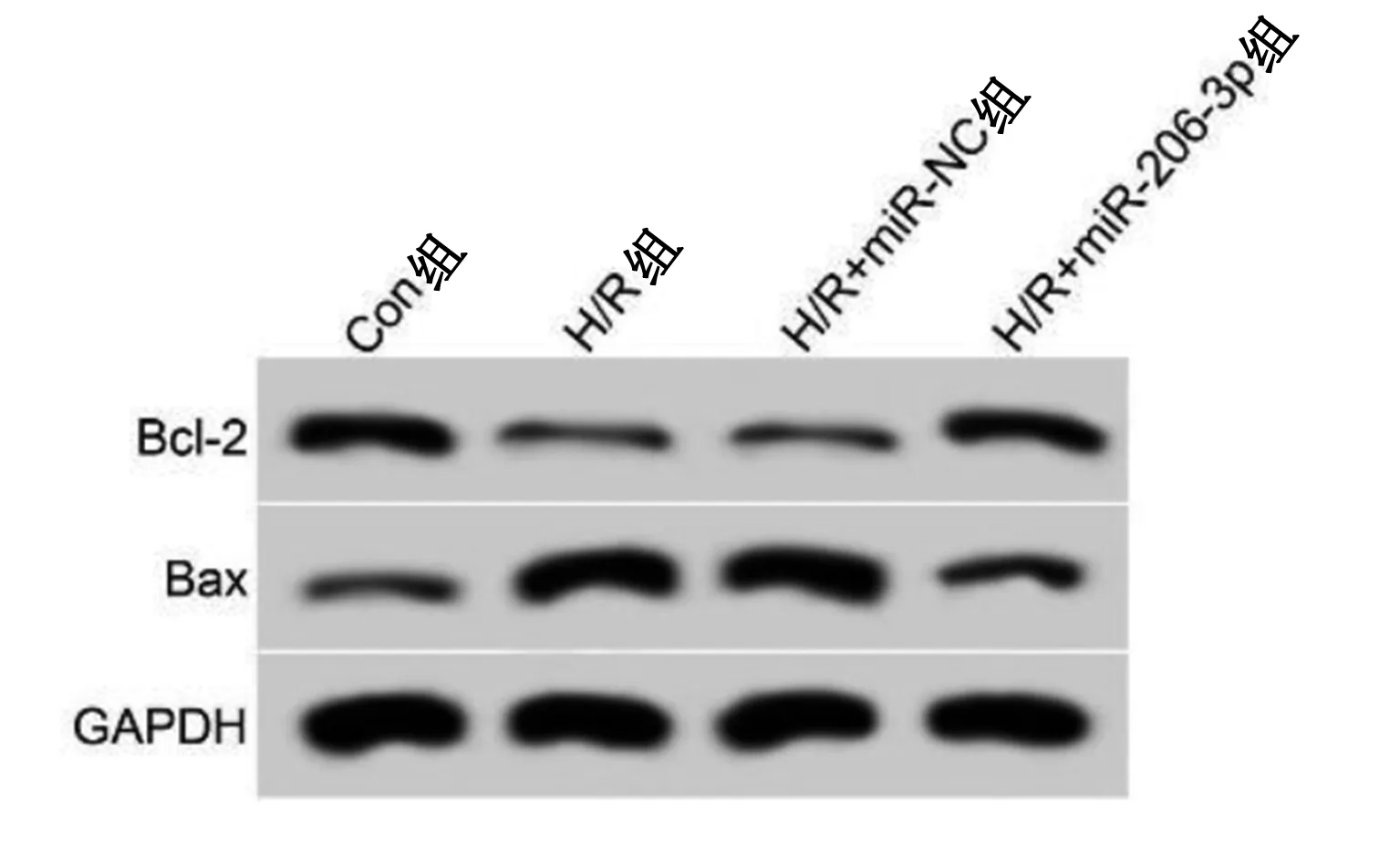
图2 4组Bcl-2、Bax凋亡相关蛋白表达条带图

图3 miR-206-3p过表达对H/R诱导的心肌细胞损伤的影响

表2 miR-206-3p过表达对H/R诱导的心肌细胞损伤的影响 ()
2.3 抑制S100A9表达对H/R诱导的心肌细胞损伤的影响 与Con组比较,H/R组心肌细胞中S100A9表达水平、MDA含量、细胞凋亡率、Bax表达水平明显升高,差异均有统计学意义(P<0.05);SOD和GSH-Px活性、Bcl-2表达水平明显降低,差异均有统计学意义(P<0.05)。与H/R+si-NC组比较,H/R+si-S100A9组心肌细胞中SOD和GSH-Px活性、Bcl-2表达水平明显升高,差异均有统计学意义(P<0.05);S100A9表达水平、MDA含量、细胞凋亡率、Bax表达水平明显降低,差异均有统计学意义(P<0.05)。详见图4、图5、表3。

图4 4组S100A9、Bcl-2、Bax蛋白表达条带图

图5 抑制S100A9表达对H/R诱导的心肌细胞损伤的影响

表3 抑制S100A9表达对H/R诱导的心肌细胞损伤的影响 ()
2.4 miR-206-3p靶向调控S100A9的表达 TargetScan预测显示,miR-206-3p与S100A9存在结合位点。荧光素酶报告实验显示,与miR-NC组比较,miR-206-3p组中转染WT-S100A9的细胞荧光素酶活性明显降低,差异有统计学意义(P<0.05);转染突MUT-S100A9的细胞荧光素酶活性比较,差异无统计学意义(P>0.05);与miR-NC组比较,miR-206-3p组S100A9表达水平降低,差异有统计学意义(P<0.05);与anti-miR-NC组比较,anti-miR-206-3p组S100A9表达水平升高,差异有统计学意义(P<0.05)。详见图6、表4、图7、表5。

图6 S100A9的3′UTR中含有与miR-206-3p互补的核苷酸序列

表4 miR-NC组、miR-206-3p组细胞荧光素酶活性比较 ()
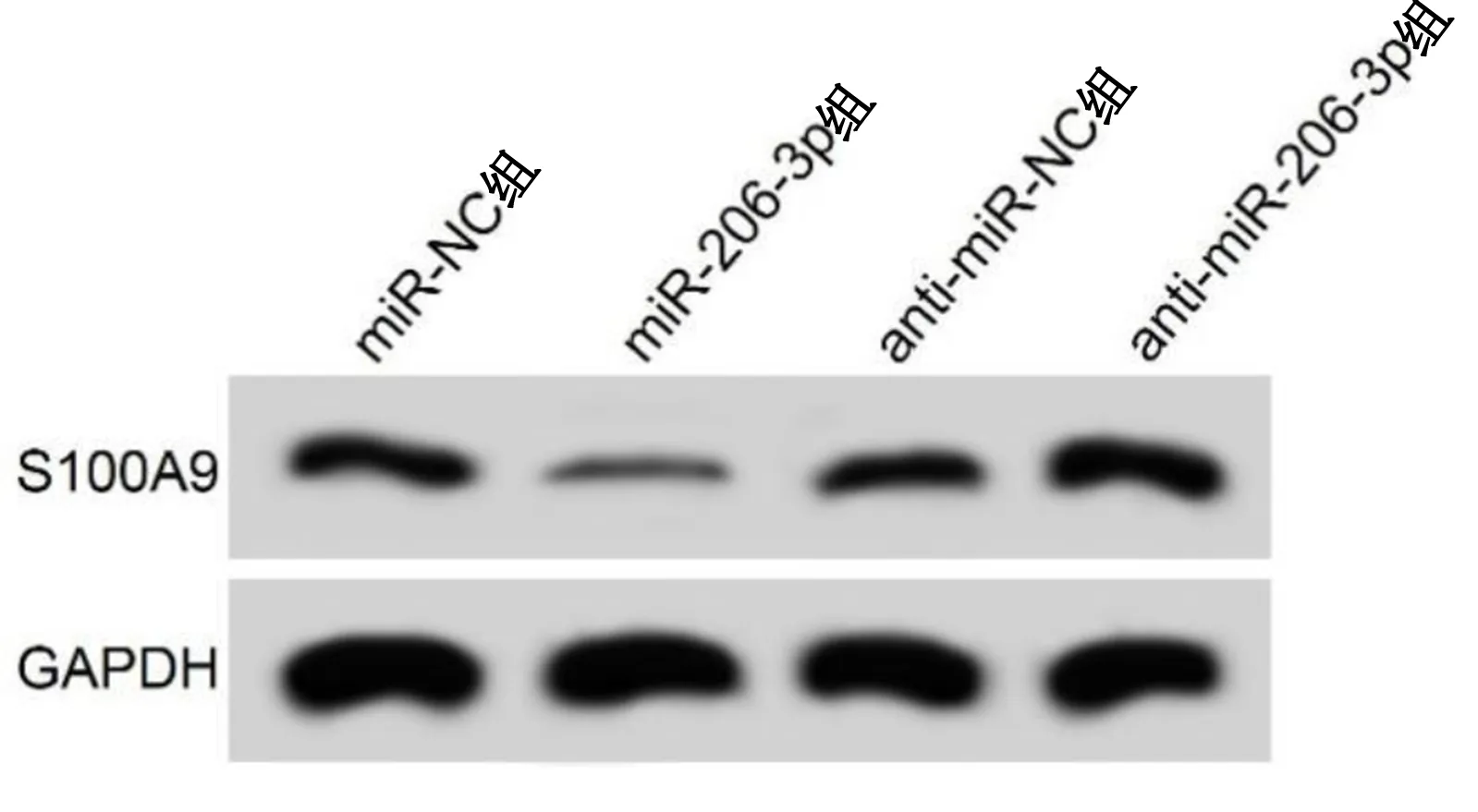
图7 4组S100A9蛋白表达条带图

表5 miR-206-3p调控S100A9蛋白的表达()
2.5 上调S100A9表达逆转了miR-206-3p过表达对H/R诱导的心肌细胞损伤的作用 与H/R+miR-NC组比较,H/R+miR-206-3p组SOD和GSH-Px活性、Bcl-2蛋白表达水平明显升高,差异均有统计学意义(P<0.05);S100A9表达水平、MDA含量、细胞凋亡率、Bax蛋白表达水平明显降低,差异均有统计学意义(P<0.05)。与H/R+miR-206-3p+pcDNA组比较,H/R+miR-206-3p+pcDNA-S100A9组心肌细胞中S100A9表达水平、MDA含量、细胞凋亡率、Bax蛋白表达水平明显升高,差异均有统计学意义(P<0.05);SOD和GSH-Px活性、Bcl-2表达水平明显降低,差异均有统计学意义(P<0.05)。详见图8、图9及表6。

图8 4组S100A9、Bcl-2、Bax蛋白表达条带图
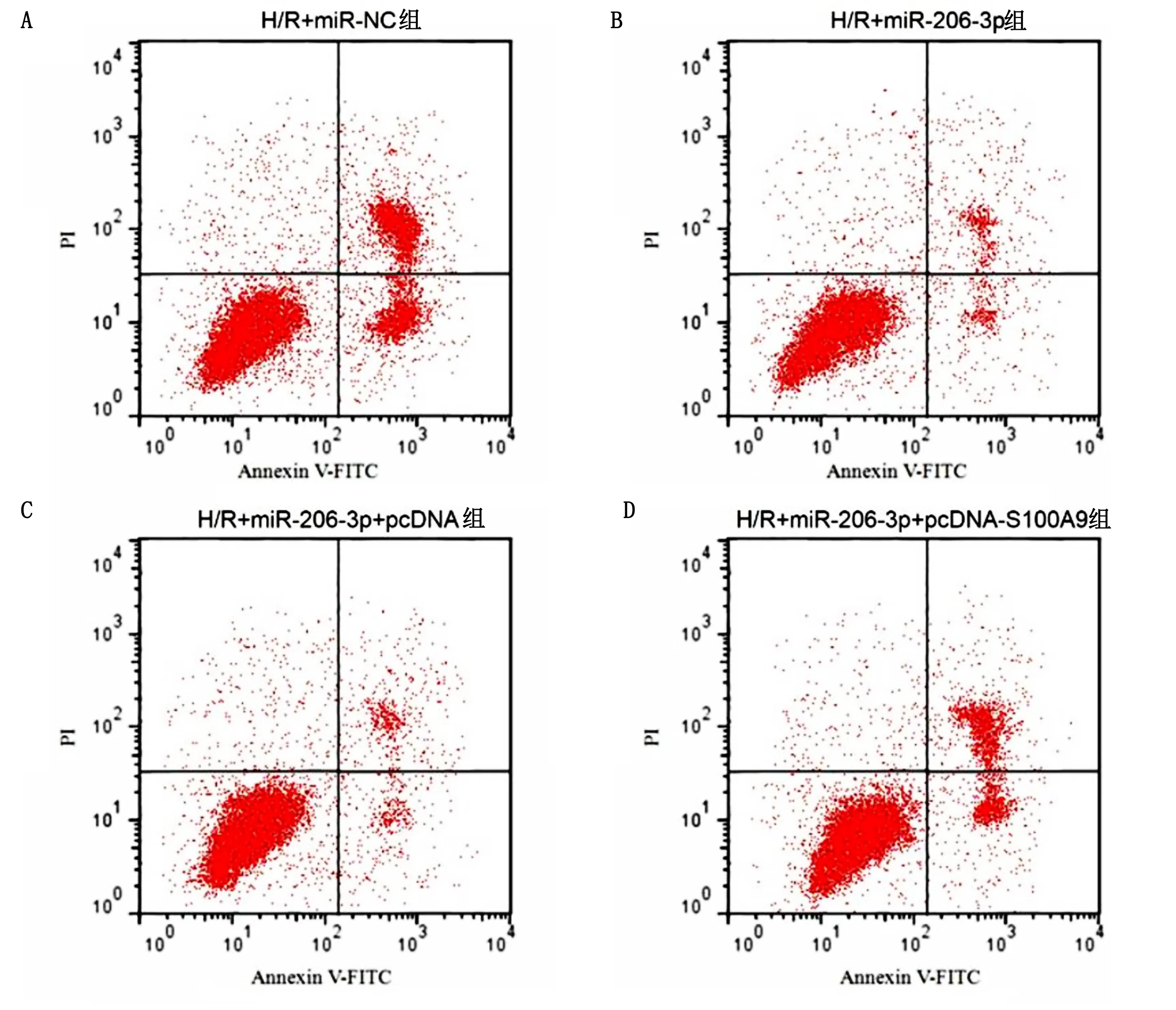
图9 上调S100A9表达逆转了miR-206-3p过表达对H/R诱导的心肌细胞凋亡的影响

表6 上调S100A9表达逆转了miR-206-3p过表达对H/R诱导的心肌细胞损伤的作用 ()
3 讨 论
心肌缺血/再灌注损伤是临床常见的病理过程,如何有效预防心肌缺血/再灌注损伤,提高病人的生存质量,是临床研究的热点[8]。研究表明,心肌缺血/再灌注损伤与氧化应激反应的发生有关[9]。本实验通过H/R诱导心肌细胞建立缺血再灌注损伤模型,结果显示,H/R诱导的心肌细胞中SOD和GSH-Px活性、Bcl-2蛋白表达水平明显降低;细胞凋亡率、Bax蛋白表达水平、MDA含量明显升高,表明本实验H/R模型建立成功。
研究表明,miRNA在心肌缺血/再灌注损伤的信号通路中发挥重要作用,可作为未来治疗心肌缺血/再灌注损伤的新型工具和诊断心血管疾病的敏感生物标记物[10]。研究报道,LncRNA RMRP过表达通过下调miR-206加剧了缺氧诱导的H9c2细胞损伤;miR-206过表达通过靶向生长停滞DNA损伤诱导基因45β(growth arrest DNA damage-inducible gene 45β,Gadd45β)可明显减少梗死面积并抑制缺血再灌注损伤诱导的心肌细胞凋亡;LncRNA UCA1使miR-206海绵化,从而加剧了氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)在人类巨噬细胞中诱导的氧化应激和细胞凋亡[11-13]。
本实验结果显示,H/R诱导的心肌细胞中miR-206-3p低表达;过表达miR-206-3p后H/R诱导的心肌细胞中MDA含量明显降低,SOD、GSH-Px活性明显升高,细胞凋亡率明显降低,Bcl-2蛋白表达水平明显升高,Bax蛋白表达水平明显降低。表明过表达miR-206-3p可抑制H/R诱导的心肌细胞凋亡和氧化应激的产生。为进一步研究miR-206-3p影响H/R诱导的心肌细胞损伤的机制,本实验通过TargetScan预测其靶基因,结果显示,miR-206-3p与S100A9存在结合位点,双荧光素酶报告实验证实miR-206-3p可靶向调控S100A9。且本实验结果表明,H/R诱导的心肌细胞中S100A9高表达,表明S100A9可能参与H/R诱导的心肌细胞损伤。研究报道,柯萨奇病毒B3引起的心肌炎病人中S100A9高表达,加重了心肌炎;S100A9基因敲除小鼠可改善左心室功能,减少心脏炎症和氧化反应[14]。外伤性脑损伤诱发了促炎性和淀粉样蛋白S100A9的产生,S100A9是脑损伤的重要标志[15]。血浆S100A8/A9异二聚体是心脏手术相关的急性肾损伤的早期预后标志物[16]。因此,本实验为研究S100A9是否影响H/R诱导的心肌细胞损伤,转染S100A9抑制表达载体,结果显示,MDA含量明显降低,SOD、GSH-Px活性明显升高,细胞凋亡率明显降低,Bcl-2蛋白表达水平明显升高,Bax蛋白表达水平明显降低。说明抑制S100A9表达可抑制H/R诱导的心肌细胞凋亡和氧化应激的产生。且上调S100A9表达逆转了miR-206-3p过表达对H/R诱导的心肌细胞损伤的保护作用。提示miR-206-3p可能通过调控S100A9影响H/R诱导的心肌细胞损伤。
综上所述,过表达miR-206-3p通过靶向下调S100A9可抑制H/R诱导的心肌细胞凋亡和氧化应激,miR-206-3p对H/R诱导的心肌细胞损伤具有保护作用。
