水杨酸和赤霉素预处理对NaCl胁迫下神香草种子萌发的影响
2022-01-08吕亚茹苏文欣姜宛彤刘宇乐严俊鑫
王 菲, 谭 怡, 吕亚茹, 苏文欣, 姜宛彤, 刘宇乐, 严俊鑫
(东北林业大学园林学院, 黑龙江 哈尔滨 150040)
施用植物激素和微量元素等对种子进行播前预处理是一项可有效提高种子活力的种子引发技术[1-2]。水杨酸(Salicylic acid,SA)和赤霉素(Gibberellin,GA)可参与调控植物种子萌发、根的生长、茎秆伸长、开花诱导和果实成熟等植物发育过程[3-4],对植物产量、品质和抗逆性的提高有重要的促进作用。SA即邻羟基苯甲酸,是一类酚酸物质,作为植物体内普遍存在的内源信号分子可与其他激素互相影响,诱导逆境相关抗性基因表达,激活系统抗性,从而提高植物对生物和非生物胁迫的耐受性[5];同时它能通过调节植物对各类营养元素的合理吸收和利用来维持植物体内的离子动态平衡[6];另外,它还能缓解逆境胁迫对植物造成的膜质过氧化损伤,提高植物叶片的光合生产能力[7]。GA属于双萜类物质,它能促进细胞分裂和细胞伸长,加速叶芽生长,影响植物淀粉酶等代谢酶的活性,有效打破种子休眠[8];它可通过腐蚀种皮蜡质层提高种皮透水和透气性,增强种子呼吸速率,从而促进种子萌发[9];并且它能诱导植物酶蛋白合成相关基因的表达,控制各种内源生长调节剂的分泌来提高种子活力,从而提高植物抵御胁迫的能力[10]。近年来,国内外施用SA、GA提高盐胁迫条件下植物种子萌发和幼苗生长质量的研究较多,如王启超等[11]对水杨酸缓解穿心莲盐胁迫的机制研究、朱秀红[12]对三种泡桐、Shahzad K等[13]对玉米的研究,均指出适宜浓度的SA、GA能缓解盐胁迫对植物造成的胁迫伤害,对种子萌发有一定促进效果。
土壤盐渍化是由于土壤底层或地下水中的盐在水分蒸发后不断在地表积累造成的[14]。目前,全球盐渍化土地面积已上升到9.54亿公顷,而我国盐渍化土壤面积达660.87万公顷,主要分布在沿海、黄淮海平原、东北松嫩平原、西北半沙漠和青新极端干旱沙漠五大地区[15],有不断恶化的趋势,严重阻碍了农业发展和生态恢复进程。根据盐的种类和性质,盐渍土可分为盐土、碱土和过渡类型[16],以NaCl等中性可溶性盐为主的盐土,一般土壤透气性差,肥力低[17],盐离子浓度高,一定程度上对植物种子的萌发期和幼苗期构成威胁。种子萌发是植物生长发育的起始点,也是最易感知到盐胁迫危害,影响其后续生长的重要阶段。研究表明,盐胁迫下高浓度的Na+会降低种子活力,减弱种子胚轴和子叶的氮代谢活动,使种子进入强迫性休眠;同时,在盐胁迫下,土壤水势下降导致植物根系吸水困难,植物体内水分亏缺甚至脱水,植物根系难以汲取营养物质,植物生长缓慢,植株体内Na+积累产生离子毒害,植物细胞内产生氧化胁迫,质膜损伤,渗透失衡,生理代谢紊乱[18-20]。
神香草(Hyssopusofficinalis)又名牛膝草,是一种唇形科(Lamiaceae)多年生草本。该植株地上部含有丰富的黄酮、挥发油、有机酸等化学成分[21],在药用、芳香疗愈、精油提取方面[22]都有较高价值。因其具有耐干旱、抗寒等特点,在我国园林绿化中应用前景广阔。但在其栽植过程中易遭受盐碱胁迫、水分缺乏等危害,对其栽培及精油产量造成极大威胁[23]。目前,人们对神香草的研究多集中于栽培育苗、精油提取及应用[22,23]。两种激素浸种处理对神香草种子的耐盐能力的影响尚不清楚。因而,本试验研究不同浓度SA和GA浸种对盐胁迫下神香草种子萌发和生长的影响,以探究两种激素对神香草耐盐性的诱导作用,为解决盐渍化地区园林植物栽培过程中的盐害问题提供理论参考。
1 材料与方法
1.1 材料
神香草种子,2020年购自北京花儿朵朵花仙子农业有限公司。净种后千粒重为1.04 g,含水量为0.31%,纯净度为97.37%,发芽率为70%左右。
1.2 方法
1.2.1种子前期处理 选取饱满、大小一致的神香草种子,用1%次氯酸钠溶液浸泡消毒10 min,蒸馏水冲洗5遍。使用浓度为0.2,0.4,0.6,0.8 mmol·L-1的SA溶液以及0.3,0.6,0.9,1.2 mmol·L-1的GA溶液浸种,分别记为SA0.2,SA0.4,SA0.6,SA0.8以及GA0.3,GA0.6,GA0.9,GA1.2,对照组用蒸馏水浸泡,记为SA0和GA0。24 h[24-26]后用蒸馏水冲洗3遍,用吸水纸吸干表面水分,备用。
根据前期预实验,设置0,50,100,150,200 mmol·L-15个NaCl浓度梯度,记为T0,T50,T100,T150和T200。本实验进行激素浸种和NaCl胁迫双因素不同水平完全组合设计,前期浸种SA和GA分别设置5个浓度梯度(包含对照),后期NaCl胁迫设置5个浓度,共计50个处理,每个处理3个重复。
1.2.2盐处理 采用培养皿纸上发芽法,将浸泡风干后的种子置于直径9 cm铺有双层滤纸的培养皿中,每个培养皿均匀放入50粒种子,向培养皿中加入5 mL不同浓度的盐溶液。将培养皿置于黑暗培养箱中培养,模拟种子发芽前土壤中的黑暗条件。保持温度25℃、湿度75%的环境条件,通过称重法[27]每天16:00向培养皿内补充蒸馏水到初始重量,以保持处理液浓度不变。每隔24 h观察统计神香草种子发芽指标,参照《GB/T 2930.4-2017草种子检验规程》[28]计算发芽率,第4天统计发芽势(胚根伸出种子长度的1/2为发芽标准),试验周期为10 d。
1.2.3相关指标测定
1.2.3.1 萌发指标测定
不同GA和SA浓度预处理24 h后,用计数法每天记录不同浓度盐胁迫下的种子萌发数量,持续计数10天后计算种子的发芽率、发芽势、发芽指数和活力指数,计算公式如下:
发芽率(Gr)=(萌发种子数/供试种子数)×100%;
发芽势(Ge)=(第4天种子发芽数/供试种子数)×100%;
发芽指数(Gi)=∑Gt/Dt;Gt为第t天的发芽数,Dt为相应的发芽试验天数;
活力指数(Vi)=S×Gi,S为幼苗的生长势,用根长表示[29]。
1.2.3.2 生长指标测定
胚芽、胚根长度测定:用游标卡尺测量幼苗的胚芽和胚根长度,每个处理随机取10株幼苗(幼苗少于10株的处理,取所有的幼苗),每组3次重复。
鲜重测定:试验进行至第10 d时取神香草整株幼苗,每个处理随机取10株(幼苗少于10株的处理,取所有的幼苗),用滤纸擦干其表面水分后,称其鲜重,每组3次重复[30]。
1.2.4模糊数学隶属函数法 对盐胁迫下神香草种子萌发和幼苗生长指标进行综合评价[31],计算发芽期和出苗期7项指标的隶属函数值,将其平均值作为最终评价指标。计算公式为:
μ(Xj)=(Xj-Xmin)/(Xmax-Xmin)
式中:μ(Xj)代表第j个指标的隶属函数值;Xj代表第j个指标值;Xmin代表第j个指标的最小值;Xmax代表第j个指标的最大值。
1.2.5数据处理 采用Excel 2016录入数据,SPSS 22.0统计软件对数据进行方差分析,Duncan进行多重比较,显著性水平为P<0.05。所有实验数据均以平均值±标准差表示。
2 结果与分析
2.1 不同浓度SA对盐胁迫下神香草种子萌发的影响
如图1所示,在无盐胁迫(T0条件)下,不同浓度SA处理后种子的发芽特性均高于对照处理,除SA0.8处理效果不明显外,其他浓度均有显著效果。随NaCl浓度增大,神香草种子发芽率、发芽势、发芽指数、活力指数呈下降趋势,这说明神香草种子萌发特性明显受到抑制。就发芽率而言,如图1A所示,不同浓度NaCl处理下,SA0.2与SA0.4处理后提升效果均显著(P<0.05),在T50条件下,相比对照分别显著增加19.99%,9.57%,但在T100和T200条件下,SA0.6与SA0.8相比对照无明显变化。如图1B所示,不同浓度SA处理均能提高盐胁迫下种子发芽势,在T50条件下,SA0.2能最大程度地提升发芽势,而在T50~T200条件下,SA0.8提升效果始终不显著。在图1C中,不同浓度SA处理后,种子发芽指数均有不同程度的提升,且随SA浓度增加缓解效果逐渐下降。对于种子的发芽指数和活力指数(图1C、图1D),SA在T150和T200条件下提升效果均较弱。
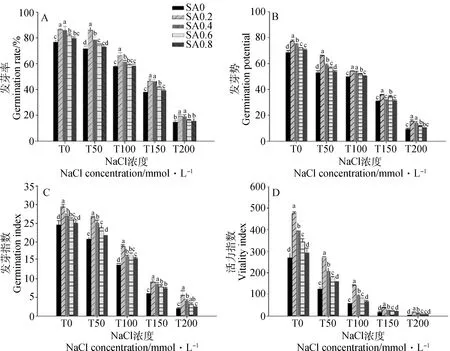
图1 不同浓度SA对盐胁迫下神香草种子发芽率(A)、发芽势(B)、发芽指数(C)、活力指数(D)的影响
2.2 不同浓度SA对盐胁迫下神香草胚芽长、胚根长、鲜重的影响
如图2所示,不同浓度NaCl条件下,SA0.2均能显著提升幼苗胚芽长、胚根长和鲜重,在T100条件下,对种子胚芽的提升效果最好,相比对照显著增加了53.01%(P<0.05);在T50条件下,SA0.2处理使神香草胚根长、鲜重显著增加了69.28%,44.48%(P<0.05)。如图2A所示,就胚芽长而言,T0~T100条件下,以SA0.2和SA0.4处理效果较好,而在T200条件下,SA0.6,SA0.8提升效果不显著。如图2B所示,T150条件下,SA0.4~SA0.8处理后胚根长相比对照差异不显著。如图2C所示,T200条件下,SA0.4,SA0.6,SA0.8对神香草幼苗鲜重的提升效果不显著,而在T50,T100条件下提升效果较显著,T50条件下分别提升了30.77%,18.39%,16.32%。另外,本试验发现无盐胁迫(T0)条件下,SA0.4~SA0.8对种子鲜重无显著影响。
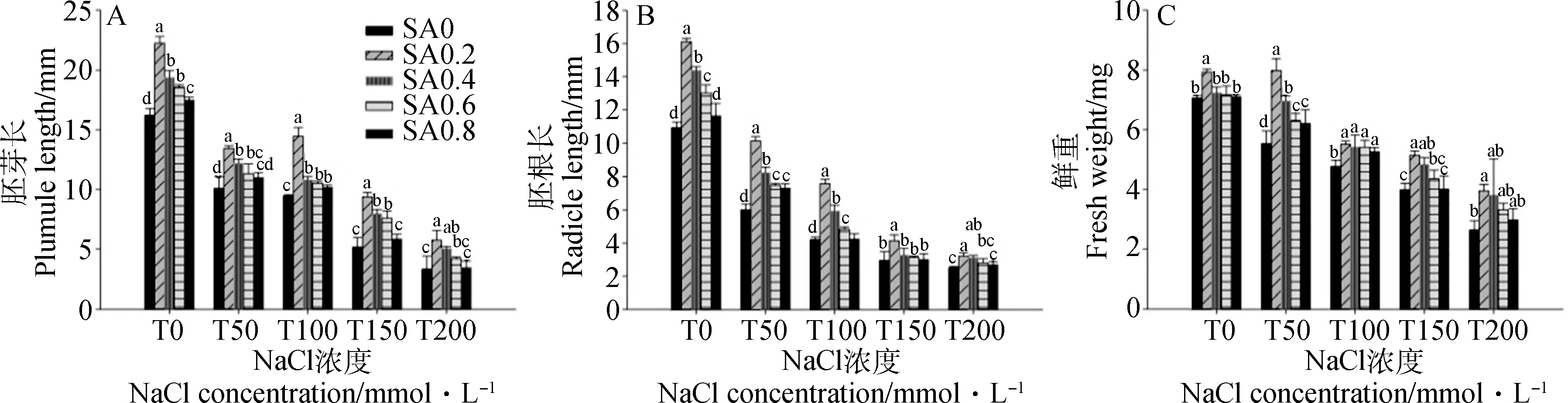
图2 不同浓度SA对盐胁迫下神香草胚芽长(A)、胚根长(B)、鲜重(C)的影响
2.3 不同浓度GA对盐胁迫下神香草种子萌发的影响
GA处理对无盐胁迫下和盐胁迫下神香草种子发芽特性均有促进效果,但促进效果因GA浓度存在差异。如图3所示,盐胁迫条件下GA处理后种子发芽率、发芽势、发芽指数、活力指数随GA浓度增加大致呈先上升后下降的趋势,无盐胁迫(T0)下,GA0.3,GA0.6对活力指数有明显提升(图3D)。如图3A、B所示,各浓度盐胁迫条件下,GA0.3,GA0.6均能显著提升种子发芽率和发芽势(P<0.05)。T100条件下,GA0.6处理后种子发芽率是对照组的1.56倍,缓解效果最为显著(P<0.05),而在T150条件下,GA0.6缓解效果低于GA0.3。T150和T200条件下GA0.6对种子发芽势的缓解效果最佳,分别提升58.03%,154.73%。如图3C、D所示,就发芽指数和活力指数而言,T50条件下GA的缓解效果明显低于T100和T150。

图3 不同浓度GA对盐胁迫下神香草种子发芽率(A)、发芽势(B)、发芽指数(C)、活力指数(D)的影响
2.4 不同浓度GA对盐胁迫下神香草胚芽长、胚根长、鲜重的影响
由图4所示,无盐胁迫(T0条件)下,除GA0.9和GA1.2对胚芽长、胚根长、鲜重提升效果较弱外,其他GA浓度均能明显促进幼苗生长。盐胁迫下神香草幼苗生长指标随GA浓度增大而呈现先上升后下降,不同浓度盐胁迫条件下,GA0.6始终为幼苗胚芽长、胚根长和鲜重的峰值浓度。如图4A所示,就胚芽长而言,GA0.3~GA1.2处理后均有提升,且缓解效果随NaCl浓度升高而下降。GA0.6处理后幼苗胚芽长度在T50~T200条件下分别提升了33.41%,62.96%,61.19%,46.93%。如图4B所示,T100和T150条件下,仅GA0.3~GA0.9提升幼苗胚根长度的效果显著,而在T200条件下,各浓度GA处理后胚根均有显著提升(P<0.05)。如图4C所示,就幼苗鲜重而言,T150和T200条件下,GA0.3和GA0.6处理后有大幅度提升,T200条件下幼苗鲜重分别提升为对照的2.62,3.15倍。

图4 不同浓度GA对盐胁迫下神香草胚芽长(A)、胚根长(B)、鲜重(C)的影响
2.5 综合评价
由表1所示,各处理的隶属平均值代表了使用模糊数学隶属函数法最终对神香草种子各指标的耐盐性做出的综合评价。T0条件下,隶属函数平均值排序为GA0.6>GA0.3>SA0.2>GA0.9>SA0.4>GA1.2>SA0.6>SA0.8>CK。预处理使用0.2~0.8 mmol·L-1SA和0.3~1.2 mmol·L-1GA之后,各处理的隶属函数值均高于对照组,这说明在无盐胁迫条件下,SA和GA对神香草种子萌发期的发芽和幼苗生长起到一定的促进作用。T50~T200条件下,GA0.6综合隶属平均值始终位于第1,GA0.3在多数条件(T0,T50,T100,T150,T200)下排名位于第2,说明GA0.3和GA0.6处理后对于缓解不同浓度盐胁迫有明显效果。而SA0.2在T0~T200不同条件下,分别位于排名第3,4,2,3位,对于种子耐盐性也有较好的提升效果。

表1 不同浓度SA和GA对盐胁迫下神香草种子萌发的综合评价
3 讨论
3.1 SA对盐胁迫下神香草种子萌发和生长的影响
发芽率、发芽势、发芽指数和活力指数是种子发芽整齐度、发芽速度及种子活力的直接反映,也可用来鉴定其萌芽期的耐盐性[32]。本研究中,不同浓度SA均能提高50~200 mmol·L-1NaCl胁迫下神香草种子发芽特性(萌发率提升最大程度在19%以上),以0.2 mmol·L-1处理效果较好。这与王立红发现0.2 mmol·L-1SA对盐胁迫下棉花种子盐害缓解效果最好的研究结果一致[33],即SA一定程度上提高了神香草对盐的耐受能力,降低了盐胁迫对种子的伤害,其原因可能是SA通过水杨酸基因转录共激活蛋白调控Na+在细胞间的转运[34],调控离子吸收与分布以缓解离子毒害;同时SA作为一种天然植物激素信号分子,可协同其他激素诱导植物防御系统,激活抗氧化酶活性,缓解膜质过氧化,并使植物产生一定的抗盐性状,提高了植物对非生物逆境的抗性[35]。另外,其缓解程度随SA浓度增大呈下降的趋势,这与郝转[36]研究SA对盐胁迫下萝卜种子萌发和幼苗生长的影响结论不同,该研究中,萝卜种子发芽特性随SA浓度升高逐渐上升,很可能是植物种类不同,对SA提升耐盐能力的响应不同,本试验中SA提升种子耐盐的最适浓度也明显低于萝卜种子(1.5 mmol·L-1SA),推测萝卜对SA浓度的敏感性低于神香草。
由于外源激素浓度、盐胁迫浓度不同,幼苗生长受到的缓解效应存在差异。本试验条件下,神香草幼苗生长指标随NaCl浓度增加明显降低,但外源施加SA会使植物产生系统获得性抗性[32],提高幼苗生长速率,促进神香草幼苗胚芽、胚根生长,从而有效缓解盐胁迫的抑制作用。另外,SA处理对50,100 mmol·L-1NaCl条件下胚芽、胚根、鲜重的缓解效果好于150和200 mmol·L-1NaCl胁迫。这与王莹等[37]对辣椒、于丽丽等[38]对水飞蓟研究结论存在差异,该研究认为SA对200 mmol·L-1NaCl下对幼苗生长和生理特性效果较好,说明对不同植物而言,SA处理可缓解的最适盐胁迫浓度不同,推测是由植物本身的耐盐性差异所致。
3.2 GA对盐胁迫下神香草种子萌发和生长的影响
李翊华等[39]对黄瓜种子、杨晓平等[40]对甘蓝种子的探讨表明,适宜浓度的GA处理可有效缓解盐胁迫对种子的危害,且低浓度GA条件下,种子发芽特性随GA浓度变化呈上升趋势,而高浓度条件下则呈下降趋势,增加幅度明显低于低浓度GA条件。这与本研究结果一致,其主要原因是GA能通过诱导植物相关基因表达提高植物体内生长素含量,诱导种子ɑ-淀粉酶合成,通过解除DELLA蛋白对GA信号转导途径的抑制[41]等方式有效破除种子休眠;一定浓度的赤霉素能不同程度地腐蚀种皮蜡质层[12],提高种皮的透水、透气性,增强种子的呼吸作用与生理生化代谢,促进胚生长,从而减缓盐胁迫产生的伤害。本试验中,适宜浓度的GA处理使神香草种子打破休眠并伴有较高的活力和发芽速度,有利于其抵抗盐胁迫的危害,但GA浓度过大后又出现下降趋势,可能是GA浓度过高对种子内部的生理代谢过程造成干扰,高于其适宜浓度范围使缓解作用下降,不能使种子萌发效果提高。
胚芽、胚根长度以及鲜重是盐胁迫下幼苗生长量的综合反映。由于外源激素浓度、盐胁迫浓度不同,幼苗生长受到的缓解效应存在差异。研究表明,GA可通过细胞伸长和细胞数目增加显著促进盐胁迫下幼苗的生长[42],同时可提高水解酶活性,大量分解贮藏物质,从而增加植物养分积累、延缓幼苗衰老。本试验中当GA处理浓度为0.3、0.6 mmol·L-1时,0~200 mmol·L-1NaCl胁迫下幼苗生长指标缓解效果比较显著,其他GA浓度条件下缓解效果并不十分显著。这与李颖[32]发现仅低浓度SA和ABA均能促进芽、根的伸长结论一致,说明外源物质适宜浓度的确定对于植物抵御胁迫有重要作用,推测是外源激素处理同时也存在一定的“剂量效应”。
3.3 SA和GA对无盐胁迫下神香草种子萌发和生长的影响
植物激素在调控植物体内多种新陈代谢过程和生理反应中起着十分重要的作用。研究表明,施用植物激素浸种能打破种子休眠,减少阻碍种子萌发的相关物质[43],有些激素还能起到促进植物细胞分裂和细胞伸长、茎杆生长、叶片扩展等作用[44]。本试验中,无盐胁迫条件下,经SA和GA预处理后,神香草种子的萌发能力和幼苗生长状况均高于对照,表明两种激素对神香草种子破除休眠、促进幼苗生长有一定的促进作用。以往研究中,陈姣等[45]发现,适宜浓度的水杨酸浸种处理可有效提高八月瓜叶片可溶性糖含量,从而促进其种子萌发及苗木生长;禄亚洲等[25]指出,外源水杨酸浸种可通过提高种子发芽势、发芽指数和活力指数,进而促进种子萌发,并增强植物抗渗透胁迫能力,降低细胞膜脂过氧化损伤说明水杨酸浸种可促进种子发芽,提高种子出芽率和幼苗存活率;贾鑫等[43]在赤霉素和生长素浸种对多叶棘豆种子萌发的影响中指出,多叶棘豆种子在经过400 mg·L-1的GA浸种7小时后,发芽率、发芽势、发芽指数和胚根长有所提高。但不同植物种子响应外源激素促进生长的最适浓度不同,由此说明,SA和GA对种子萌发有促进作用,不同植物对激素适宜浓度的阈值要求不同。
4 结论
种子的萌发期和幼苗期是植物对环境胁迫最敏感、耐受能力最低的阶段。盐胁迫作为一种非生物胁迫,通过影响植物的营养吸收、能量和物质代谢等生理过程严重限制了农艺和观赏植物的生长和发育,降低了其产量和品质。本试验研究了SA、GA预处理对不同浓度NaCl胁迫下神香草种子萌发的影响,结果表明,随NaCl浓度增加,神香草种子的发芽率、发芽势、发芽指数、活力指数呈下降趋势,生长指标也明显低于对照。综合分析表明,0.2~0.8 mmol·L-1的SA和0.3~1.2 mmol·L-1GA预处理均可提升0~200 mmol·L-1NaCl胁迫下神香草种子萌发和幼苗生长指标。经隶属函数分析后显示,0.6 mmol·L-1GA是缓解不同浓度NaCl胁迫神香草种子萌发和幼苗生长的最佳浓度。
