耐盐促生菌筛选鉴定及对盐胁迫燕麦生长的影响
2022-01-08张银翠赵桂琴王振龙撖冬荣
张银翠, 姚 拓, 赵桂琴, 徐 茜, 王振龙, 包 康, 撖冬荣
(甘肃农业大学草业学院, 甘肃 兰州 730070)
土壤盐渍化是干旱半干旱地区作物减产的主要因素[1]。我国干旱区盐渍化土壤面积大,分布广,严重影响农业经济的可持续发展。解决该问题的传统方法是培育耐盐品种,但往往不能有效改善。相比之下,由于微生物对植物具有显著有益作用,利用微生物改良盐碱地以及提高植物抗逆性越来越受到人们关注[2]。大多植物根际促生菌(Plant growth-promoting rhizobacteria,PGPR)生长于中性环境,难以在盐碱环境中生存,则导致非耐盐促生菌菌肥在盐碱地不能发挥促进植物生长的作用[3],因此需要筛选耐盐PGPR,为盐碱地制作有效的微生物肥料。黑果枸杞(LyciumruthenicumMurr.)是耐盐抗旱灌木,在我国西北荒漠地区分布广泛[4],多年来一直是该地区的建群种[5],在干旱、盐碱地区可作为土壤改良的物种,黑果枸杞根际促生菌可能具备高耐盐性,因此,其PGPR的筛选对耐盐微生物资源开发具有重要意义。
植物根际促生菌是存在于植物根际的一类能够促进和保护植物生长发育的有益菌,促使植物适应不同的生态环境[6],但PGPR的促生特性受到环境因素,尤其是各类胁迫的严重影响,Upadhyay等发现PGPR随盐度增加失去了对植物的促生能力[7]。目前有研究表明将耐盐PGPR接种于作物的种子或幼苗后,可有效缓解盐胁迫对作物造成的伤害[8],如在盐胁迫下将Bacillussp. SR-2-1/1和Bacillussp. SR-2-1接种于马铃薯根际,可调节植物的离子吸收(增加K+和Ca2+吸收以及减少Na+吸收)达到缓解盐胁迫的作用[1]。耐盐菌(0%~20% NaCl)Klebsiellasp.兼具多种促生特性,可通过改善燕麦幼苗的生化和生理状况,帮助其提高NaCl胁迫的耐受水平[10]。迄今为止,许多研究表明耐盐PGPR在减轻不同作物盐胁迫上都有重要作用,如小麦和大豆等[10,11],目前关于促生菌促进植物耐盐性的研究多集中于植物地上部分的分析,对根系研究相对较少。
根是植物在长期适应陆生生活环境中逐渐发展和完善的营养器官,具有固定植物,吸收、输导土壤中的水分养分,合成和储藏营养物质,繁殖等多方面的功能。因而根系无论对植物基本的生长发育还是对植物响应外界环境都至关重要[12],根系表现型的适应性是对土壤环境条件变化的反应[13],根系形态决定植物对土壤水分和养分的吸收利用,从而影响植物地上部功能的发挥[14]。根系形态学特征包括根形态和根构型,根系形态一般用根的数量、总根长、根表面积、根体积、根分枝数、根毛的数量和长度等参数来描述,根构型是指同一根系中不同类型的根在生长介质中的空间造型和分布[15]。研究表明根长、根重和吸收面积等指标在一定程度上能反映根构型[16]。
燕麦(AvenasativaL.)是一种重要的饲料作物,尽管研究表明其具有一定的耐盐性,但与大麦、小麦和苜蓿等其他作物相比,对盐分更为敏感[9]。本研究通过从前期分离自黑果枸杞根系的菌株中重筛优良菌株并分类鉴定,探究盐胁迫下接种PGPR对燕麦根系形态的影响,以期为耐盐促生菌的开发筛选菌株资源。
1 材料与方法
1.1 材料
1.1.1供试菌株 对照菌株醋酸钙不动杆菌(Acinetobactercalcoaceticus)P19由甘肃农业大学微生物实验室提供,溶解无机磷量254.0 μg·mL-1,溶解有机磷量35.5 μg·mL-1,固氮酶活性864.9 nmol·mg-1protein·h-1。
1.1.2供试种子 供试燕麦为‘白燕7号’,由甘肃农业大学草业学院惠赠。
1.1.3主要培养基 无机磷培养基(Pikovskaky,简称PKO),金氏(King)培养基[17];LB培养基;固氮培养基(Nitrogen free medium,NFM)[18]。
1.2.1促生菌筛选 将前期分离保存的菌株在LB培养基中活化,依次接种于PKO和NFM培养基,筛选出现溶磷圈及在NFM培养基上生长快速的菌株,测定以下特性。
1.2 方法
1.2.2菌株促生特性测定 溶无机磷量:菌株接种于无机磷(PKO)液体培养基,于28℃,140 r·min-1的摇床上培养10天。培养结束后将发酵液在4℃,10 000 r·min-1条件下离心15 min,收集上清液,用钼蓝比色法测定磷含量[18]。采用乙炔还原法检测菌株固氮酶活性[18]。分泌IAA量采用salkowski比色法[17]。产ACC(1-Aminocyclopropane-1-carboxylic acid)脱氨酶特性的定性测定采用Penrose和Glick的方法[19]。
1.2.3菌株耐盐性评价 菌株接种于分别含有1%~15%NaCl的固体LB培养基上,每个处理3次重复,于28℃下培养5 d,观察其生长情况。将具有强耐盐性的促生菌接种于含有1%(LB基础培养基),3%,5%,7%,9%,11%,13% NaCl的LB液体培养基中,28℃,180 r·min-1培养,24 h测定OD600值[20]。
1.2.4优良耐盐促生菌鉴定 按照细菌基因组提取试剂盒说明书提取菌株DNA,通用引物27F(5′-GAGTTTG ATCCTGGCTCAG-3′)和 1492r(5′-TACGGCTACCTTGTTACGACTT-3′)扩增16S rDNA片段,扩增条件:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min共35个循环。72℃延伸5 min;4℃∞,扩增产物送北京奥科公司测序,将16SrDNA序列在Ezbiocloud网站与细菌模式菌株的序列进行比对,选择相似性较高的序列下载,使用MEGA7.0软件进行系统进化分析。
1.2.5菌株促生效果测定 供试种子消毒:挑选颗粒饱满的燕麦种子,2% NaClO浸泡3 min表面消毒,无菌水冲洗4~5次。置于铺有两层滤纸的培养皿上20℃下催芽(发芽最适温度15~25℃)。
菌悬液制备:供试菌株接种于装有100 mL液体LB培养基的250 mL三角瓶,28℃,180 r·min-1培养24 h,6 000 r·min-1离心10 min,弃去上清液,用50 mL无菌水冲洗菌体,使菌体悬浮液在OD600达0.6左右。
半固体培养基制备:配制全量Hoagland营养液,加0.2%琼脂灭菌,按400 mL每杯分装于高15 cm,口直径9 cm,底部直径5.5 cm的塑料杯(塑料杯在使用前清洗后用75%酒精灭菌,无菌水洗2~3次,置于紫外灯下灭菌10 min)中,用封口膜封口,待冷却凝固备用。
试验设计:采用双因素完全随机区组设计,因素一为促生菌接种,无菌水为对照,因素二为NaCl浓度,设3个处理,处理一:无盐胁迫,不加NaCl;处理二:0.6% NaCl;处理三:0.9% NaCl。每个处理3次重复。将发芽后苗长约5 cm的幼苗移栽于制备好的半固体培养基,每杯种4株,24 h后在幼苗根系接种20 μl菌体悬液,22℃,16 h光照8 h黑暗的生长室培养30 d后收获。测定株高,地上部鲜重,Scan Wizard EZ扫描仪扫描根系。
1.2.6数据处理及分析 用Microsoft Excel 2010进行原始数据整理,SPSS 24.0进行单因素方差分析和主成分分析。首先利用Kolmogorov-Smirnov和方差齐性检验各指标是否为正态分布和方差齐性,Kolmogorov-Smirnov检验表明各指标的P值均大于0.05,说明各指标均为正态分布,此外,对这些指标进行方差齐性检验(对部分数据进行了取对数(ln)处理),P值均大于0.05,说明符合方差齐性。然后使用单因素方差分析,在P<0.05的显著水平上采用多重比较检验差异。
2 结果与分析
2.1 菌株分离筛选与促生特性
获得2株目标菌株,编号分别为LrM1和LrM2,LrM1解Ca3(PO4)240.0 mg·L-1,分泌IAA 30.0 μg·mL-1,固氮酶活性117.0 nmol C2H4·h-1·mL-1,没有产ACC脱氨酶的特性;LrM2固氮酶活性280.0 nmol C2H4·h-1·mL-1,解Ca3(PO4)25.6 mg·L-1,无分泌IAA特性,但具有产ACC脱氨酶的特性。
2.2 促生菌的耐盐性
NaCl浓度低于5%时,随胁迫程度的增加3菌株的生长受到抑制。NaCl浓度在5%~7%时LrM2和P19的生长出现上升的现象,LrM1在此浓度下仍处于被抑制的状态。大于7%时各菌株随盐浓度增大OD600值显著下降,NaCl浓度9%时LrM1几乎不再生长,OD600值为0.032,11% NaCl胁迫时LrM2和P19 OD600分别为0.012和0.013。

图1 PGPR在不同NaCl浓度LB培养基中的生长曲线
2.3 系统发育分析
菌株LrM2的16S rDNA序列在Ezbiocloud网站模式菌株比对结果显示与Bacillushalotolerans和Bacillusstercoris的相似度最高,均为98.81%;LrM1的16S rDNA序列在Ezbiocloud网站模式菌株比对结果显示与Paenibacilluspeoriae和Paenibacilluspolymyxa的相似度最高,分别为99.85%和99.42%。使用MEGA7.0软件选择邻近法进行系统进化分析并构建进化树,结果如图2所示:LrM1处于类芽孢杆菌属(Paenibacillus)大的分支中,与Paenibacilluspeoriae聚在一起;LrM2处于芽孢杆菌(Bacillus)大的分支中,与Bacillushalotolerans和Bacillusmojavensis在一个分支上。即LrM1为Paenibacilluspeoriae,LrM2为Bacillussp.。

图2 基于16S rDNA序列构建的系统发育进化树
2.4 不同盐浓度下促生菌对燕麦根系形态的影响
2.4.1对燕麦总根长和根直径的影响 不同盐浓度下,促生菌对燕麦总根长和根直径的影响不同(图3)。无NaCl胁迫时,3株促进菌接种显著促进根长的增加,LrM2和P19抑制根直径的增大(P<0.05)。NaCl浓度为0.6%时,抑制LrM1对根长的促进作用,LrM2和P19显著促进根长增加,3株菌对根直径没有影响。NaCl浓度为0.9%时,根长显著减小,与无盐胁迫时未接种菌株的处理相比显著下降71.4%,3个接种处理与对照无差异,LrM1抑制根系的增粗,P19处理的根系直径最大,但两者与对照相比都未达到显著差异(P<0.05)

图3 不同NaCl浓度下促生菌对燕麦根长和根系直径的影响
2.4.2对燕麦根系总表面积和总体积的影响 无NaCl胁迫时,3株促生菌显著促进根系总表面积增大,LrM1和P19显著促进根体积增加(P<0.05)。NaCl浓度为0.6%时,LrM2和P19对根系表面积和体积的增大具有显著促进作用(P<0.05)。NaCl浓度为0.9%时,3株促生菌处理的根系总表面积和总体积与不接菌处理没有差异(P<0.05)(图4)。
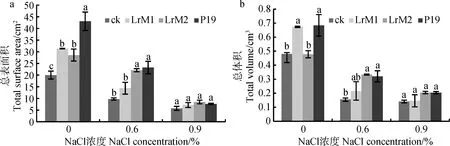
图4 不同NaCl浓度下促生菌对燕麦根表面积和根体积的影响
2.4.3对燕麦根尖数和分支数的影响 无NaCl胁迫时仅P19显著促进根尖数增加,但3个接种处理均促进分支数增加(P<0.05)。NaCl浓度为0.6%时,LrM2和P19显著促进根尖数和分支数增加(P<0.05)。NaCl浓度为0.9%时,各接种处理对根尖数和分支数均无影响(P<0.05)(图5)。

图5 不同NaCl浓度下促生菌对燕麦根尖数和分支数的影响
2.5 燕麦根系指标的主成分分析及综合评价
3株促生菌接种后燕麦6个根系指标彼此间存在差异,且各指标间具有一定相关性,故采用主成分分析法对6个根系指标进一步分类简化。将6个指标转化为2个主成分,根据特征值大于1进行提取,特征值大于1的主成分共2个,其方差贡献率分别为69.8%和22.3%。累积方差贡献率为92.1%,评价的6项根系形态指标转化为2个不相关的综合指标,达到对原信息降维的目的(表1)。
主成分载荷矩阵反映了各指标在主成分中的作用方向及大小程度。由表1可知,第1主成分代表了燕麦根系总信息的69.8%,主要反映根系吸收面积的大小,第2主成分代表了燕麦根系总信息的22.3%,主要反映根系横向生长和纵向生长情况,但总根长(—0.298)载荷值的绝对值较大,说明盐胁迫抑制根系的纵向发展时根的横向发展得到促进。

表1 燕麦根系指标的主成分载荷矩阵、特征值和方差贡献率
以 2个主成分的方差贡献率为权重,构建菌株促进燕麦耐盐性的综合评价模型:Dn=69.761×F1+22.336×F2。根据上述综合评价模型计算出各促生菌在盐胁迫下对燕麦促生作用的综合评价分值,分值越高,促生作用越强。由表2可知,菌株LrM2的主成分综合得分最高,LrM1综合得分最低,即LrM2促生作用最强,LrM1最弱(表2)。
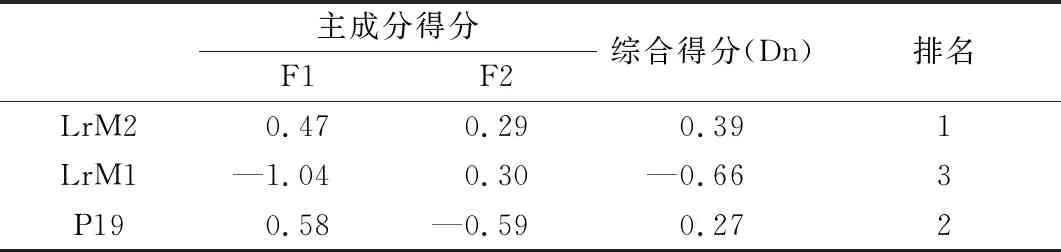
表2 不同菌株促生能力的主成分得分
2.6 PGPR对燕麦株高及鲜重的影响
不同盐浓度下,促生菌对株高和鲜重影响不同(图6)。无NaCl胁迫时,LrM2和P19处理显著促进株高和鲜重增大(P<0.05)。NaCl浓度为0.6%时,LrM1和LrM2促进株高增大,仅LrM2接种显著促进鲜重增加。NaCl浓度为0.9%时,与未胁迫对照处理相比株高和鲜重分别降低43.8%和67.0% (P<0.05),各接种处理对对株高及鲜重没有促进作用。

图6 不同NaCl浓度下促生菌对燕麦株高和叶鲜重的影响
3 讨论
本试验筛选出2株耐盐促生菌,LrM1在液体LB培养基中盐浓度为9% 时生长受抑制,LrM2在液体LB培养基中盐浓度达11%时生长受抑制,经鉴定LrM2为Bacillus属,LrM1为Paenibacilluspeoriae。盐生植物根际微生物具较强耐盐性可能是其根际的离子强度较高,因此根际促生菌也适应高盐度[21]。有研究者从黄河三角洲盐碱地田菁根际土[20]中分离出一株肠杆菌属(Enterobacter)耐盐细菌,显著促进田菁发芽率,在玉米盆栽试验中对光合作用、株高、根长等都有促进效果;有滨海盐生植物补血草根际土壤[22]中分离出高耐盐性促生菌的报道,目前鲜有黑果枸杞根际耐盐促生菌的研究。
根系是连接植物地上与地下部分的唯一枢纽,向地上部传输水分与营养,最先遭受盐胁迫,对土壤盐分的变化敏感度最高。逆境条件下,良好的根系形态有利于植物对土壤养分的有效吸收及利用,对耐盐性至关重要[23-24]。盐胁迫后根形态指标发生明显变化,总根长、根尖数、根表面积、根系体积和分枝数均显著减小,接种促生菌LrM2和P19后对0.6% NaCl胁迫的各根系形态指标有不同程度的促进作用,但对0.9%NaCl胁迫的根系形态参数没有影响,可能是该胁迫抑制菌株的促生特性,促生能力减弱,不足以缓解盐胁迫对燕麦根系生长的抑制[26]。
根系长度的增大有利于提高根系在土壤中的分布范围,是促进植物营养和水分获取的一个重要策略[25]。根系分支直接关系到作物对土壤水分的吸收和利用,较大的根系表面积和根体积有利于植物大范围的吸收水分和养分[27-28]。LrM2和P19显著促进0.6% NaCl胁迫燕麦总根长、表面积、体积、根尖数和分支数的增加,两菌株可能通过改变根系形态特征,促使植物根系在胁迫环境中扩展,吸收足够的水分和营养来保证燕麦的正常生理需求,前人对强抗旱陇中苜蓿根系形态特征的研究也得出相似的结果[29]。
PGPR的促生特性受到环境因素特别是盐胁迫的严重影响[30],如Muhammad Tahir等[1]发现,随着盐度的增加,两株芽孢杆菌的促生特性受到严重限制。LrM1耐盐性较LrM2低,可能其促生特性更易受盐胁迫的抑制,导致对燕麦的促生作用差。PGPR产生的ACC脱氨酶将植物乙烯前体ACC裂解为氨和α-酮丁酸,降低逆境植物的乙烯产量,从而促进根系生长[31-32]。由此可见,菌株LrM2可能有助于植物缓解盐胁迫,最终改善植物根系以及增加地上生物量。
冠层是水分散失的通道,植物经历持续水分胁迫后会通过减少地上生物量来降低蒸腾耗水量[33]。盐胁迫最终导致植物产生生理干旱而出现上述结果,本试验接种LrM2显著促进胁迫时根系生长,根系形态的改变是一种“开源”策略,即植物在逆境下以根系形态的适应性变化保证捕获最大限度的水源[34],缓解植物的水分胁迫,地上部分得以生长。Swapnil Sapre等将一株Klebsiellasp.促生菌接种于盐胁迫的燕麦,也得出显著促进叶鲜重增加的结果[9]。
主成分分析显示LrM2在胁迫条件下对根系生长促生作用最显著,对地上生物量、株高分析结果和根系分析结果一致,也是LrM2促生作用最强。虽然P19和LrM2耐盐性相差不大,但盐胁迫时接种P19与对照相比没有促进株高增加,且生物量下降,可能是P19在胁迫条件下能生长,但失去对燕麦的促生作用。综上所述,有望将LrM2用于制作盐碱地微生物肥料,但应用方面还需进一步研究。
4 结论
菌株LrM2具固氮、溶磷和产生ACC脱氨酶等促生特性,且耐盐性较高,显著促进0.6%NaCl胁迫燕麦的地上生物量和株高增加,明显改善总根长、根表面积、根体积、分支数和根尖数等形态参数,有开发成盐碱地微生物肥料的潜力。
