4种豆科植物根际土壤真菌群落特征与土壤理化因子间相关性分析
2022-01-08苏贝贝道日娜
苏贝贝, 张 英, 道日娜
(青海大学农牧学院,三江源区高寒草地生态省部共建重点实验室, 青海 西宁 810016)
豆科牧草是豆科饲用植物的总称,通过固氮作用对节约草地氮资源做出贡献,同时具有良好的饲用价值,极大地促进了草原植被的建立,对我国畜牧业的发展十分重要[1]。扁蓿豆为豆科苜蓿属矩荚苜蓿组的多年生草本植物,广泛分布于我国北方的典型草原、高山草原和荒漠化草原,具有较强的抗寒、抗旱、耐盐碱、耐贫瘠等优点,同时,富有较高的营养价值[2]。紫花苜蓿号称“牧草之王”,其根系比较发达,拥有较好的适应能力、能够防风固沙、改良土壤等多种特性[3]。红豆草营养丰富,含有大量缩合单宁,牲畜喜食且不得膨胀病,被誉为“牧草皇后”[4]。蚕豆俗称佛豆、胡豆、寒豆等,属越年生或一年生豆科野豌豆属草本植物,富含蛋白质、膳食纤维、微量元素等营养物质[5]。
土壤是豆科牧草营养吸收和生长发育的重要场所,土壤质量的好坏直接或间接影响牧草品质与产量。目前,对豆科植物根际土壤生态质量的研究,主要集中于微生物量、土壤养分、微生物活性及可培养真菌的初步分类等[6-9]方面,但从土壤微生物群落结构角度探讨豆科植物的研究相对较少[10]。土壤微生物是土壤生态环境中最为重要且对环境变化极其敏感的生物活性因子,对土壤生态系统的健康状况与植被的生长发育都会产生重要影响[11]。真菌作为微生物区系的主要成员,具有分解有机质,为植物提供养分的功能,是土壤生态系统是否健康的指示物[12]。近年来,对土壤真菌群落结构和功能的探究受到了学者们的高度关注。牟红霞等[13]研究发现,随着种植年限的变化,土壤真菌群落变化表现为先减小后增大的变化趋势,且与土壤理化性质具有显著相关关系,pH值、速效氮和有机碳是影响紫花苜蓿土壤真菌群落组成的主要因子。刘凤红[14]研究表明,蓝莓系内生真菌的群落组成和结构因其品种的不同而存在一定差异,且各菌属在不同品种蓝莓根系内的优势度也不同。
高寒地区的自然条件较为特殊,海拔高,气候寒冷干旱,生态环境脆弱,挖掘极端生境下的土壤真菌群落结构特征是未来研究的重要方向。前人主要通过探索培养微生物、PCR-DGGE、16S rRNA基因文库构建技术来了解土壤微生物群落结构[15-16]。这些方法存在通量低、信息量少,并不能全面反应出土壤微生物的物种结构及其丰度[17]。因此,本研究采用Illumina HiSeq PE250高通量测序技术对4种豆科牧草根际土壤进行测序,全面反应土壤中真菌的多样性,探明4种豆科牧草根际土壤真菌群落结构对土壤理化性质的响应,旨在为高寒地区豆科牧草根际土壤真菌多样性的深入研究提供基础数据理论依据,对维护高寒草地生态系统平衡有重要意义。
1 材料与方法
1.1 研究区概况
试验地位于青海省牧草良种繁育场(N 35°15′28″,E 100°39′16″),平均海拔高程3 220 m,年平均气温为0.2℃,全年≥0℃的活动积温为1 503℃,全年无绝对无霜期,年平均降水量为430.0 mm,年平均蒸发量为1 352.5 mm。该地区海拔高,冬春干旱,多风而寒冷、夏季凉爽,雨热同季,适合牧草生长。
1.2 样地设置及土样采集
在2019年4月20日播4种豆科植物草种,种植面积为5 m×8 m,条播,行距为40 cm,每个处理田进行3次重复,播种量分别为扁蓿豆Medicagoruthenicu(样品编号TDB)24 kg·hm-2、紫花苜蓿Medicagosativa(样品编号TDZ)22.5 kg·hm-2、红豆草Onobrychisviciifolia(样品编号TDH)30 kg·hm-2、蚕豆Viciafaba(样品编号TDC)220 kg·hm-2,随机区组试验设计如图1所示。土壤样品采集时间为2019年8月20日,具体采集方法如下:采用5点取样法取样,使用土钻采取0~20 cm植物根系及土壤样品,抖落根系大块土壤,收集根上0~5 mm的土壤作为根际土[18],立即装入无菌样品采集袋,所有样品在低温条件下带回实验室,样品分为两份,一份自然风干过2 mm筛用于土壤理化性质的测定,另外一份-80℃冰箱保存,用于土壤微生物总DNA提取。

图1 随机区组试验设计图
1.3 测定指标与方法
1.3.1土壤理化指标 土壤理化性质的测定方法如下[19]:利用酸度计电位法测定土壤pH值;利用氯化钾浸提-分光光度计法测定土壤速效氮含量;利用NaHCO3浸提-钼锑抗比色法测定土壤速效磷含量;利用醋酸铵浸提-火焰光度计法测定土壤速效钾含量;利用纳氏比色法测定土壤全氮含量的测定采用;利用钼锑抗比色法测定土壤全磷含量;利用火焰光度计法测定全钾含量;利用高温外热重铬酸钾氧化—容量法测定有机质含量。
1.3.2土壤总DNA提取及ITS基因扩增 采用OMEGA土壤DNA提取试剂盒(生工生物工程(上海)股份有限公司)提取豆科植物根际土壤样品中的微生物基因组DNA,为了降低实验误差,每个样品重复3次。采用Illumina HiSeq PE250测序平台的通用引物对真菌ITS1区域进行PCR扩增,引物为ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)。PCR扩增条件参照Miao等[20]方法。将电泳检测合格的PCR产物,送至生工生物工程(上海)股份有限公司进行测序。
1.4 生物信息学分析
根据Barcode序列和PCR扩增引物序列从下机数据中拆分出各样品数据,截去Barcode和引物序列后对Reads进行拼接[21]得到原始Tags数据(Raw Tags);对原始测序数据进行质量过滤并去除嵌合体序列,进而得到优质Tags数据;在相似性97%的水平上对序列进行聚类,用Mothur[22]方法与SILVA软件的SSUrRNA数据库进行物种注释(阈值0.8~1.0);采用PyNAST软件[23]与GreenGene数据库中数据信息进行多序列比对,最后对测序数据进行标准化处理,进一步进行α多样性分析(Alpha Diversity)、β多样性分析(Beta Diversity)和显著物种差异分析等来挖掘样品之间的差异。通过RStudio软件绘制热图,采用非加权配对平均法进行层次聚类绘制系统发育树。
1.5 数据分析
所有数据经过Excel 2013处理,采用SPSS 21.0软件对数据进行单因素方差分析(One-way ANOVA),Duncan新复极差法进行差异显著性检验(P<0.05)。土壤理化指标与真菌群落之间的关系,采用Pearson相关系数法进行相关性分析。
2 结果与分析
2.1 土壤理化性质
4种不同豆科植物根际土壤理化性特征测定结果如表1所示,结果表明4种豆科植物根际土壤的pH值在8.02~8.25之间,其差异显著(P<0.05),全氮含量变化范围为1.1~2.79 g·kg-1,全磷含量范围在1.96~3.44 g·kg-1之间,全钾含量范围为23.85~24.81 g·kg-1,TDC样品和其他3个样品全钾含量差异显著,速效氮含量范围为78~187 mg·kg-1,速效磷含量范围为19.3~75.2 mg·kg-1,速效钾含量范围为78~168 mg·kg-1,有机质含量范围为16.39~41.73 g·kg-1,TDB的土壤速效氮、速效磷和速效钾,以及有机质含量均远远小于其他3个样品。

表1 4种豆科植物根际土壤理化因子特征
2.2 土壤真菌群落丰度与Alpha多样性分析
通过对4个土壤样品进行高通量测序,共得到267 532条有效序列,序列长度相对集中,平均长度分别为260 bp,256 bp,238 bp,243 bp,聚类共得到966个OTUs。各样品测序覆盖度均在99.9%以上,并且趋于平缓的稀释曲线,说明本研究测序数据合具有可靠性,能够准确提供土壤真菌群落的真实信息(图2)。如表2所示,各样品真菌群落丰富度指数(Chao1指数)依次为TDC>TDZ>TDH>TDB,真菌群落多样性指数(Shannon-Wiener)指数依次为TDC>TDB>TDH>TDZ。在97%的相似度水平下,得到了每个样品的OTU个数,如图3所示,所有样品中共有OTUs数目为61个,其中TDB,TDC,TDH,TDZ所特有的OTUs数目分别为44,50,26和19个。

表2 4种豆科植物根际土壤样品序列数统计、丰富度与多样性指数

图2 样品稀释曲线

图3 样品韦恩图
2.3 土壤真菌群落分布特征
2.3.1门水平上的组成 如图4所示,在4种豆科植物根际土壤中,各样地土壤真菌分属于9个门,相对丰度>1%的菌群分别为子囊菌门(Ascomycota)、被孢霉门(Mortierellomycota)、担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)、丝足虫门(Cercozoa)、油壶菌门(Olpidiomycpta)、球囊菌门(Glomeromycota)、Aphelidiomycota、毛霉门(Mucoromycota)。其中,子囊菌门(Ascomycota)在4组土样中的相对丰度为39.52%~84.51%,是最优势菌门,远远大于次优势菌门——被孢霉门(Mortierellomycota),相对丰度为6.94%~24.65%;各组土样在门分类水平上的菌群落丰度分别为:子囊菌门(Ascomycota)在各组土样中相对丰度高低为TDZ>TDH>TDC>TDB;被孢霉门(Mortierellomycota)在各组土样中相对丰度高低为TDC>TDB>TDH>TDZ。

图4 门分类水平下的真菌群落相对丰度
2.3.2属水平上的组成 如图5所示,在各样地中真菌在属分类水平上,相对丰度>1%的分别为四枝孢属(Tetracladium)、被孢霉属(Mortierella)、小不整球壳属(Plectosphaerella)、毛壳菌属(Chaetomium)、小画线壳属(Monographella)、假裸囊菌属(Pseudogymnoascus)、线黑粉酵母属(Filobasidium)、小鬼伞属(Coprinellus)、油壶菌属(Olpidium)、镰刀霉属(Fusarium)。其中,在TDB土样中,小不整球壳属(Plectosphaerella)为最优势属,相对丰度为23.23%;被孢霉属(Mortierella)为次优势属,相对丰度为14.64%。TDC土样中,被孢霉属(Mortierella)为最优势属,相对丰度为23.93%;次优势属为四枝孢属(Tetracladium),相对丰度为4.75%。然而,在TDH土样中,四枝孢属(Tetracladium)为最优势属,相对丰度为42.29%;次优势属为被孢霉属(Mortierella),相对丰度为6.93%。同样,在TDZ土样中,四枝孢属(Tetracladium)为最优势属,相对丰度为6.86%;次优势属为被孢霉属(Mortierella),相对丰度为6.77%。

图5 属分类水平下的真菌群落相对丰度
2.4 Beta多样性分析
通过以Rstudio软件的P-heatmap包绘制聚类热图,从聚类中可根据颜色梯度的变化直观看出两两样品间的差异性。聚类结果如图6所示,TDZ样品和TDC样品的真菌群落组成及丰度差异最小,而和TDB样品的真菌群落组成及丰度差异最大。
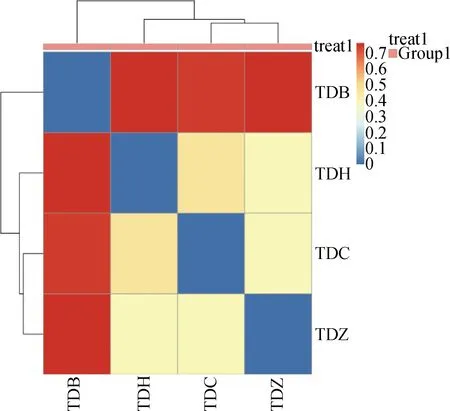
图6 豆科牧草根际土壤样品加权UniFrac的heatmap图
基于Beta多样性分析得到的四种距离矩阵,通过R语言工具采用非加权配对平均法(UPGMA)对样品进行层次聚类,以判断各样品间物种组成的相似性。从图7中可以看出TDZ样品和TDC样品的真菌组成及丰度相似性较高,而和TDB样品的真菌群落结构差异较大。

图7 基于OTU的豆科牧草根际土壤样品树状聚类图
2.5 土壤理化性质与真菌优势类群的相关性
土壤中微生物物种丰度与土壤理化性质关系密切,门水平丰度较高物种与土壤理化相关性分析表明(表3)。土壤pH值与子囊菌门呈负相关,与其他理化因子呈正相关。土壤全氮、速效磷、有机质与子囊菌门、壶菌门、球囊菌门、Aphelidiomycota呈正相关;与丝足虫门、油壶菌门、毛霉门呈极显著负相关(P<0.01);与被孢霉门、担子菌门呈负相关。土壤全磷与子囊菌门、被孢霉门、壶菌门、球囊菌门、Aphelidiomycota呈正相关;与油壶菌门呈显著负相关(P<0.05);与担子菌门、丝足虫门、毛霉门呈负相关。土壤全钾与壶菌门、球囊菌门、Aphelidiomycota呈极显著正相关(P<0.01);与被孢霉门呈负相关;与子囊菌门、担子菌门、丝足虫门、油壶菌门、毛霉门呈负相关。土壤速效氮、速效钾与子囊菌门呈负相关;与其他理化因子负相关。

表3 门水平物种与土壤理化性质的相关性
2.6 土壤理化性质与真菌多样性的相关性
对4种豆科植物根际土壤真菌群落多样性与土壤理化性质进行相关性分析,结果表明(表4),土壤真菌群落丰富度Chao1指数与土壤全磷含量呈极显著正相关(P<0.01),与土壤有机质含量呈显著正相关(P<0.05);土壤真菌群落多样性指数Shannon与土壤pH值、全磷、全钾、有机质含量呈正相关,与土壤全氮、速效氮、速效磷、速效钾含量呈负相关。

表4 不同豆科植物根际土壤真菌群落多样性与土壤理化性质的相关性
3 讨论
土壤微生物不仅可以调节植物群落的结构和多样性,在一定程度上还影响着植物与微生物群落间的互相适应作用[24-25]。真菌能够对生态系统的健康变化做出敏锐反应,并且积极促进碳、氮在土壤中的转化利用,尤其是在植物有机体分化的前期过程中,真菌比细菌和放线菌更具活性[26]。
有研究发现土壤pH值是影响真菌群落结构的重要环境因子,对真菌的生长和繁殖具有显著影响[27]。当土壤有机质含量超过其所能承受的阈值时,真菌多样性就会降低[28]。张雪等[29]研究表明,艾比湖湿地6种盐生植物根际土壤真菌群落多样性及丰富度存在差异。结合本研究对同一地区种植的4种豆科牧草根际土壤真菌进行高通量测序分析,Alpha多样性分析结果表明,各样地真菌群落丰富度指数(Chao1指数)依次为TDC>TDZ>TDH>TDB,真菌群落多样性指数(Shannon-Wiener指数)依次为TDC>TDB>TDH>TDZ。β多样性分析结果表明,TDZ样品和TDC样品的真菌群落组成及丰度差异最小,而和TDB样品的真菌群落组成及丰度差异最大。李金前等[30]研究发现,3种园林植物土壤中的真菌数量和群落结构差异显著。这与本研究中同一地区不同种豆科植物根际土壤真菌群落结构差异显著结果相一致,土壤环境是造成牧草根际土壤真菌群落多样性差异的原因。
优势菌是决定微生物群落平衡的重要因素,能够影响微生物群落的组成和结构。苏小惠等[31]对同一地区不同苎麻品种根际微生物多样性群落结构进行了分析,结果表明,真菌主要以子囊菌门、接合菌门和担子菌门为主。赵兴丽等[32]对不同品种茶树根际土壤真菌群落多样性及结构特征进行研究,试验结果显示,担子菌门、子囊菌门和接合菌门为优势真菌群。汪焱等[33]对高寒区不同地域燕麦根际土壤微生物多样性进行研究,结果指出,真菌主要以子囊菌门,球灰霉菌门,担子菌门,壶菌门,油壶菌门,球囊菌门子为主,这与本研究结果相似,但群落组成相对丰度不同。张俊忠等[34]研究结果表明,不同草地类型土壤真菌的构成相似,但是土壤真菌的数量、种类、结构组成不同。结合本研究,4个土壤样品中的真菌群落在门水平上,主要以子囊菌门最为丰富,其次为被孢霉门、担子菌门。进一步属水平上分析,小不整球壳属(Plectospharella)在TDB土样中最为丰富,相对丰度为23.23%;TDC土样中,被孢霉属为最优势属,相对丰度为23.93%;四枝孢属在TDH、TDZ样地中最丰富,相对丰度分别为42.29%,6.86%。从门和属分类水平上可以明显看出同一地区栽培牧草土壤微生物群落组成基本一致,但4种豆科植物的土壤微生物群落组成丰度存在差异。
真菌对季节变化、土壤理化性质、植被类型等的响应各有不同,而土壤环境因子是影响土壤真菌多样性的主要因素。Wang等[35]比较了南极洲菲尔德斯Fildes地区4种不同种类土壤的微生物多样性和菌群组成,发现影响土壤微生物菌群结构最显著的因素为pH值、磷酸盐、有机碳、有机氮含量。Hazard等[36]研究显示,土壤有机质含量会对土壤真菌群落结构存在重大影响。Jansa等[37]研究表明施磷对提高土壤真菌的多样性具有一定的作用。李海云等[38]研究发现土壤速效钾、全氮、速效氮、有机质和有机碳是祁连山不同退化高寒草地土壤真菌群落分布的主要驱动因子。植物根系的健康状态是植物、土壤物理环境和化学环境以及土壤中微生物(病原体本身以及其他微生物)之间复杂的相互作用的结果[39]。通过分析真菌多样性与土壤环境因子的关系,可以间接反映土壤是否健康,本研究相关性分析表明,4种豆科植物根际土壤真菌群落多样性与土壤全磷、速效磷、全氮、全钾、速效氮、速效钾、有机质的含量及土壤pH值间存在一定的相关性,其中重要驱动因素是土壤全氮、全磷、速效磷和有机质,这说明真菌对环境的适应能力不同,对环境因子的改变比较敏感,从而导致真菌群落结构发生变化。各种环境因子与土壤微生物的相互作用机制是复杂的,因此,探究植物根际土壤微生物和土壤理化性质之间的关系对高寒地区的植物资源利用和经济发展有重要的意义。
4 结论
4种豆科植物根际土壤理化性质间具有显著差异,且与扁蓿豆样地相比,蚕豆、红豆草、紫花苜蓿3样地土壤理化性质更为相似。通过Illumina HiSeq高通量测序技术,共得到267 532条有效序列,聚类共得到966个OTUs;4种豆科植物根际土壤真菌群落丰富度指数(Chao1指数)依次为TDC>TDZ>TDH>TDB,真菌群落多样性指数(Shannon-Wiener)指数依次为TDC>TDB>TDH>TDZ;Beta多样性分析表明,蚕豆与紫花苜蓿根际土壤真菌多样性相似度较高,与扁蓿豆差异性较大。通过相关性分析,土壤全氮、全磷、全钾、速效磷和有机质是土壤真菌群落分布的主要影响因子。
