根瘤菌对紫花苜蓿生物修复镉污染功能的影响
2022-01-08孔海明李开源高双红孙娈姿
孔海明, 李开源, 高双红, 孙娈姿
(西北农林科技大学草业与草原学院, 陕西 杨凌 712100)
随着我国工业的飞速发展,土壤重金属污染已成为破坏生态环境、阻碍农业发展的重要问题[1]。其中,镉(Cadmium,Cd)的污染问题最为突出,Cd污染土壤面积已达到2×105km2,约占总耕地面积的1/6[2]。土壤中的Cd可通过食物链的富集作用进入人和动物体内,严重危害人和动物的健康。因此,Cd污染土壤的修复治理问题亟待解决[3]。治理重金属污染土壤的传统方法有物理法和化学法,不仅成本高,还易造成二次污染。植物修复作为近年来兴起的新型修复重金属污染土壤的方法,成本低且保护土壤生态环境,被广泛认可和接受[4]。植物修复是利用植物根部吸收污染土壤中的重金属,并使重金属在植物地上部分积累,收割植物地上部分,即可在不破坏土壤结构的基础上去除污染物[1]。其中,氮素作为植物生长必需的营养元素,可提高植物对重金属污染土壤的修复功能。研究表明,利用非固氮植物修复Cd污染土壤时,施加氮肥可改变土壤中Cd的有效性及其在植物中的富集量,进而提高植物对Cd的生物修复能力[5]。但是,施用氮肥不仅增加成本,过多施氮还可能产生二次污染[6]。
根瘤菌是豆科植物重要的共生微生物,在土壤氮素不足的条件下,根瘤菌可将空气中的分子态氮转化为植物可直接利用的氮素[7],为植物提供氮素营养。根瘤菌共生对促进植物生长、提高作物产量具有重要作用[8],并且可以减少人工施氮量从而保护土壤生态环境。已有研究表明,接种根瘤菌可增强豆科植物生物修复重金属污染土壤的功能[9],根瘤菌可以直接螯合、沉淀、转化、吸附和积累重金属,还可通过固氮、磷溶解、植物激素合成等促进豆科植物生长,同时降低Cd毒性[10]。其中,Younis等[11]发现接种根瘤菌可提高扁豆(LablabpurpureusSweet)对Cd的抗性,促进生长。Chen等[12]表明接种根瘤菌的含羞草(Mimosapudica)对Cd的吸收能力可提高70%。但是,在Cd胁迫下,根瘤菌是否可以通过改变植物的氮素营养而影响其对Cd的生物修复功能尚不清楚。
紫花苜蓿(MedicagosativaL.)是豆科多年生草本植物,抗逆性强、根系发达、生物量大,且耐频繁刈割,可起到保护水土、改良土壤的作用,具有较好的生态价值,是目前生态修复研究的重要植物[13-14]。本试验以紫花苜蓿为研究对象,在不同氮素水平上对其进行接种和不接种根瘤菌处理,研究根瘤菌对紫花苜蓿生长和镉吸收的影响,为Cd污染土壤中修复植物的选择以及修复技术的应用提供理论依据。
1 材料与方法
1.1 试验材料培养
试验于2020年7月25日在西北农林科技大学草业与草原学院进行,供试紫花苜蓿为‘三得利’品种,供试菌株是苜蓿中华根瘤菌Rm1021。
挑选籽粒饱满且大小均一的种子,用15% H2O2浸种消毒10 min后,用蒸馏水冲洗4~5次,置于铺有两层灭菌滤纸的培养皿中,于25℃光照的人工气候培养间中萌发,待长出真叶后移至装有石英砂的圆形塑料花盆中(口径12 cm,高23 cm),每盆3株植物。移栽后,置于温度25℃、光照时长15 h的培养间内。每天浇灌1/2 Hoagland’s营养液。
1.2 试验材料处理
为探究氮素水平对紫花苜蓿生物修复的影响,待植株生长至30 cm时,将植株随机分成两组进行氮素处理。由于根瘤菌在土壤氮素含量低于4.5 mmol·L-1下可接种成功[15],因此设置低氮(1 mmol·L-1)和高氮(4 mmol·L-1)两个水平,随后在每个氮素水平上进行根瘤菌接种和不接种处理。为促使紫花苜蓿接种成功,接种后,将全部植株统一剪至7 cm高。接种后一周将根挖出查看,在确保根系着生粉红色有效根瘤后,施加Cd胁迫处理(CdCl2)。研究共设置4个Cd水平:0 mmol·L-1(CK),0.25 mmol·L-1,0.5 mmol·L-1,1.0 mmol·L-1。因此,本研究共计16个处理(2个氮素水平N×2个接种处理R×4个Cd处理),每个处理4次重复,共64盆植物。为防止蒸发造成土壤Cd及氮素的积累,每日的浇灌量达到浇透程度。30天后将整株植物采样,用于各项指标的测定。
1.3 试验指标和测定方法
株高和生物量的测定:用直尺测量株高。取紫花苜蓿鲜样,用剪刀分离地上部和地下部,在烘箱内105℃杀青30 min后,在75℃烘干至恒重,于万分之一天平上称重,记录干重。
Cd含量的测定:将植物样品取样烘干后,粉碎过0.425 mm筛。称取样品2.0 g放入消解管中,分别添加20 mL浓硝酸和4 mL高氯酸,然后低温热消解。当溶液到5 mL左右时加10 mL超纯水,继续消解15 min左右,转移至25 mL容量瓶中,冷却至室温,以0.2%的硝酸定容,通过火焰原子吸收分光光度法测定其重金属含量[16]。
氮含量的测定:将地上部和地下部植物样品烘干后,磨碎过孔径为0.074 mm筛,用凯氏定氮法测定紫花苜蓿含氮量。
叶片丙二醛(Malondialdehyde,MDA)含量的测定:采用硫代巴比妥酸法[17]。以0.5% TBA溶液为空白对照,测定450 nm,532 nm和600 nm处的吸光值,用公式MDA(μmol·g-1FW)=[6.452×(A532—A600)—0.559×A450]×Vt/(Vs×FW)计算。其中,Vs为测定所用提取液体积(mL),Vt为提取液总体积(mL),下同。
叶绿素含量的测定:采用95%乙醇提取叶绿素[18]。后用紫外可见分光光度计(UV-6100S型,MAPADA,中国)在波长665 nm,649 nm下测定吸光度,利用公式叶绿素含量(mg·g-1FW)=(18.16A649+6.63A665)×Vt×n/(1 000×FW)计算单位鲜重(Fresh weight,FW)的总叶绿素含量,式中,n为稀释倍数。
1.4 数据分析
利用SPSS 21.0对数据进行统计分析。当出现显著交互作用时,使用Duncan’s法对每个Cd水平下数据进行差异显著性检验(P<0.05),试验数据均用平均值±标准误表示。
2 结果与分析
2.1 紫花苜蓿株高和生物量
株高和生物量可反映植物的生长状况。Cd胁迫可显著降低紫花苜蓿的株高和生物量(表1)。在不同Cd胁迫下,增加施氮处理紫花苜蓿的株高和生物量均有所增加,说明添加氮素可缓解Cd对植物生长的毒害(表2,表3)。在2个氮素水平下,相比于未接种组,接种处理紫花苜蓿的株高和生物量均有所提高,Cd水平为0时,接种处理使低氮和高氮下植物株高分别增加10.20%和13.32%(P<0.05),地上生物量分别增加34.62%和25.00%(P<0.05)。Cd水平为1.0 mmol·L-1时,接种处理对株高无显著影响,但可显著提高植物的地上和地下部生物量(P<0.05)(表3)。
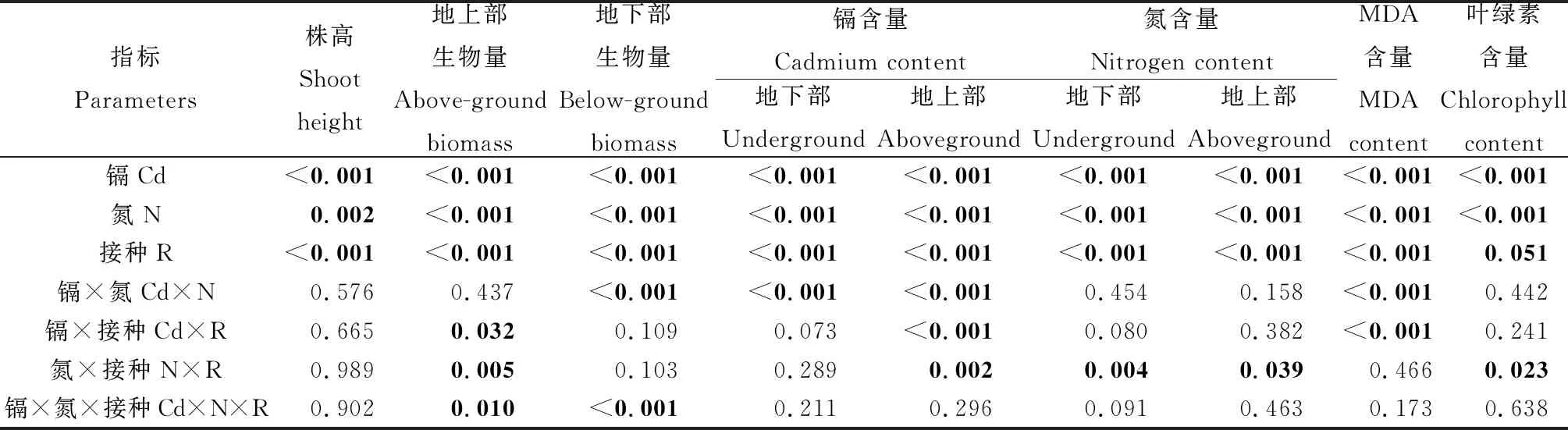
表1 镉水平、氮素水平和根瘤菌接种对苜蓿各指标影响的三因素方差分析

表2 不同处理下紫花苜蓿的株高
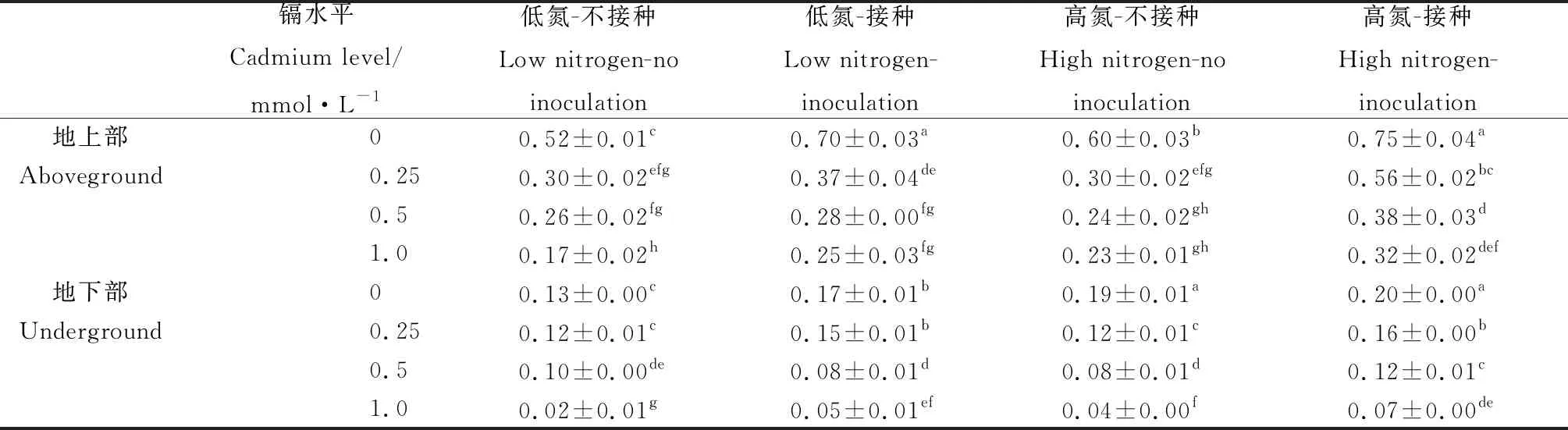
表3 不同处理下紫花苜蓿的生物量
2.2 紫花苜蓿Cd含量
植物体内Cd含量随Cd水平的增加而显著增加(表1)。无论接种与否,提高氮素水平可显著增加地下部和地上部Cd的积累(P<0.05)(表4)。在2种氮素水平下,接种可一定程度上增加地上部和地下部的Cd含量。低氮条件下,相比于未接种处理,接种处理显著提高紫花苜蓿地下部Cd的含量(P<0.05)(表4);在3个Cd胁迫水平上,地上部Cd的含量分别增加24.40%,11.57%和11.96%。在高氮下,接种处理使3个Cd水平下植物地上部Cd含量显著增加(P<0.05)(表4),使地下部Cd含量分别增加37.78%,4.17%,20.97%。

表4 不同处理下紫花苜蓿的Cd含量
2.3 紫花苜蓿氮含量
植物地上部和地下部氮含量随Cd胁迫水平的增加而显著降低(P<0.05)(表1,表5)。在不同水平的Cd胁迫下,提高氮素水平可显著增加植物地上部氮含量(P<0.05)(表1),在Cd水平为1.0 mmol·L-1时,增施氮素可使接种组和未接种组紫花苜蓿地下部氮含量分别提高16.42%和54.55%(表5)。在2个氮素水平下,接种处理均可提高植物的氮素含量,接种组的地上和地下部的氮含量均高于未接种处理组(表5)。

表5 不同处理下紫花苜蓿的氮含量
2.4 紫花苜蓿MDA含量
MDA含量反映了膜脂过氧化的程度,可间接反映植物受Cd胁迫毒害的程度。由表1可知,MDA含量随Cd胁迫水平的提高而显著上升(P<0.05)。提高氮素水平显著降低了MDA的含量(P<0.05)(表6)。镉胁迫下,与不接种处理相比,接种处理进一步降低了MDA含量(P<0.05)(表6)。在0.25 mmol·L-1,0.5 mmol·L-1,1.0 mmol·L-1Cd水平下,接种根瘤菌使高氮下叶片MDA含量分别降低47.40%,37.91%,25.87%,低氮下分别降低38.30%,29.37%,28.42%。

表6 不同处理下紫花苜蓿中MDA含量
2.5 紫花苜蓿叶绿素含量
叶绿素作为光合作用的关键色素,其含量多少标志着植物生长能力的强弱,Cd胁迫可导致叶绿素分解,使叶片干枯发黄。由表7可知,叶绿素含量随Cd胁迫水平的提高而下降。提高氮素水平可在一定程度上增加叶绿素含量。在高氮处理下,Cd水平为0.25 mmol·L-1时,与不接种处理相比,接种处理可使叶绿素含量增加27.11%(P<0.05)。

表7 不同处理下紫花苜蓿中总叶绿素含量
3 讨论
Cd是重金属污染土壤中的主要毒性元素之一,可被植物根系吸收并积累在茎叶中,进而随着食物链危害人类健康[19]。在改良重金属污染土壤中,生物修复是一种经济、环保的方法。与非固氮植物相似,氮素也可增加紫花苜蓿对Cd的吸收,并增强紫花苜蓿对Cd的抗性。根瘤菌具有固氮功能[8],并可增加根系对土壤氮素的吸收量[6],从而提高植物的氮素含量。因此在Cd胁迫下,接种根瘤菌可增加紫花苜蓿的Cd含量以及叶绿素含量,降低MDA含量,从而提高紫花苜蓿对Cd污染的生物修复功能。
根系是植物与Cd最先接触的部位,也是最先受到Cd毒害的部位[20],Cd毒可使根系变短变粗、侧根减少、活力降低,从而影响植物对Cd的吸收[21]。与前人研究一致,提高氮素水平显著地提高了Cd胁迫下紫花苜蓿根系的重量。而接种根瘤菌也可提高紫花苜蓿的地下生物量[22],增加根系表面积、根系体积和促进侧根生长[6],从而增加根系与土壤的接触面积。另外,根瘤菌的细胞壁富含羧基阴离子和羧酸阴离子,易结合环境中的活性金属阳离子到其表面[1],进一步促进植物根系对Cd的吸附。
除了根系对土壤中Cd的吸收之外,Cd在植物地上部的积累也是决定植物生物修复功能的重要指标。相比于低氮条件,高氮下紫花苜蓿体内积累的Cd含量较高,说明氮素可增强紫花苜蓿对Cd的积累。施氮还能提高油菜(BrassicacampestrisL.)中Cd向地上部转运积累的能力[23],类似结论在山杨幼苗(PopulusdavidianaDode)[24]和白三叶(Trifoliumrepens)[4]的研究中也可得到。接种根瘤菌可显著提高植物氮素含量,因此,根瘤菌可通过增加氮素含量,增加Cd在茎叶中的富集,从而提高植物对重金属污染土壤的修复。
叶绿素含量可表征逆境胁迫下植物的衰老状况。Cd胁迫可通过抑制5-氨基酮戊酸合成及抑制原叶绿素还原酶活性使植物叶绿素合成受阻[25],降低光合速率,抑制植物生长。氮素是叶绿素合成的重要营养元素,提高氮素营养可增加Cd胁迫下叶绿素含量[24-26]。而根瘤菌可通过固氮作用提高紫花苜蓿氮素含量,进而提高Cd胁迫下叶绿素的含量,王鹏辉等[27]也表明,接种根瘤菌处理使各品种大豆(Glycinemax)的叶绿素含量比未接种根瘤菌处理高7.63%~39.06%。
MDA含量是衡量膜脂过氧化程度的重要指标。Cd胁迫诱导活性氧类物质的积累,导致膜脂过氧化[28],从而增加MDA含量(表6)。提高氮素营养可减少MDA含量,说明氮素能够提高植物对Cd的耐受性[29],Hassan等[30]对水稻(OryzasativaL.)的研究结果也表明,Cd胁迫下,氮素可通过增加含氮化合物来稳定大分子、维持体内活性氧平衡以及抵抗细胞中氧化还原电位变化,从而减少MDA积累。而接种根瘤菌后可提高紫花苜蓿的氮素含量,缓解Cd胁迫对紫花苜蓿的细胞膜损伤,促进植物在逆境下的生长发育,从而发挥其改良土壤的生物修复功能。
4 结论
在Cd胁迫下,紫花苜蓿的株高下降,生物量减少,植物的生长发育受到抑制。提高氮素含量可促进叶绿素合成、降低MDA含量,并且增加植物对Cd的吸收。Cd胁迫下接种根瘤菌可增加植物体内氮素含量,增强植物对Cd的抗性。因此,根瘤菌可增强紫花苜蓿对镉污染土壤的生物修复功能,在生物修复领域具有良好的应用潜力和前景。
