生草对关中平原有机猕猴桃园土壤养分及细菌群落的影响
2022-01-08刘崇义靳旭妹王莹莹李腾飞陈新义曹馨悦龙明秀何树斌
刘崇义, 靳旭妹, 王莹莹, 李腾飞, 陈新义, 曹馨悦, 龙明秀, 何树斌
(西北农林科技大学草业与草原学院,陕西 杨凌 712100)
我国的猕猴桃产业的发展速度和规模令人瞩目,种植面积接近世界总面积的72%,产量占全球总产量的55%[1]。但由于生产中大量施用化肥、农药问题还很普遍,严重影响果品质量安全,制约了产品的国际市场占有率,不利于可持续发展。随着人们生活质量和对食品安全意识的提高,有机猕猴桃生产则成为解决上述问题的必然选择。但目前我国有机果园普遍存在土壤有机质含量较低、有机肥运输成本高等问题。果园生草技术能改善果园土壤物理性状,调节果园小气候,提高土壤有机质含量、土壤养分和酶活性,还可以提高果品质量,对土壤肥力和果树生长发育都有重要影响[2-4],是有机果园安全生产的重要技术之一。
细菌在土壤养分转化和循环等生物化学过程中发挥着重要作用[5]。土壤细菌在许多土壤化学过程中起着重要作用,参与有机质分解、碳氮循环、土壤团聚体和腐殖质的形成[6]。土壤细菌种群和群落组成受当地气候、土壤类型、植物种类和土壤管理方式等一系列土壤因素的影响[7]。土壤细菌对外界干扰较为敏感,其群落组成、相对丰度等指标在一定程度上反映了作物对养分的吸收利用及其生长发育状况[8]。生草覆盖主要通过植物根系分泌物、生草凋落物降解以及土壤含水量改变来影响果园土壤细菌群落结构[9]。根系分泌物中含有大量有机质,包括氨基酸、糖类、有机酸、酚类、次生代谢物和蛋白质等,这些物质主要由植物根毛和根尖细胞分泌[10]。李磊等[11]研究表明,猕猴桃园套种蕺菜(Houttuyniacordata)可提高根际土壤细菌数量,有利于改善猕猴桃根际土壤环境。Nakamoto等[12]研究表明,种植白三叶草(Trifoliumrepens)显著改善了土壤中细菌底物诱导的呼吸。因此,探讨果园不同生草处理对果园土壤的影响具有重要意义[13]。
前人对于生草处理下有机猕猴桃园土壤细菌群落、土壤化学性质的研究尚少[8-9,14]。秣食豆可固氮,且地上生物量高、绿期长;草木樨根系较浅且固氮效果显著;黑麦草能快速覆盖地面,抑制杂草,总体生长表现和肥田效果均较好[14-15]。本研究通过对三种不同生草处理的有机猕猴桃园土壤养分及土壤细菌群落变化特征进行研究,以期为有机猕猴桃园的土壤管理提供科学理论依据。
1 材料与方法
1.1 试验设计与研究区概况
试验地位于杨凌示范区五泉镇上湾村陕西百恒有机果园有限公司(34° 30′ N,107°59′ E),海拔418.0~540.1 m,年降水量635.1~663.9 mm,年均气温12.9℃。9龄徐香猕猴桃果园(株行距6 m×3.8 m)。试验采用完全随机区组设计,于2019年3月分别设置秣食豆(GM)、草木樨(MO)、一年生黑麦草(LP)、清耕(CK)4种处理,均采用条播,行距15 cm,播种量22.5 kg·hm-2;每个处理重复3次,共12个处理,小区面积为12 m×3.8 m=45.6 m2。2020年10月用土钻采集0~20 cm土层土样,按S形取样法分别采集5钻土壤,充分混合作为1个土样,每个土样分为2份:一份去除杂质后自然风干、研磨过筛,用于测定土壤化学性质和酶活性;另一份保存于-20℃冰箱及时送样测序。
1.2 土壤化学性质测定
土壤样品化学性质的测定方法参照《土壤微生物研究原理与方法》[16]。采用干燥恒重法(105℃)测定土壤水分含量;按1∶2.5的水土比混合后直接用pH计测定pH值;采用水合热重铬酸钾氧化比色法测定土壤有机质(Soil organic carbon,SOM);采用高效液相色谱法测定全氮(Total nitrogen,TN)凯氏蒸馏法;干燥恒重法(105℃)测定土壤水分;碱扩散法测定速效氮(Available nitrogen,AN);氢氧化钠熔融钼锑反比色法测定总磷(Total phosphorus,TP);碱熔土样后,用Olsen法测定速效磷(Available phosphorus,AP);用原子吸收分光光度法测定全钾(Total potassium,TK);用四苯硼酸钠比浊法测定速效钾(Available potassium,AK)。
1.3 土壤酶活性测定
本研究集中测定过氧化氢酶(Catalase,CAT)、β-葡萄糖苷酶(β-xylosidase,βG)、脲酶(Urease,URE)、碱性磷酸酶(Alkaline phosphatase,ALP)和蔗糖酶(Sucrase,SUC)5种酶活性,其中,土壤过氧化氢酶活性与土壤微生物活动相关,土壤蔗糖酶常用来表征土壤熟化程度和肥力水平,脲酶活性常被用来表征土壤氮素状况[16],β-葡萄糖苷酶主要参与土壤纤维素的降解,碱性磷酸酶能水解土壤磷循环中的重要底物磷酸多糖和磷酸酯[17],土壤酶活性分析采用微孔板荧光法,具体测定步骤和酶活计算公式参照Marx[18]的研究内容。
1.4 土壤细菌相对丰度和多样性测定
用E.Z.N.A.®Soil DNA Kit试剂盒提取细菌总DNA,琼脂糖凝胶电泳检测DNA质量,紫外分光光度计对DNA进行定量。使用341F (5′-CCTACGGGNGGCWGCAG-3′)和805R (5′-GACTACHVGGGTATCTAATCC-3′)引物来PCR扩增16S rDNA(V3+V4)可变区。PCR扩增产物经2%琼脂糖凝胶电泳进行检测,并对目标片段进行回收,回收采用AxyPrep PCR Cleanup Kit回收试剂盒。使用AMPure XT beads (Beckman Coulter Genomics,USA)将PCR产物纯化,Qubit (Invitrogen,USA)定量。分别使用Agilent 2100生物分析仪(Agilent,USA)和Illumina (Kapa Biosciences,USA)的文库定量试剂盒评估扩增子文库的大小和数量,在NovaSeq PE250平台上对库进行排序,使用QIIME2[19]的feature-classifier插件进行序列比对及物种注释,比对数据库为SILVA (https://www.arb-silva.de/)和NT-16S (ftp://ftp.ncbi.nlm.nih.gov/blast/db/nt.gz)数据库。数据已上传NCBI数据库(Bioproject:PRJNA734445)。测序工作由杭州联川生物技术股份有限公司完成。
1.5 数据处理
采用Microsoft Excel 2016对数据进行整理,采用IBM SPSS statistics 26软件进行单因素方差分析和显著性检验。使用QIIME2计算细菌β多样性、使用PCoA分析不同生草处理土壤微生物群落结构差异。通过线性判别(LDA)效应法(LEfSe)分析不同生草处理之间具有显著差异的物种。利用Canoco5.0软件对土壤细菌群落和环境因子进行了RDA冗余分析。利用Graphpad prism 8和R(v3.6.1)ipraph软件包绘制相关网络图和热图。使用R(v3.6.1)random forest包进行随机森林分析。利用PICRUSt2软件对不同牧草处理下土壤细菌的功能特性进行了预测,新推出的PICRUSt2预测软件获得的结果可以很好地匹配土壤细菌功能[20]。
2 结果与分析
2.1 不同生草处理对果园土壤养分及酶活性的影响
由表1可知,和CK相比,GM,MO,LP处理后土壤pH值显著降低(P<0.05),而SOM含量显著升高(P<0.05),其中三种生草处理SOM含量分别提高7.6%,11.4%,10.9%。GM与MO处理的TK含量显著高于CK处理(P<0.05),而AK含量显著低于CK与LP处理(P<0.05)。GM处理的AP含量显著高于其他3种处理(P<0.05)。不同处理的AN,TP,TN含量差异不显著。猕猴桃果园生草处理的土壤βG,CAT,URE含量均有提升,其中GM和MO处理的CAT和URE含量相对CK处理显著升高(P<0.05),MO和LP处理的βG含量显著升高。不同处理的ALP含量差异不显著。

表1 不同生草处理样地的土壤养分与酶活性
2.2 不同生草处理对果园土壤细菌群落组成结构影响分析
扩增细菌16S rDNA基因的V3-V4区后,通过高通量测序分析了群落的结构和组成。对于整个采样集(12个土壤重复样),使用Illumina HiSeq分析鉴定出总共999 126个序列(原始标签),平均长度41.63 M。对原始下机数据进行双端拼接、质量控制、嵌合体过滤后,获得了949 508个高质量序列(纯净标签)。最终,在所有样品中共发现763 248个已处理序列(有效标签),占总定量序列的76.4%,测序量符合分析要求。如图1所示,在所有样本中主要的门是变形菌门(Proteobacteria),平均占总序列的38.8%,其次分别为酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)和芽单胞菌门 (Gemmatimonadetes),分别占总序列的23.1%,9.6%和7.7%。

图1 门水平物种组成柱状堆叠图
2.3 不同生草处理对果园土壤细菌多样性分析
采用方差分析Anosim(Analysis of similarities)非参数检验比较各组细菌β多样性的差异。不同分组因素对样本差异的解释度R值为0.299,分组显著性P值为0.015,达到显著水平,说明组间差异显著大于组内差异,试验设计分组合理可靠。通过比较不同生草处理间的距离发现(图2b),GM,MO和LP处理的β多样性区别于CK处理。主坐标分析(Principal coordinate analysis,PCoA)(图2a)可以很好地区分生草处理与清耕处理,不同处理之间的距离差异可以用PCoA两轴解释,PCoA1轴解释度为32.7%,PCoA2轴解释度为15.3%,说明生草处理改变了果园土壤细菌的群落结构。

图2 不同处理细菌β多样性分析
2.4 利用随机森林算法对不同果园生草细菌群落结构重要菌属分析
采用随机森林算法(Random Forest)分析了不同生草处理下影响土壤细菌群落结构的重要细菌属。该算法通过基尼(Gini)指数计算各变量对分类树各节点观测值异质性的影响,从而比较各变量的重要性。值越大,变量的重要性就越大。对GM,MO,LP,CK四种处理细菌组成通过随机森林分析,找出区分不同处理间差异的关键成分得出了不同生草处理对土壤细菌群落多样性的影响。不同生草处理间的差异代表种存在着明显的差别,在门水平上(图3a),主要为厚壁菌门(Firmicutes)、匿杆菌门(Latescibacteria)和浮霉菌门(Planctomycetes);在属水平上,可鉴定的菌属则以Stenotrophobacter属、Bauldia属、Kofleria属为主。
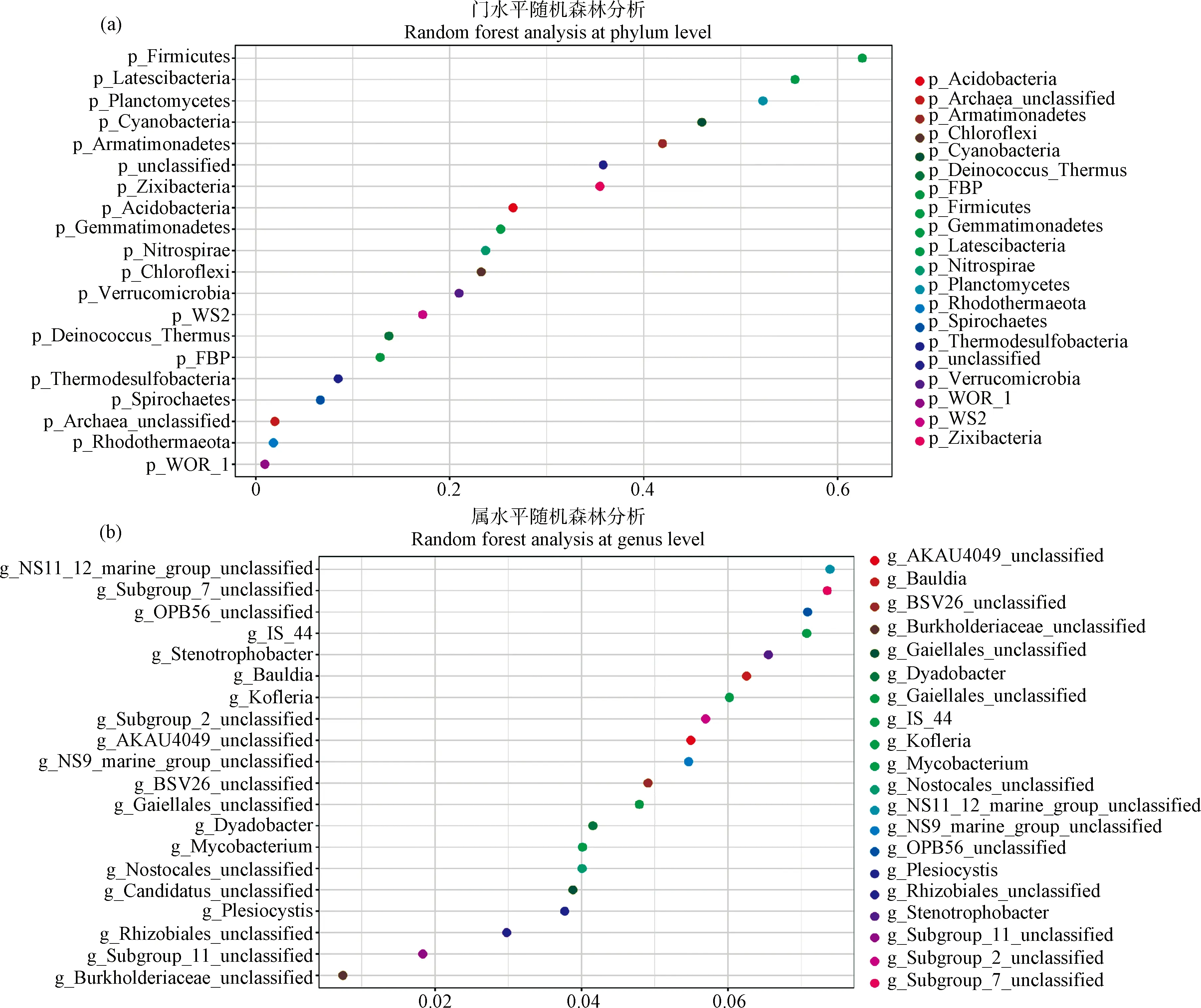
图3 门与属水平土壤细菌群落随机森林算法分析
2.5 对不同果园生草细菌群落结构的LEfSe差异分析
采用线性判别分析效应大小方法(LEfSe)对不同类群中的主要细菌进行了定量分析,进一步阐明了土壤样品中鉴定出的细菌分支之间可能存在的相互作用。结果表明,不同土壤类群细菌丰度差异显著(LDA>3.6,P<0.05)。在所有土壤样品中共鉴定出65种特异菌群。在GM-CK的所有分类水平中,GM处理中筛选出11个特异菌群,CK处理中筛选出10个特异菌群(图4)。GM组中,芽孢杆菌门的丰度较高(LDA=4.32,P=0.04),主要为芽单胞菌科。浮霉菌门(LDA=4.14,P=0.04)和变形菌门(LDA=4.09,P=0.04)是MO-CK数据集中发现的特异菌群。LP-CK中的芽单胞菌门和变形菌门是主要差异菌群,LDA值分别为4.38和4.07。
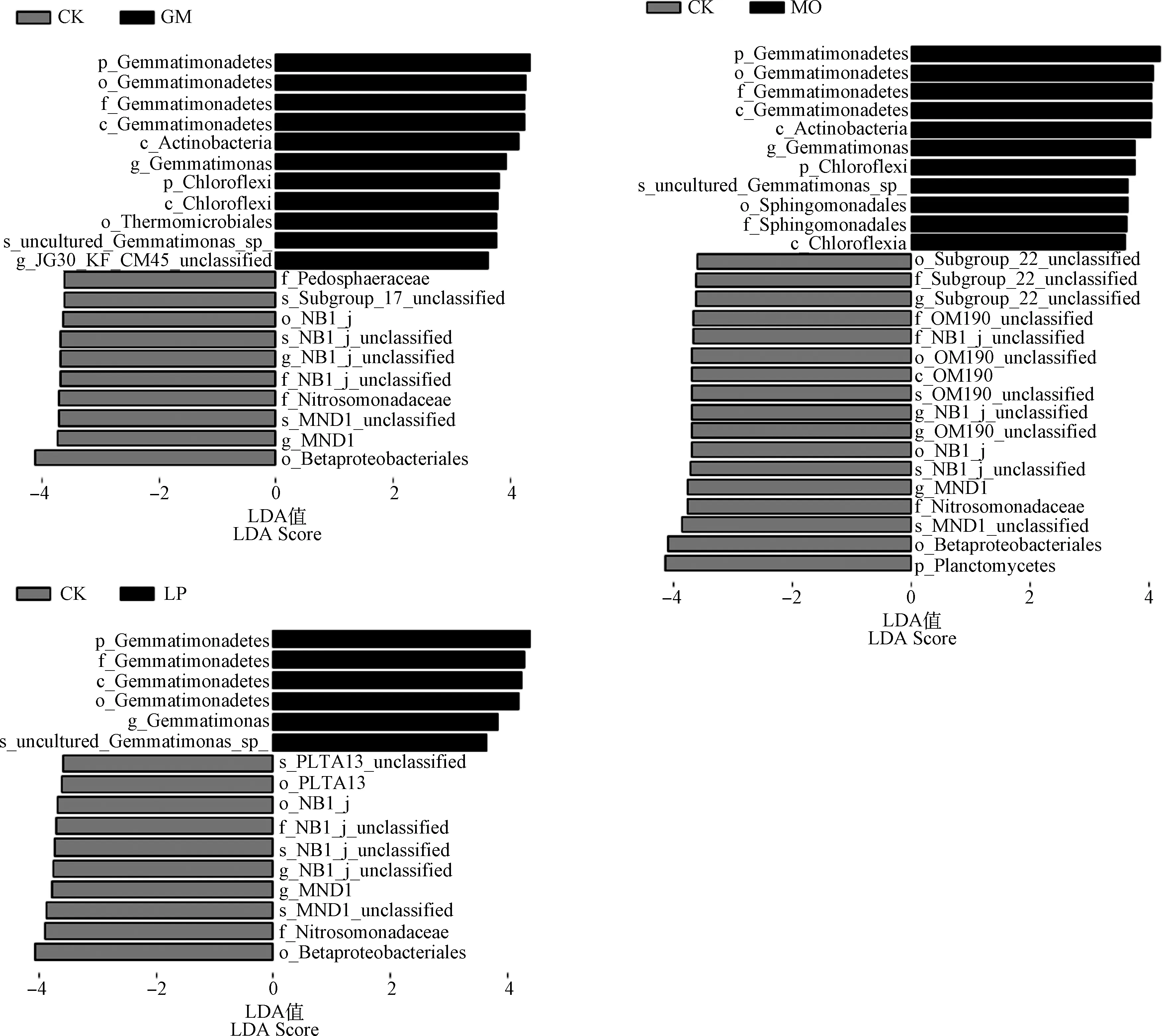
图4 各处理间土壤细菌群落组成的LEfSe分析(线性判别分析得分值大于3.6)
2.6 细菌群落结构与土壤养分的关联性分析
在门水平上对土壤细菌群落结构与环境因子进行关联性冗余分析(Redundancy analysis,RDA),结果显示第一主坐标轴解释了58.2%的变异,第二主坐标轴解释了17.1%的变异,前两轴总共解释了75.3%的变异(图5a),表明前两轴能够反映细菌门水平与土壤环境因子关系的绝大部分信息。将所测得的环境因子对土壤细菌物种多样性的解释度从大到小排列为:SUC>pH>CAT>AK>βG>TK>AP>SOM>URE。通过斯皮尔曼(Spearman)关联系数计算表明(图5b),相比于其他土壤性质,河床菌门(Zixibacteria)丰度与土壤有机质、过氧化氢酶、脲酶、β-葡萄糖苷酶极显著负相关(P<0.01);蓝藻细菌门(Cyanobacteria)丰度与有机质呈极显著正相关,与速效钾呈极显著负相关(P<0.01);芽单胞菌门(Gemmatimonadetes)丰度与pH值呈极显著负相关(P<0.01);匿杆菌门(Latescibacteria)丰度与有机质、β-葡萄糖苷酶呈极显著负相关(P<0.01);厚壁菌门(Firmicutes)丰度与β-葡萄糖苷酶呈极显著负相关(P<0.01)。

图5 土壤细菌群落结构与环境因子的关联性分析
2.7 PICRUSt2细菌群落功能预测分析
利用PICRUSt2软件预测不同生草处理土壤细菌功能特征,将高通量测序结果得到的OTU丰度特征与京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)注释基因数据库比对,得到所有样本在二级代谢通路共有39个(图6)。注释到膜转运功能(Membrane transport)、能量代谢(Energy metabolism)和碳水化合物代谢(Carbohydrate metabolism)的基因家族最多,所占百分比分别为12.2%,6.6%和6.3%。同时,研究也关注了三级代谢通路,注释到分泌系统(Secretion system)、转运(Transporters)、和双组分调节系统(Two-component system)最多,所占百分比分别为5.8%,3.3%,3.0%,其中4组处理间泛醌和其他萜类醌的生物合成(Ubiquinone and other terpenoid-quinone biosynthesis)、β-内酰胺抗性(Beta-Lactam resistance)、氯环己烷和氯苯降解(Chlorocyclohexane and chlorobenzene degradation)、RNA降解(RNA degradation)代谢通路存在显著差异(P<0.05),这些代谢特征反映了生草处理对土壤细菌群落功能的不同调控。
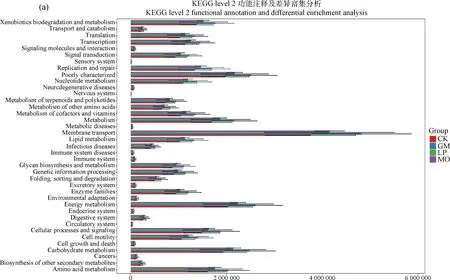
图6 KEGG功能注释及差异富集分析功能注释及差异富集分析
3 讨论
3.1 果园生草对土壤养分与酶活性的影响
在本研究中,相比于清耕处理,三种生草处理均显著提高了土壤有机质含量,这与Qian等人研究结果一致[21],其认为生草栽培能显著提高果园表层土壤有机质含量。猕猴桃树在土壤pH值为6.5~7.0的环境中生长良好[22],本研究中生草处理的土壤pH值也得到了改善,该结果与王依等在秦岭北麓猕猴桃园研究结果一致[23]。土壤酶类参与土壤中各种生化反应,主要影响有机物质分解、营养物质循环和能量转移。本试验中三种生草处理组土壤过氧化氢酶、脲酶含量均有提升,这与Zheng[24]、潘介春[25]、左玉环等[26]研究结果一致。而碱性磷酸酶差异并不显著,草木樨处理的土壤蔗糖酶含量甚至低于清耕处理,说明生草处理对不同土壤酶活性的影响各不相同,需要长时间才能达到积极的效果[27]。
3.2 果园生草对土壤细菌多样性的影响
土壤细菌是陆地生态系统的重要组成部分,在土壤养分转化、循环等生化过程中发挥着重要作用。土壤细菌在许多土壤化学过程中起着重要作用,参与土壤碳氮循环、有机质分解、土壤团聚体和腐殖质形成。它们还与植物有各种共生和寄生关系[6]。果园生草使土壤细菌组成发生显著变化,本研究中的三种生草处理与清耕处理的细菌组成存在显著差异,果园生草能提高土壤细菌物种丰富度,在生草植被凋落物降解过程中,与植物有机质降解有关的土壤细菌数量增加,土壤细菌群落多样性增加[28]。本研究中,土壤细菌主要为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)和芽单胞菌门(Gemmatimonadetes),这和其他果园生草覆盖的研究结果类似[29-31]。根据细菌的营养生活史来看,酸杆菌门(Acidobacteria)多属于寡养菌(k-strategists),主要分解难分解的碳。它们通常生长缓慢,主要生活在营养不良的环境中。而芽单胞菌门(Gemmatimonadetes)是一种植物促生菌,通过与植物根系的相互作用,进行生物固氮,诱导植物分泌植物激素,促进植物生长,此菌门已从众多植物中被分离出来[32-33]。
相较于清耕,秣食豆和黑麦草处理中纤维杆菌门丰度均有提高,在属水平的丰度热图中,大部分细菌为现阶段无法培养的菌属,必须通过同源分析才可确定具体功能。β多样性分析显示,不同处理间组间差异显著大于组内差异,生草处理β多样性显著高于清耕处理。通过随机森林算法分析,我们发现不同处理间细菌差异的关键成分,其中厚壁菌门、匿杆菌门和浮霉菌门是生草组间差异代表物种,可以分别作为不同生草处理下的生物标记物,然而,其在群落中的丰富度并不是主要的,因此我们需要重新思考菌群丰度与其在环境中的重要性之间的关系[34]。厚壁菌门菌种能表达糖基水解酶,参与纤维素和半纤维素的降解[35],因此生草覆盖可以通过植被降解为厚壁菌门的生长提供碳源,这与前人的研究结果一致。
本研究中,细菌主要参与了膜转运功能、能量代谢功能和碳水化合物代谢功能。相比于清耕处理,生草处理使植被多样性升高,植被凋落物、残体和根系分泌物发生改变[9],从而导致细菌膜转运和代谢功能出现差异,说明果园生草处理对土壤细菌功能基因产生显著影响,对优化细菌群落结构有一定的作用。
4 结论
在关中平原有机猕猴桃园的三种生草处理均提高了土壤有机质和β-葡萄糖苷酶含量,改善了土壤pH值,草木樨与秣食豆处理提高了土壤全钾、过氧化氢酶和脲酶含量。说明生草处理能够提高有机猕猴桃园土壤养分,改良土质。生草处理同时改变了猕猴桃园土壤细菌群落之间的物种群落结构。同时,对细菌代谢通路的分析反映出土壤细菌对不同生草处理的响应与反馈机制存在差异。综上,关中平原有机猕猴桃园种植草木樨、秣食豆和黑麦草可显著提高土壤有机质和养分含量,改善土壤微生态环境,其中草木樨和秣食豆改良效果尤佳。
