三氯化铁分解重铬酸钾滴定法测金属化球中金属铁和氧化亚铁的含量
2022-01-08邢文青张世欢黄合生尚聪亚
邢文青,张世欢,黄合生,尚聪亚
(广东韶钢松山股份有限公司,广东 韶关 512123)
1 前言
金属化球是韶钢25 万t 处理含锌尘泥环保综合利用项目主要产品之一,金属化球的质量由金属化率来衡量,金属化率是试样中金属铁占试样全铁的百分数,因此金属铁的含量是金属化球质量的主要指标,准确测定金属铁含量至关重要。金属化球的金属铁含量在20%~75%,氧化亚铁的含量在10%~40%。金属铁测定方法有:汞盐浸出-重铬酸钾滴定法、碘乙醇浸出-EDTA 滴定法、硫酸铜溶解-重铬酸钾滴定法、三氯化铁-乙酸钠滴定法和氯化铁溶解-重铬酸钾滴定法[1-6]。汞盐浸出-重铬酸钾滴定法数据稳定,抗干扰性强,因HgCl2毒性大,已基本停止使用。碘-乙醇法Fe3+与EDTA 的络合反应会形成褐色沉淀,不适合于金属铁含量高的试样;硫酸铜法因会诱导游离氧化亚铁的溶解,有一定的局限性;三氯化铁-乙酸钠滴定法适合质量分数为0.15%~3.0%的铁矿石、球团矿的金属铁测定,不适合金属化球中金属铁的检测;直接还原铁金属铁含量的测定三氯化铁分解重铬酸钾滴定法,操作简单结果可靠,只单独测定金属化球中金属铁,无法满足生产需及时掌握金属化球中金属铁和氧化亚铁的含量要求。
本文通过对影响三氯化铁分解重铬酸钾滴定法测定金属化球中金属铁和氧化铁的分析条件进行优化,建立了测定金属化球中金属铁和氧化亚铁含量的分析方法,该方法快速简便,适用于日常的检测。
2 实验部分
2.1 主要仪器设备及化学试剂
仪器:天平,电炉,磁力搅拌器。
化学试剂。三氯化铁,100 g/L,静置过夜;碳酸氢钠;碳酸氢钠溶液,10 g/L;氟化钠;盐酸,ρ3.19 g/mL,分析纯;氯化锡溶液,60 g/L,以(1+1)盐酸溶解(当天配制);钨酸钠溶液,250 g/L;三氯化钛,15 g/L;二苯胺磺酸钠,5 g/L;钨酸钠溶液,250 g/L;硫磷混酸(3∶3∶14):于700 mL 水中,边搅拌边加入150 mL 磷酸(ρ2.70 g/mL),再加15 mL 硫酸(ρ2.84 g/mL),混匀,流水冷却;硫酸亚铁铵溶液,20 g/L;重铬酸钾标准溶液c(1/6K2Cr2O7)=0.015 mol/L,准确称取7.350 g基准重铬酸钾(150 ℃烘干2 h),置于250 mL烧杯中,加水溶解后移入1 000 mL容量瓶中,稀释至刻度,充分混匀;重铬酸钾标准溶液c(1/6K2Cr2O7)=0.005 mol/L,准确称取2.450 g 基准重铬酸钾(150 ℃烘干2 h),置于250 mL烧杯中,加水溶解后移入1 000 mL 容量瓶中,稀释至刻度,充分混匀。分析中除另有说明外,仅使用认可的分析纯试剂和符合GB/T 6682规定的三级水。
2.2 实验方法
称取0.2 g试料,精确至0.000 1 g。将试料置于300 mL 锥形瓶中,加入40 mL 三氯化铁溶液(2.7),立即塞上胶塞,置于搅拌器上旋转30 min,用中速滤纸加纸浆过滤于500 mL 锥形瓶中,用水洗涤锥形瓶及残渣8~10 次,体积约150~200 mL。滤液用于测金属铁,残渣用于测氧化亚铁。随同试料做空白实验。
2.2.1 金属铁的检测
在滤液中加入20 mL 硫磷混酸,5 滴二苯胺磺酸钠,用重铬酸钾标准溶液滴至紫红色为终点。
2.2.2 氧化亚铁含量检测
将残渣及滤纸放入原锥形瓶中,加入1~2 g碳酸氢钠固体,加入0.5~1 g 氟化钠固体,30 mL 盐酸,迅速盖上陶瓷盖,加热溶解完全至体积约10~15 mL取下,立即加入碳酸氢钠溶液60 mL,流水冷却至室温;取下锥形瓶上陶瓷盖,立即加入20 mL硫磷混酸,加入3~5滴二苯胺磺酸钠作指示剂,用重铬酸钾标准溶液至紫红色为终点。
3 结果与讨论
3.1 试样预处理条件的确定
3.1.1 三氯化铁溶液的用量、试料搅拌时间、试料量正交实验
三氯化铁溶液的用量、试料搅拌时间、试料量多少决定于试料中金属铁能否被三氯化铁溶液完全溶解,为此选取一份MFe质量分数为50%的金属化球,对三氯化铁溶液的用量、试料搅拌时间、试料量3个因素设计3个水平,见表1。

表1 正交实验3水平3因素
按L9(34)设计正交实验探究金属铁测定的条件实验,正交实验方案见表2。按表2 对MFe 质量分数为50%的金属化球进行处理过滤、滤液调节酸度,以二苯胺磺酸钠为指示剂,用重铬酸钾标准溶液滴定,根据所消耗的标准溶液体积计算金属铁的质量分数。
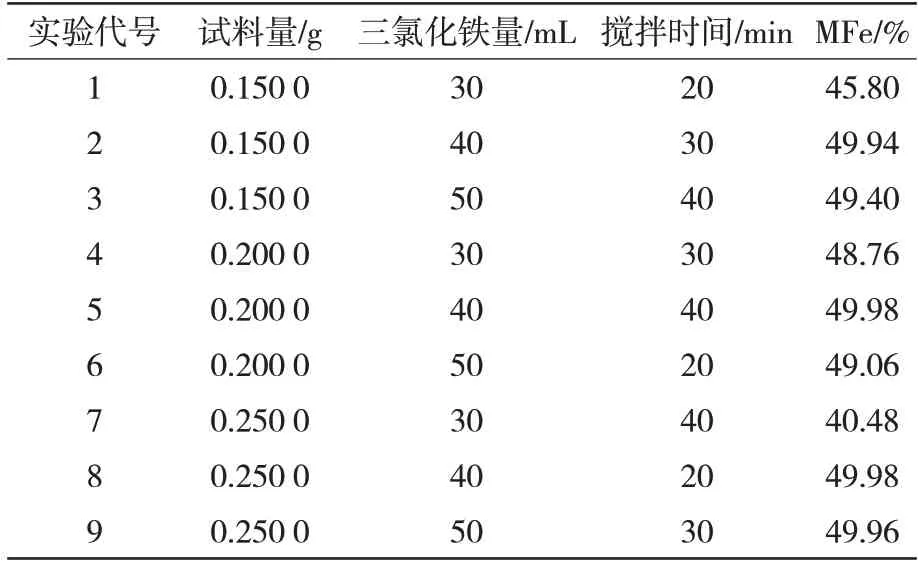
表2 正交实验结果
用Mintab 软件对正交分析数据进行分析得出的结果见表3,各因素中影响最大的水平从正交表数据处理中可以看出,三氯化铁量的极差R最大,其次是搅拌时间,试料量的极差最小。所以三氯化铁用量的影响最显著。
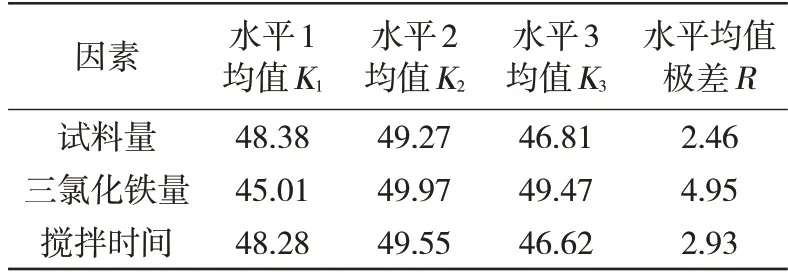
表3 正交实验结果分析
所有因素中都是K2较大,因此试样最佳的试料量为0.200 0 g,三氯化铁加入量为40 mL,搅拌时间为30 min。
3.1.2 滤纸及清洗速度的选择
称取9 份0.200 0 g 的MFe 质量分数为50%的金属化球试料分别置于300 mL 三角锥瓶,各加入40 mL 三氯化铁,并搅拌30 min 后开展以下实验:3份用快速定量滤纸过滤,3份用中速定量滤纸过滤,3份用慢速定量滤纸,处理后用同一条件实验,结果见表4。由此可知用定量中速滤纸时,平行性测定R最小,结果重复性好。
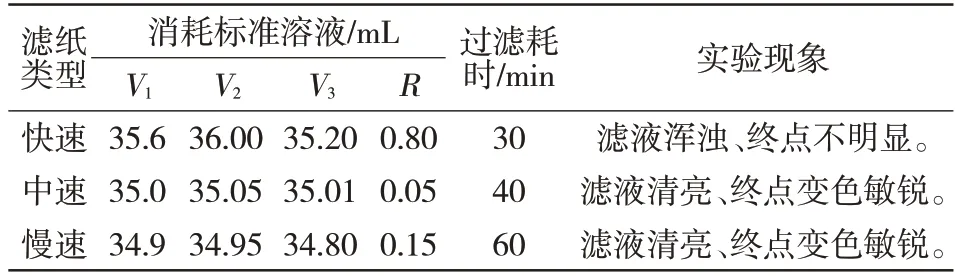
表4 滤纸对检测结果的影响
3.1.3 样品粒度的选择
实验选用已多次测量的金属化球(质量分数为43.58%)留样。根据规定的方法制备不同粒径的样品,并根据实验方法进行测定,实验结果见表5。结果表明,当样品粒径较大时,测得的铁含量稳定性较差。当试样的粒径为0.125 mm时,金属铁检测结果重复性好,粒度过小时因制样过程中使部分金属铁被氧化导致结果偏低。
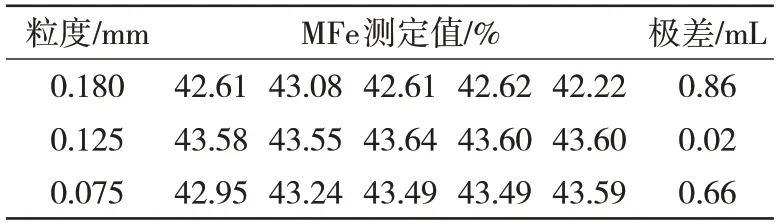
表5 样品粒度对检测结果的影响
3.2 滴定酸度控制
选用已多次测量的金属化球(质量分数为43.58%)留样,试料量为0.2 000 g、三氯化铁加入量为40 mL、搅拌时间为30 min的情况下,按表6中进行硫磷混合酸浓度及加入量实验,结果见表6。从表6 可以看出,加入20 mL(15+15+70)硫磷混合酸时,滴定金属化球中金属铁结果消耗重铬酸钾标准体积的极差最小,结果最稳定。
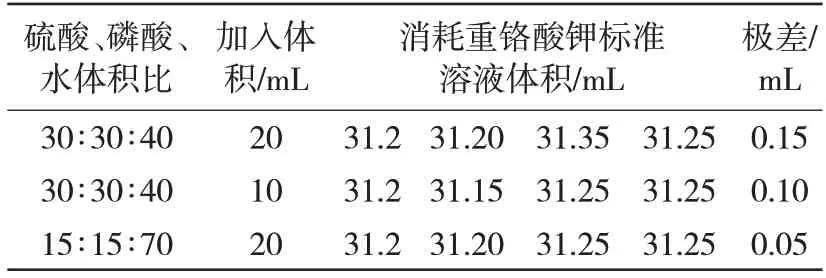
表6 酸度对检测结果的影响
3.3 重铬酸钾标准溶液浓度的选择
选用了已多次测量的金属化球(质量分数为43.58%)留样,使用不同浓度的重铬酸钾标准溶液进行滴定,并根据实验方法进行测定。不同浓度的重铬酸钾标准溶液对金属铁检测,消耗的重铬酸钾标准溶液体积见表7。从表中数据可看出,采用浓度为0.15 mol/L重铬酸钾标准溶液滴定各种金属化球中金属铁结果重复性好,消耗体积控制15~40 mL。
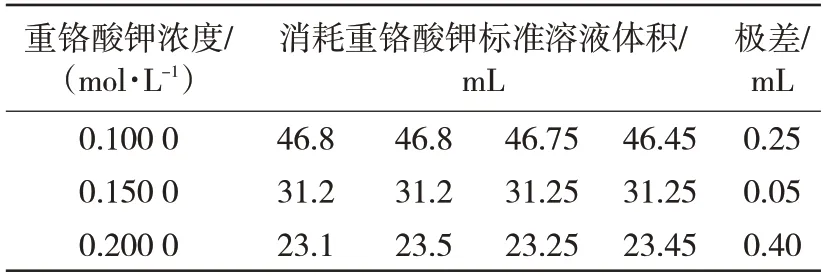
表7 重铬酸钾浓度对检测结果的影响
9个试料的残渣按实验方法进行处理后使用不同浓度的重铬酸钾标准溶液进行滴定。不同浓度的重铬酸钾标准溶液对氧化亚铁检测,消耗的重铬酸钾标准溶液体积见表8,从表中数据可以看出,采用浓度为0.05 mol/L重铬酸钾标准溶液滴定各种金属化球中氧化亚铁结果重复性好,消耗体积控制12~40 mL,考虑本法用于分析其他物料,最终选用滴定亚铁的重铬酸钾标准溶液的浓度为0.05 mol/L。
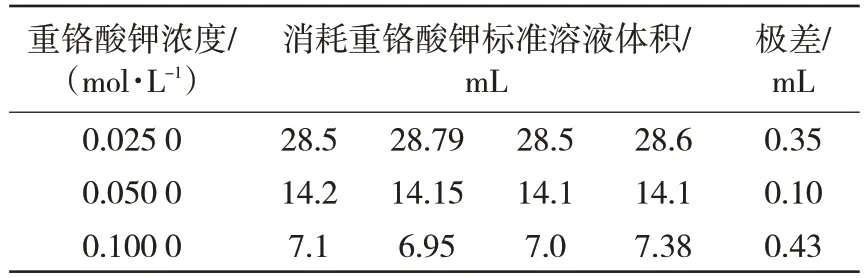
表8 重铬酸钾浓度对亚铁检测结果的影响
3.4 精密度实验
称取金属化球团A、B 各6 份,每份质量为0.200 0±0.000 1 g,按2.2 章节内容进行样品处理,后用重铬酸钾标准溶液滴定,测定金属化球团中金属铁和氧化亚铁,结果见表9 和表10。从表中看出,变异系数CV满足GB/T 27404—2008中要求。
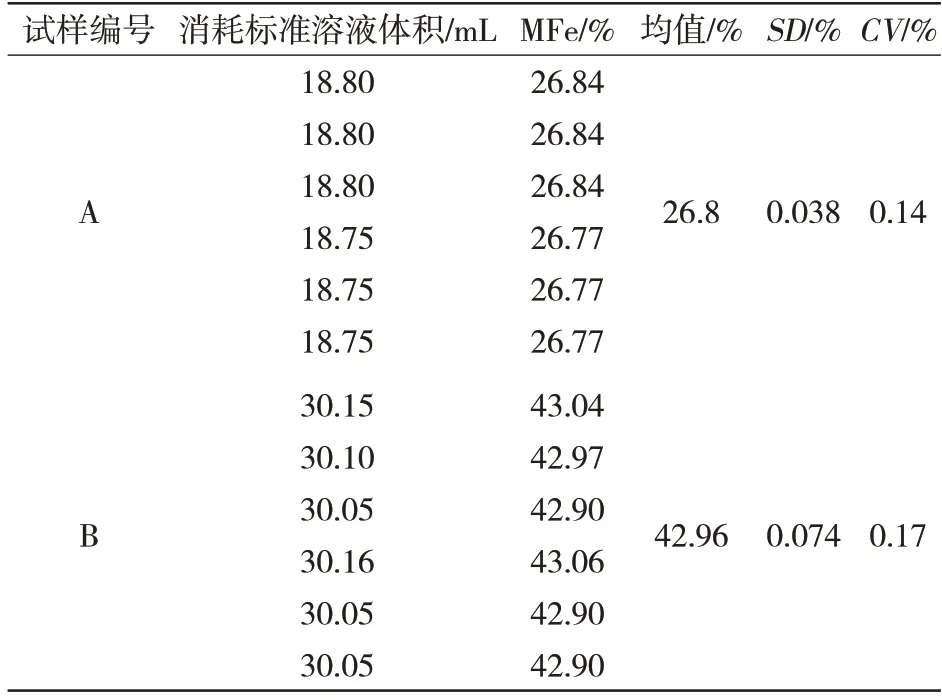
表9 金属化球金属铁精密度数据

表10 金属化球中氧化亚铁精密度分析数据
3.5 回收率实验
按照实验方法,在一份金属化球团(MFe%=26.80)加入添加一定量高纯铁粉(质量分数>99.99%,粒度达到0.125 mm),混合均匀。按照实验方法进行测定,金属铁回收率结果见表11。由表11 可知,方法的回收率符合文献中对回收率实验做出的规定。

表11 MFe回收率实验数据
选取一份金属化球试样加入一定量编号为GSB03-2037-2006(WFeO=25.63%)铁矿石标准样品,混合均匀。按照实验方法进行测定,氧化亚铁回收率结果见表12。回收率符合文献中对回收率的规定。
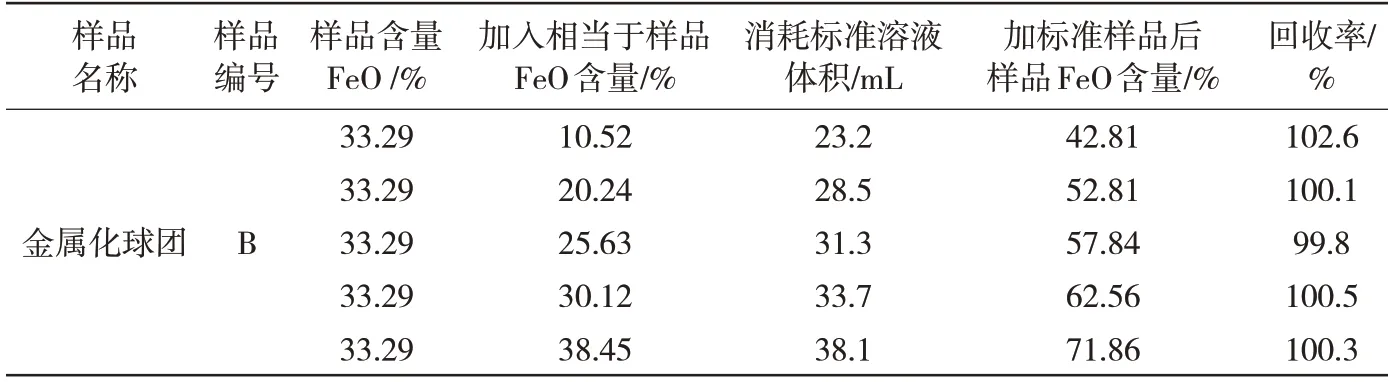
表12 氧化铁回收率实验数据
3.6 本方法金属铁测量能力评价
因没有金属化球标准物质,按(MSA)对方法的测量能力进行评定。随机抽取10份金属化球样品由化验员A、B、C 按确定的实验方案进行实验,判定准则:%GRR<10%,可接受;%GRR 为10%~30%,可能可接受(分析/检讨);%GRR>30%,不可接受(分析/改善);并且ndc≥5。实验数据见表13,分析数据见表14。
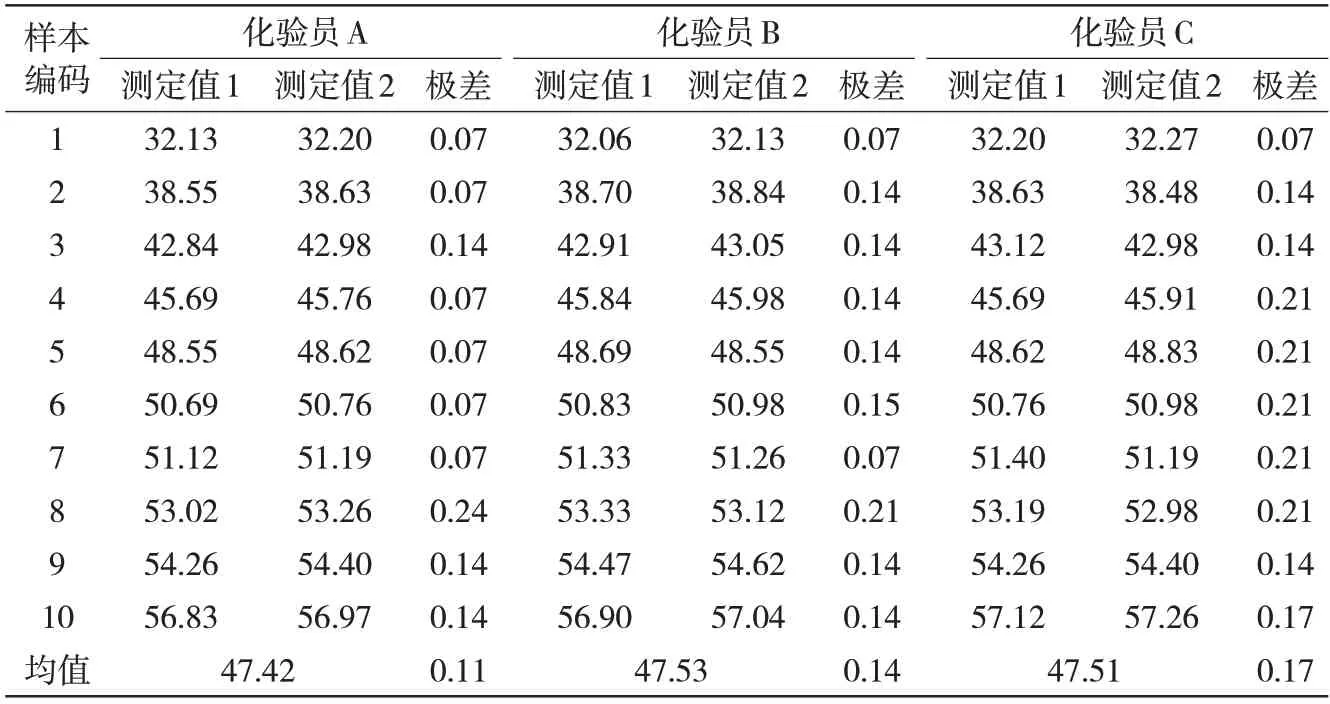
表13 MSA实验数据 %

表14 MSA分析结果
对金属化球中金属铁测定过程系统进行MSA分析,重复性和再现性的%GRR值为1.70%,区别分类数ndc值为83,检测方法可靠。
4 结语
通过用三氯化铁分解重铬酸钾滴定法测定金属化球中金属铁和氧化亚铁含量,探讨了试样预处理、滴定酸度控制、重铬酸钾标准溶液浓度等分析结果的影响,通过实验建立了测定金属化球中金属铁和氧化亚铁含量的分析方法,在样品重量为0.100 0 g,样品粒径<0.125 mm,搅拌时间为40 min,氯化铁溶液浓度和用量为100 g/L和40 ml时,三氯化铁溶液分离-重铬酸钾滴定法测定金属化球团中金属铁和氧化亚铁,方法的实验室变异系数CV分别为0.17%、0.58%。该方法快速简便,方法可适用于金属化球中金属铁和氧化亚铁的常规测定。
