CTRP1、HMGB1、CAM水平变化与脑卒中患者神经功能损伤程度的关系研究
2022-01-08钱晶谷丽丽
钱晶,谷丽丽
(河南省直第三人民医院 神经内科,河南 郑州 450000)
脑卒中的发生,能够导致患者短期内致残率和不良临床结局发生率的上升,从而增加患者的多器官功能障碍风险[1]。部分研究者认为,脑卒中的发病率可超过475/1 万人左右,部分高危地区脑卒中的发病率可进一步的上升[2]。临床上对于脑卒中患者的病情评估具有重要的意义,对于神经功能的评估,能够在疾病的治疗及临床预后随访方面发挥重要的作用。血清学炎症性相关因子,能够在病情的进展及临床预后随访方面发挥作用。肿瘤坏死因子相关蛋白(CTRP1)能够通过诱导炎症反应,加剧瀑布式炎症反应的激活,进而促进脑组织的炎症性损伤,加剧脑功能的障碍[3];高迁移率族蛋白1(HMGB1)能够通过诱导趋化因子的富集,募集炎症因子的沉积,进而促进脑组织的损伤和功能的障碍[4];钙调蛋白(CAM)的表达改变,能够通过影响到神经元细胞内钙离子的超载,进而诱导神经元细胞的线粒体损伤,促进神经元的凋亡[5]。为了揭示CTRP1、HMGB1、CAM 的表达及其与脑卒中患者的神经功能障碍的关系,本次研究选取选取2019 年6 月至2020 年6 月在河南省直第三人民医院接受治疗的脑卒中患者为研究对象,探讨了CTRP1、HMGB1、CAM 的表达情况,并分析了相关指标与脑卒中患者的病情关系。
1 资料与方法
1.1 一般资料
选取2019 年6 月至2020 年6 月河南省直第三人民医院收治的92 例脑卒中患者,设为观察组,其中男50 例,女42 例;年龄54~75 岁,平均(63.74±4.33)岁。纳入标准:①年龄≥50 周岁;②经CT 或相关检查确诊为脑卒中;③无其他系统严重疾病者;④均为首次发病。排除标准:①临床资料不全者;②合并其他严重基础疾病者;③死亡病例。另选取来院体检的健康人士92 例作为对照组,其中男51 例,女41 例;年龄52~78岁,平均(63.86±4.45)岁。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。本项研究经医院伦理委员会评审通过,且所有参与者均知情同意。
1.2 方法
取受试者静脉血4 mL,1 500 r/min 离心15 min,取上清液,在每个聚苯乙烯板中加入上述液体0.1 mL,4℃过夜孵育,加入磷酸盐缓冲液(PBS)洗涤3 次,每次3 min,在每个聚苯乙烯板孔中加入CTRP1、HMGB1、CAM 抗体(1∶800,购自南京伯斯金生物公司),37℃孵育30 min,加入PBS 洗涤3 次,3 min/次,每孔中加入四甲基联苯胺(TMB)溶液底物0.1 mL,37℃,20 min,加入2 M 硫酸0.05 mL 终止反应,采用Varioskan LUX 多功能酶标仪(上海赛默飞世尔科技有限公司)进行OD 值检测。
1.3 评价指标
观察两组研究对象CTRP1、HMGB1、CAM 水平,分析脑卒中患者CTRP1、HMGB1、CAM 与神经功能损伤程度的相关性。神经功能损伤程度采用美国国立卫生研究院卒中量表(NIHSS)评估(均在入院时完成):小于7 分:轻型神经功能缺损;7~15 分:中型神经功能缺损;大于15 分:重型神经功能缺损。患者出院后第三个月月底进行电话随访,并采用改良的Rankin 量表(MRS)评估患者预后,满分5 分,≤2 分预后良好,>2 分预后不良。
1.4 统计学方法
采用SPSS 20.0 软件对数据进行分析。计数资料以例表示;计量资料以均数±标准差(±s)表示,采用t检验和F检验(两两比较采用LSD-t检验)。相关性采用Pearson 相关分析法分析。P<0.05 为差异有统计学意义。
2 结果
2.1 两组研究对象CTRP1、HMGB1、CAM 水平比较
观察组患者的CTRP1、HMGB1、CAM 水平均高于对照组,差异有统计学意义(P<0.05),见表1。
表1 两组研究对象CTRP1、HMGB1、CAM 水平比较(n=92,±s)
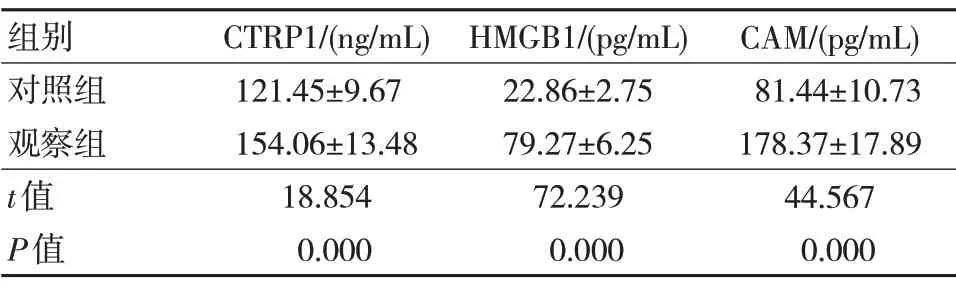
表1 两组研究对象CTRP1、HMGB1、CAM 水平比较(n=92,±s)
2.2 不同神经功能损伤程度患者CTRP1、HMGB1、CAM 水平比较
根据NIHSS 评分将患者分为轻型神经功能缺损39 例,中型神经功能缺损31 例,重型神经功能缺损22 例。不同神经功能损伤程度患者CTRP1、HMGB1、CAM 水平存在明显不同,差异有统计学意义(P<0.05)。见表2。
表2 不同神经功能损伤程度患者CTRP1、HMGB1、CAM 水平比较(±s)

表2 不同神经功能损伤程度患者CTRP1、HMGB1、CAM 水平比较(±s)
2.3 脑卒中患者CTRP1、HMGB1、CAM 水平与神经功能损伤程度的相关性
脑卒中患者的CTRP1、HMGB1、CAM 水平与神经功能损伤程度均呈正相关,差异有统计学意义(r=0.764、0.737、0.801,P<0.05)。
2.4 不同预后患者CTRP1、HMGB1、CAM水平
预后不良组患者29 例,预后良好患者63 例。预后不良组患者CTRP1、HMGB1、CAM 水平显著高于预后良好组,差异有统计学意义(P<0.05)。见表3。
表3 不同预后患者CTRP1、HMGB1、CAM 水平(±s)

表3 不同预后患者CTRP1、HMGB1、CAM 水平(±s)
3 讨论
临床上不同的病理性改变,能够通过诱导脑血管内皮细胞的损伤,加剧粥样斑块的沉积,进而提高脑卒中的发生风险。在具有基础性高血脂症或者动脉管壁硬化的患者中,脑卒中的发病率和病死率可进一步的恶化[6-7]。长期的观察发现,脑卒中患者的总体生存时间较短,其短期内病情变化较快,治疗后的神经功能缺损表现较为明显[8]。而临床上缺乏对于脑卒中患者神经功能缺损的相关评估性指标,虽然影像学指标能够在脑卒中患者的病情评估过程中发挥作用。但部分单中心的临床分析研究可见,磁共振或者头颅CT 检查,对于脑卒中患者神经功能评估的一致性率不足45%,其对于患者病情演变评估的灵敏度较低[9]。本次研究对于脑卒中患者血清中CTRP1、HMGB1、CAM 的表达分析研究,能够揭示脑卒中患者病情进展机理的同时,为临床上脑卒中患者的神经功能缺损评估提供参考。
CTRP1 是炎症性相关因子,其作为肿瘤坏死因子家族成员,能够通过直接诱导神经元细胞的损伤,促进神经元膜完整性的破坏,进而加剧脑组织的功能损伤和神经功能障碍的发生。相关研究还认为,CTRP1 能够在机理上诱导肿瘤坏死因子α 或者白细胞介素-6(IL-6)的富集,进而加剧炎症信号通路的激活,提高脑卒中患者的病情进展速度[10];HMGB1 是趋化因子相关家族成员,其能够诱导补体成分C3、C4 的激活,进而提高其对于脑组织的浸润和损伤作用[11];CAM 是钙离子调控相关蛋白,其能够提高钙离子的内流速度,加剧神经元细胞的钙超载负荷,进一步加剧神经元细胞的破坏[12]。部分研究者探讨了HMGB1 的表达与脑卒中的关系,认为在脑卒中患者中,HMGB1 的表达明显上升,但缺乏对于CTRP1、CAM 的分析研究。
对于脑卒中患者血清中CTRP1、HMGB1、CAM 的分析研究可见,在脑卒中病例组患者中,CTRP1、HMGB1、CAM 的表达浓度均明显上升,高于正常对照组人群,统计学差异较为明显,提示了CTRP1、HMGB1、CAM 的高表达均可能影响到了脑卒中的病情进展。其具体基础方面的机理,可能考虑与CTRP1、HMGB1、CAM 的下列几个方面的病理生理性改变有关[13-14]:①CTRP1 能够诱导肿瘤坏死因子家族成员的激活,提高了下游炎症性信号通路NF-KB 的激活程度,进而促进了脑组织的破坏;②HMGB1 能够提高趋化蛋白的富集,促进其对于脑血管内皮细胞的浸润和损伤,加剧了脑组织的缺血性氧化应激性损伤;③CAM能够提高线粒体钙离子的超载,导致线粒体的功能障碍,加剧了线粒体的功能损伤。沈显群等[15]研究者发现了与本次研究相似的结论,其发现在脑卒中患者中,HMGB1 的表达浓度可明显上升,平均上升幅度可超过35%以上,同时在具有明显的脑功能缺损的患者中,HMGB1 的表达波动更为显著。NIHSS 评分是评估患者脑功能缺损的评分指标,脑卒中患者的相关评分明显的上升,脑功能的缺损较为明显,提示了脑卒中患者的脑功能的障碍,这主要由于脑组织的缺血性损伤,促进了神经元细胞的凋亡,导致神经电冲动传递的异常,进而影响到了脑功能。相关关系分析研究可见,CTRP1、HMGB1、CAM 的表达与脑卒中患者的脑功能评分正相关,预后不良组患者CTRP1、HMGB1、CAM 水平显著高于预后良好组。进一步提示了CTRP1、HMGB1、CAM 的表达与脑卒中患者的病情关系,这主要由于相关指标的波动,能够反应患者神经胶质细胞或者神经元的损伤程度,进而评估病情进展。临床上可以通过检测CTRP1、HMGB1、CAM,分析脑卒中患者脑神经损伤情况,同时预测患者临床结局。
综上所述,在脑卒中患者中,CTRP1、HMGB1、CAM 的表达明显上升,同时CTRP1、HMGB1、CAM 的表达与脑卒中患者的脑功能评分密切相关。后续临床研究可以深入探讨相关指标的诊断学价值。
