核聚集相关蛋白1在肾透明细胞癌中的表达及其临床意义*
2022-01-08刘雷郑双英
刘雷,郑双英
(常德职业技术学院 医学系,湖南 常德 415006)
肾细胞癌(renal cell carcinoma,RCC)是泌尿系统常见的恶性肿瘤,其主要病理类型包括透明细胞癌、乳头状细胞癌、嗜铬细胞癌、集合管癌和未分类癌等[1]。其中,透明细胞肾细胞癌(clear cell renal cell carcinoma,CCRCC)是最常见的类型,约占RCC 总数80%[2]。CCRCC 分子机制尚未完全阐明,其发生与多种基因突变和异常表达有关。FIORENTINO 等[3]发现,APC、ERBB4、RB1、EGFR和FGFR3突变在CCRCC 中十分频繁。CCRCC 起病隐匿,缺乏早期诊断性肿瘤标志物,约有30% 的CCRCC 患者确诊时已发生转移[4]。因此,开发新的肿瘤标志物用于CCRCC 诊断具有重要意义。
核聚集相关蛋白 1(nucleus accumbensassociated protein 1,NAC1)是一种核蛋白,属于BTB/POZ-ZF 结构域家族成员,具有调控细胞增殖、凋亡、转录和细胞形态维持等功能[5]。NAC-1在前列腺癌、卵巢癌中发挥重要作用[6-7]。目前,关于NAC1 表达与CCRCC 关系的研究较少,本研究拟对此进行初步探讨,以期提高CCRCC 早期诊断率,发现新的治疗靶点。
1 资料与方法
1.1 一般资料
选取2016 年1 月至2016 年12 月在常德职业技术学院附属医院连续收集的110 例患者CCRCC组织及邻近正常组织标本。所有患者行根治性肾切除术,未进行放疗、化疗、靶向治疗等新辅助治疗,病理诊断为CCRCC。采集患者临床及病理资料,包括年龄、性别、病理分级、临床分期、复发或转移情况、复发或转移时间及生存时间。其中,男性73 例,女性37 例;平均年龄(57.32±11.05)岁;病理分级:>Ⅱ级20 例,≤Ⅱ级90 例。按照2010 年创立的美国癌症联合委员会TNM 分期将RCC 患者分为Ⅰ~Ⅳ期[8],其中Ⅰ期70 例,Ⅱ期25 例,Ⅲ期12 例,Ⅳ期3 例。平均随访(48.61±14.95)个月后,18 例(16.8%)患者术后复发或转移。其中,16 例(14.5%)患者死于CCRCC 远处转移。平均总生存期(OS)(26.38±6.33)个月,2 年和5 年疾病特异性生存率(DSS)分别为94.5% 和85.5%。第1、2 年每年随访4 次,第3~5 年每年随访2 次。随访内容包括病史采集、体格检查、胸部X 射线检查、腹部多普勒超声或CT 检查交替进行,并根据肾功能血检结果进行肾小球滤过率检查。本研究通过常德职业技术学院附属医院伦理委员会批准,所有受试者签署知情同意书。
1.2 免疫组织化学(IHC)和染色结果评估
切片常规脱蜡脱水,并采用柠檬酸进行抗原修复。随后将切片放入3%过氧化氢溶液中,室温25 min;然后放入PBS(pH 值7.4)中15 min。将BSA(3%,美国Sigma 公司)均匀加入组织中,室温下密封30 min。用抗NAC1 抗体(ab8192,美国Abcam 公司)(1∶200 稀释)在4℃下孵育8 h,再用二抗(HRP-conjugated Goat Anti-Mouse IgG,武汉塞维尔生物科技有限公司)在室温下孵育50 min。然后将所有切片用DAB 处理5 min,随后用苏木精-伊红反染;最后将切片分别置于无水乙醇和二甲苯中进行脱水处理。
每组中的每个切片随机选择>3 个200 倍视野进行摄影。用Image-Pro Plus 6.0(Media Cybernetics,Inc.,Rockville,MD,美国)计算组织的综合光密度(IOD)和像素面积(AREA),平均密度(MD)等于IOD 除以AREA。NAC1 表达由两位病理学家根据IHC 图像和相应的MD 值进行量化。
1.3 统计学方法
数据分析采用SPSS 23.0 统计软件。相关样本Wilcoxon 符号秩检验用于分析癌组织与相邻组织间NAC1 表达的差异,独立样本Wilcoxon signedrank 检验用于比较不同临床病理特征的CCRCC 组织间NAC1 表达情况;采用Kaplan-Meier 生存曲线和Log-rank 检验分析NAC1 表达与CCRCC 患者预后关系,采用Cox 回归的单因素和多因素分析来评估CCRCC 患者预后的危险因素,P<0.05 为差异有统计学意义。
2 结果
2.1 免疫组织化学检测NAC1 在CCRCC 中表达
分别分析CCRCC 组织和相邻组织的染色情况,阳性染色强度分别定义为0、1、2、3 为无染色、浅黄色、黄褐色和棕色(见图1、图2)。CCRCC 组织中NAC1 平均表达量为(1.06±0.88),相邻组织为(1.91±1.02)。相关样本Wilcoxon 符号秩检验显示,NAC1 在CCRCC 组织中表达量低于相邻组织,差异有统计学意义(Z=6.040,P<0.001)。
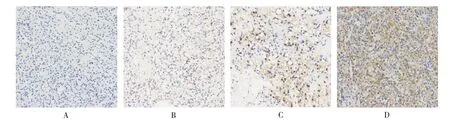
图1 CCRCC 组织中NAC1 的表达
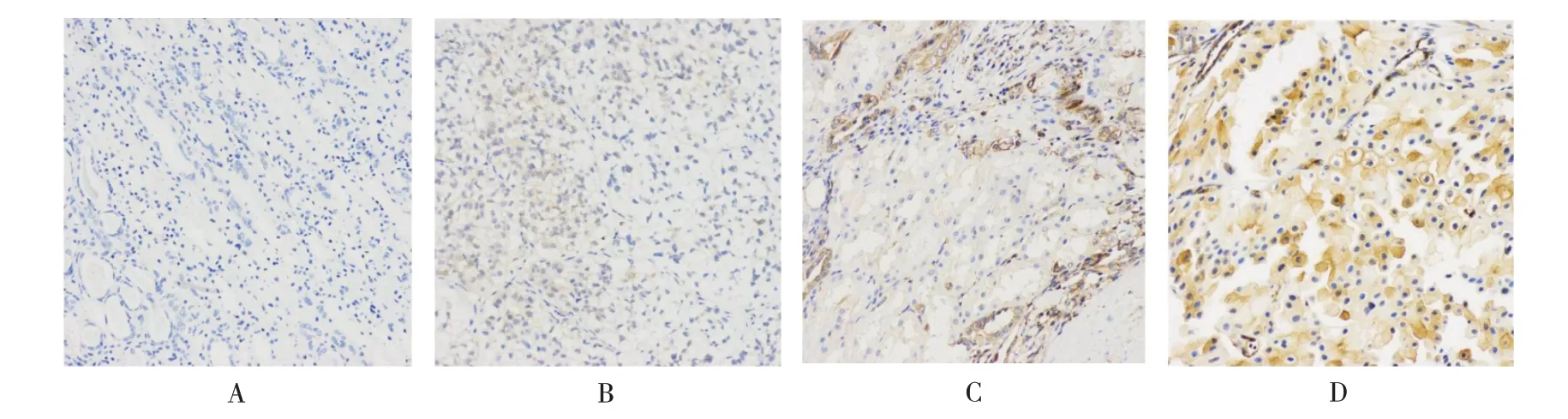
图2 CCRCC 癌旁正常组织中NAC1 的表达
2.2 CCRCC 中NAC1 表达与临床病理特征的关系
采用独立样本Wilcoxon 符号秩检验比较不同年龄、性别、肿瘤病理分级和TNM 分期的NAC1表达情况。结果显示NAC1 表达与肿瘤病理分级相关,差异有统计学意义(P<0.05);病理分级为≤Ⅱ级患者NAC1 表达量高于>Ⅱ级患者,差异有统计学意义(P<0.05)。但NAC1 在CCRCC 中表达与年龄、性别和TNM 分期无关,差异无统计学意义(P>0.05)。见表1。
表1 CCRCC 中NAC1 表达与临床病理特征的关系(±s)

表1 CCRCC 中NAC1 表达与临床病理特征的关系(±s)
2.3 NAC1 表达与CCRCC 预后的关系
本研究110 例患者中,16 例患者死于CCRCC远处 转移,OS 为(26.38±6.33)个月。根据NAC1 表达,将患者分为NAC1 低表达组和NAC1高表达组。Kaplan-Meier 生存率和对数秩检验显示,NAC1 高表达组预后优于NAC1 低表达组,差异有统计学意义(P<0.05)见图3。

图3 Kaplan-Meier 曲线分析NAC1 表达与癌症特异性生存率的关系
采用Cox 回归单因素和多因素分析评估CCRCC 预后的风险因素,单因素Cox 回归分析显示,病理分级、TNM 分期和NAC1 表达是RCC 预后的风险因素(P<0.05)。多因素Cox 回归分析显示,NAC1 表达和TNM 分期是RCC 患者预后的独立危险因素(P<0.05)。NAC1 表达量低和Ⅲ、Ⅳ期RCC 患者预后较差。见表2。
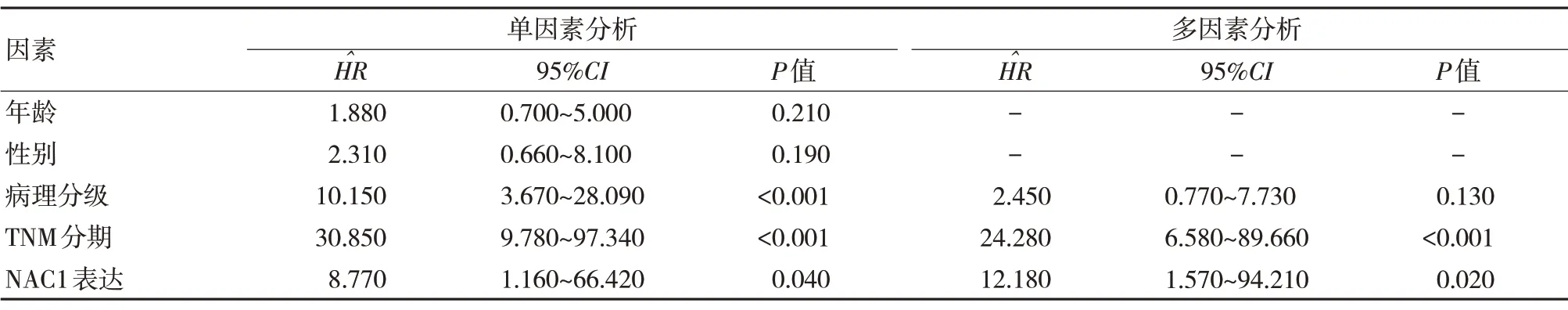
表2 CCRCC 预后因素分析参数
3 讨论
RCC 是一种起源于肾小管上皮细胞的恶性肿瘤,其是泌尿系统常见的恶性肿瘤。由于RCC 一般缺乏早期症状,当患者出现RCC 的典型三联征(即腰痛、血尿、腹部肿块)时,往往已是癌症晚期[9]。为了排除不同细胞类型对研究的影响,本研究只纳入病理类型确认的CCRCC 患者。CCRCC的临床分期主要通过增强CT 扫描确定,增强CT扫描可以评价RCC 局部浸润、淋巴腺病变和转移情况。本研究纳入Ⅰ期70 例、Ⅱ期25 例、Ⅲ期12 例和Ⅳ期3 例。为排除手术方法对RCC 预后的影响,本研究纳入患者均行根治性肾切除术。
术后随访是治疗RCC 的重要环节,RCC 患者应接受专业泌尿外科医生随访。通过对临床症状和体征、肾功能、局部复发或转移情况随访,可以获得重要的预后信息。以往研究发现,接受定期随访患者较未接受定期随访患者OS 更长[10]。本研究110 例患者中,18 例复发或转移。总复发或转移率为16.8%,与以往研究相似。BEISLAND等[10]前瞻性地随访了195 例RCC 患者,31 例患者在随访期间出现复发或转移,总体复发或转移率约为15.9%。18 例复发或转移的患者中,16 例(14.5%)患者死于CCRCC 远处转移,OS 为(26.38±6.33)个月,5 年疾病DSS 为85.5%。根据美国SEER 数据库,2007―2013 年美国RCC 患者的5 年生存率约为74%。本研究预后好于以往数据,这可能与对RCC 早期诊断和治疗及晚期RCC 靶向治疗的原因有关。
NAC1 基因是一种肿瘤抑制基因,在DNA 损伤修复反应和维持细胞遗传物质的稳定性方面起着重要作用。由于NAC1 表达不足,肿瘤细胞内遗传物质不稳定性增加,导致基因突变,从而促进癌症的发生和发展。本研究结果表明,NAC1 表达量在RCC 组织中明显低于邻近组织。NAC1 基因的低表达或缺失主要由基因突变引起。COMSIC数据库对169 个肿瘤的500 多个蛋白激酶突变进行分析,发现NAC1 基因突变频率在所有基因中排名第3 位。NAC1 在许多肿瘤组织中表达量较低或存在缺陷。FERRIS 等[11]比较了165 例非小细胞肺癌患者的肺癌组织和正常肺组织中NAC1 表达情况,结果显示21.8% 肺癌组织中无NAC1 表达,NAC1 在肿瘤组织中表达明显低于正常肺组织。WANG 等[12]对早期乳腺癌的回顾性研究发现,NAC1 在癌组织中表达明显低于正常乳腺上皮组织。类似的研究表明,NAC1 在胃癌、结直肠癌和胰腺癌中表达低于正常组织[13-15]。NAC1 表达与RCC 的关系研究不多。
NAC1 表达与肿瘤的临床病理因素相关。本研究结果发现,NAC1 表达与RCC 的病理分级有关,但与年龄、性别和临床分期无关。NAC1 在病理>Ⅱ级RCC 组织中表达明显低于≤Ⅱ级RCC 组织。经过大量文献查阅,笔者未发现关于RCC 中NAC1 表达与临床病理数据关系的研究。然而关于NAC1 表达与其他癌症的临床病理间的关系有大量的文献,结果也较相似。NAC1 在结直肠癌组织中表达量较低,且与结直肠癌的病理分级相关。NAC1 在高等级肿瘤组织中表达量明显低于低等级肿瘤组织。NAC1 表达与包括RCC 在内的多种肿瘤组织的肿瘤分化呈正相关关系,本研究证明了这一点。
本研究结果还发现,NAC1 在RCC 中表达与RCC 患者的预后有关。NAC1 表达量低的患者总生存期较短。NAC1 表达与RCC 预后的关系报道较少。但也有报道称,NAC1 表达与其他肿瘤的预后有关。TNM 分期和NAC1 表达是独立预后因素。本研究发现NAC1 表达与TNM 期是RCC 预后的独立危险因素,与上述研究结果基本一致。因此,提示NAC1 基因在RCC 中具有重要的潜在应用价值,可作为RCC 的潜在治疗靶点。
本研究存在一些局限性:首先,该研究受限于相对较小的样本;第二,一些因素可能未被纳入,如肿瘤的位置;第三,虽然数据是在前瞻性维护的数据库中仔细收集,但使用回顾性分析存在一些偏差。尽管有这些局限性,但笔者明白这项研究结果对RCC 的治疗具有重要意义,然而需要更多样本的前瞻性研究。
综上所述,NAC1 表达水平可以作为RCC 预后的独立风险因素。NAC1 表达水平低的患者可能有较短的总生存期。随着对RCC 潜在致病机制的进一步了解,NAC1 可作为RCC 新的生物标志物和潜在的分子治疗靶点。
