人乳头状瘤病毒相关口咽鳞状细胞癌的特点及临床分析
2022-01-07袁硕卿张奥博董研博王振晓刘良发
袁硕卿,张奥博,董研博,王振晓,刘良发
(首都医科大学附属北京友谊医院 耳鼻咽喉头颈外科,北京 100050)
口咽癌是指发生于软腭-悬雍垂、腭扁桃体、舌根及口咽侧壁和后壁等部位的恶性肿瘤。口咽癌位列人体常见癌症的第10位[1],约占全身恶性肿瘤患者的5%。90%以上的口咽癌病理类型为鳞状细胞癌(oropharyngeal squamous cell carcinoma, OPSCC)。OPSCC的主要危险因素为吸烟和酗酒,且具二者有很强的协同作用[1-2]。然而近年来OPSCC的发病率呈上升趋势且发病人群多为中青年人,在欧美国家大部分患者并不具备上述暴露因素。流行病学和分子生物学研究证实这与人乳头状瘤病毒(human papillomavirus, HPV)感染,尤其是高危HPV感染相关。根据致病力差异,国际癌症研究协会将HPV分为高危型和低危型,其中高危型包括HPV16、18、33、35、52等[3]。高危型HPV16是HPV+OPSCC最常见的病毒亚型[4]。关于HPV检测方法尚有一定的争议。现在临床上对HPV的检测方法有P16 免疫组织化学染色(IHC)、HPV16 DNA原位杂交(ISH)、PCR等检测方法。由于P16 IHC检测的价格便宜及敏感度极高,2018年美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)在口咽癌治疗指南中首次将P16列为OPSCC患者必查项目。现在在临床上已得到广泛应用。本文回顾性分析了近5年收治的OPSCC患者资料共38例,重点分析HPV阳性的OPSCC患者的临床特点、OPSCC患者生存率的影响因素并探讨不同治疗方案对患者生活质量的影响,以期更好地指导制定临床治疗方案并判断预后。
1 资料与方法
1.1 一般资料
回顾性分析2014年1月—2019年1月在首都医科大学附属北京友谊医院耳鼻咽喉头颈外科诊治的符合纳入标准的口咽鳞状细胞癌患者共38例。其中男31例,女7例;年龄37~73岁,中位数为58岁;高危吸烟暴露史患者25例(≥20包/年,吸烟史10年以上),占总例数65.8%;高危饮酒暴露史患者23例(≥白酒250mL/日,饮酒史10年以上),占总例数60.5%;营养状态极差(高危)患者29例(初诊6个月内体重下降达5%),占总例数76.3%。纳入标准:①经病理活检证实为鳞状细胞癌;②于我院接受完整治疗的患者。排除标准:①发生远处转移患者;②合并严重心肺疾病或严重肝肾功能障碍者;③合并其他器官恶性肿瘤者;④不能完成完整随访患者。
1.2 临床病理资料
对38例患者石蜡标本行P16免疫组织化学染色,依据美国病理学家协会标准[5],即当细胞质及细胞核中P16的表达>70% 时认为是P16阳性,其他则为阴性。其中P16阳性13例,阴性25例。原发部位为扁桃体者24例,其中P16阳性10例;原发部位为舌根者为14例,其中P16阳性3例。依据第8版UICC/AJCC口咽癌分期标准进行分期[6],其中T1 10例,T2 12例,T3 8例,T4 8例;N0 10例,N1 11例,N2 12例,N3 5例。临床分期为I、II期10例,III、IV期28例。肿瘤组织学分化程度包括:低分化10例,中分化10例,高分化18例。
1.3 治疗方案
根据NCCN指南,对于早期OPSCC患者行单纯放疗、同步放化疗、手术或手术+术后放疗。对于中晚期肿瘤则行同步放化疗、诱导化疗+放疗+手术或术后补充放疗、手术+术后放化疗方案。其中在诱导化疗结束后根据WHO实体恶性肿瘤疗效评价标准,若肿瘤缩小≥50%,即部分缓解(partial response, PR),则进一步行术前放疗加手术治疗,术后根据有无不良预后因素(淋巴结包膜外侵犯、切缘阳性、周围神经受累、血管内瘤栓等)决定是否行术后补充放疗。若诱导化疗未达PR,则行手术治疗,术后放疗或放化疗。从2017年始,对于OPSCC患者常规行活检肿瘤组织P16的免疫组织化学染色,并根据染色结果指导下一步治疗计划。中晚期患者,若P16为阳性,则建议患者行诱导化疗方案+半量放疗(40~50 Gy/20~25 次,5 次/周)方案,目的使肿瘤降期,根据降期后的肿瘤分期来决定手术入路。若手术原发灶局限于扁桃体,或舌根原发灶缩小达直径小于1.0 cm,局限于黏膜层,则采用经口微创治疗,否则行经颈或联合下唇正中、下颌骨正中裂开入路手术。若需要术后补充放疗则适当减少放疗剂量,以期减少放化疗的毒副作用以及术后的功能障碍。38例患者中行同步放化疗4例,单纯根治性放疗2例,手术加术后放疗或放化疗27例,诱导化疗+术前放疗+手术或术后补充放疗5例。
1.3.1 手术治疗 手术治疗包括原发灶切除及颈部淋巴结清扫术。原发灶手术包括13例经口CO2激光或等离子病灶扩大切除术、14例舌骨上入路病灶扩大切除术、5例经下唇下颌正中裂开入路病灶扩大切除术。保持>5 mm 安全切缘,切除肿瘤后,再切取切缘送快速冷冻病理检查,确保切缘阴性。共有9例患者行病灶切除术后I期修复重建术,其中行带蒂岛状胸大肌皮瓣修复重建术3例,颏下皮瓣修复重建术4例,游离股前外侧穿支皮瓣修复重建术2例。颈部根据淋巴结转移情况行择区性颈部淋巴结清扫术15例,改良根治性颈清扫术5例,根治性颈清扫术2例。无围手术期死亡及皮瓣坏死等严重术后并发症。
1.3.2 放射治疗 所有放射治疗均采用三维适形调强模式,域照射剂量分布为每周照射5次,每次2 Gy。放疗照射剂量:①根治性放疗:原发灶及阳性淋巴结剂量68~72 Gy,高危区剂量60 Gy,低危区(预防区)剂量50 Gy;②术前放疗:原发灶及阳性淋巴结剂量40~50 Gy,低危区剂量40 Gy;③术后放疗:常规60~66 Gy,切缘阳性则70 Gy;④术后补充放疗:术后根据有无不良预后因素(淋巴结包膜外侵犯、切缘阳性、周围神经受累、血管内瘤栓等)决定是否行补充放疗。若需要补充放疗则HPV-患者补充放疗至根治量,HPV+患者酌情减少放疗剂量至总放疗剂量50~60 Gy。
1.3.3 化学治疗 与放疗的同步化疗均使用顺铂,30 mg/m2,每周1次,共5~7次,总量250~350 mg。诱导化疗为2~3周期,化疗方案为TPF方案(多西紫杉醇+顺铂+5-氟尿嘧啶)。
1.4 随访情况
所有患者随访均采用复诊及电话随访,截至随访日期为2020年3月1日。其中生活质量评估均在术后1年进行,存活不足1年者按最后1次随访结果进行记录。生活质量评估包括患者进食、言语、鼻咽反流及误吸情况,结果以有序分类资料进行统计。进食分为普食、半流食、流食3个等级;言语包括正常交流、可交流但欠清晰、构音障碍无法正常交流3个等级;鼻咽反流及误吸分为完全正常、偶尔发生以及经常发生3个等级。
1.5 统计学方法
统计学软件采用SPSS 26.0进行分析。计数资料行χ2检验,生存分析采用Kaplan-Meier计算方法,并进行Log-rank检验,多因素分析采用Cox回归模型。生活质量分析采用非参数秩和检验。P<0.05为差异具有统计学意义。
2 结果
2.1 一般资料比较
不同HPV感染状态OPSCC患者从表1可以看出,HPV阳性的OPSCC患者占比为34.2%。在HPV阳性的OPSCC患者中,低级别暴露于吸烟(61.5% vs 20.0%,P=0.014)、饮酒(61.5% vs 28.0%,P=0.049)状态中的患者比例更高,差异具有统计学意义。HPV阳性的OPSCC患者更容易出现N2及以上的颈部淋巴结转移(69.2% vs 32.0%,P=0.032),差异具有统计学意义。
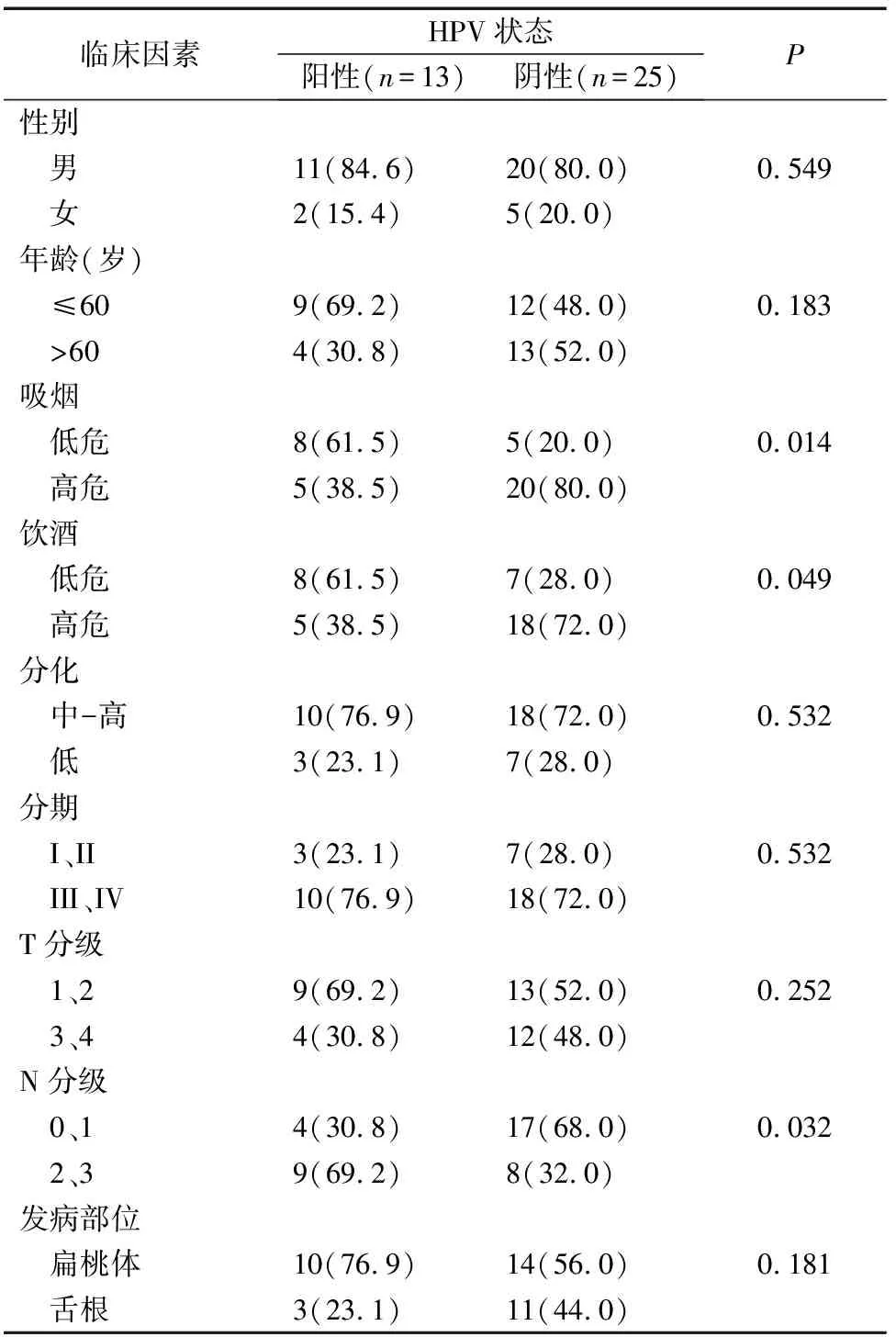
表1 不同HPV感染状态OPSCC患者一般资料比较 [例(%)]
2.2 OPSCC患者生存分析以及影响预后的因素
38例患者随访时间为13.2~72.8个月,中位随访时间为45.2个月。其中死亡9例,死亡原因为肿瘤局部复发或转移。其余29患者无瘤生存27例,带瘤生存2例。以Kaplan-Meier进行生存分析,1年总生存率为89.3%,3年总生存率为 57.5%(图1)。进一步行Kaplan-Meier法单因素分析和Log-rank检验,结果显示:HPV阳性患者以及肿瘤临床分期较早者预后较好(图2、3)。HPV阳性与HPV阴性3年总生存率比较差异具有统计学意义(71.9% vs 52.0%,P=0.003)。3年总生存率肿瘤临床分期I、II期与III、IV期比较差异具有统计学意义(69.8% vs 51.2%,P=0.006),见表2。Cox回归多因素分析明确两者仍是影响预后的独立因素,其中HPV阳性患者比阴性患者死亡风险下降91.6%(HR=0.084,95%CI=0.010-0.676,P=0.020),临床III、IV期患者是I、II期患者死亡风险的4.869倍(HR=4.869,95%CI=1.349-17.565,P=0.016)。 不同治疗方案的总生存率无统计学差异。见表3。

表2 Kaplan-Meter法单因素分析影响口咽鳞癌患者预后的因素 (例,%)

续表2

图1 Kaplan-Meier法计算累积总生存率
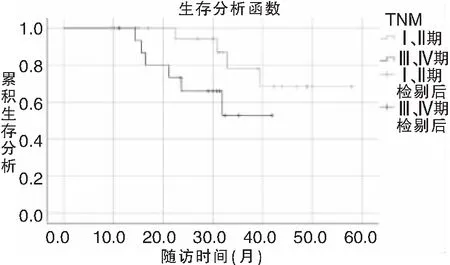
图2 Kaplan-Meier法单因素分析和Log-rank检验P16阳性与否对OPSCC总生存率的影响

表3 Cox回归模型多因素分析影响口咽鳞癌患者预后的因素

图3 Kaplan-Meier法单因素分析和Log-rank检验肿瘤临床分期对OPSCC总生存率的影响
2.3 OPSCC患者治疗后生活质量分析
通过分析3种不同治疗方案对患者术后的生活质量影响,其结果显示:在进食方面有统计学差异(P=0.002),在误吸及反流、言语方面无统计学差异,见表4。从表5可以看出,同步放化疗或根治性放疗患者治疗后吞咽困难最明显,与其他两种治疗方案相比差异具有统计学意义(P=0.001,P<0.005)。另外两种治疗方案间无统计学差异(P=0.805)。

表4 口咽鳞癌患者治疗后生活质量分析

表5 口咽鳞癌不同治疗方案生活质量对比分析
3 讨论
OPSCC的发病与多种危险因素有关,其中的主要危险因素包括吸烟和酗酒[7-8]。然而近年来的研究表明,非吸烟及酗酒的OPSCC发病与HPV感染有关,OPSCC中HPV 感染率高达25%~60%,其中以HPV-16 最为常见,可高达95%,其余常见的还有HPV18、33和35等亚型[9-10]。HPV驱动肿瘤发生使得HPV+OPSCC患者在生物学上有别于与HPV感染无关的OPSCC患者[1-2,9-10]。
HPV阴性头颈鳞癌最常见的基因异常是11q13扩增,TP53突变以及CDKN2A/P16变异(或启动子甲基化),其中CDKN2A/P16通过RB1去磷酸化及基因突变,导致头颈鳞状细胞癌中P16表达缺失。HPV阳性的头颈鳞癌中存在大量野生型TP53及P16的过度表达,却极少见到11q13扩增现象[11-12]。HPV 致癌主要依赖 E6 和 E7 两种致癌蛋白。一方面E6蛋白可以协同泛素连接酶形成E6相关性蛋白,使P53泛素化,导致其编码的蛋白体酶变性。同时E6蛋白也可直接作用于P53 DNA结合位点活跃的部分,阻碍其转录,抑制P53的乙酰转移酶活性,破坏其稳定性,从而失去阻滞细胞周期、促进细胞凋亡、维持基因组稳定的能力[13]。另一方面,E7蛋白能够结合并降解pRb,使pRb失活,导致P16(CDK抑制剂)失去调节而过度表达,并诱导有丝分裂信号的传递从而导致细胞周期蛋白依赖性激酶(Cyclin-dependent kinase,CDK)增加,引起pRB/E2F复合体中的E2F释放,进而激活有丝分裂期相关基因组,导致肿瘤细胞不断增殖[14]。因此,有学者认为检测P16过表达情况可以作为检测HPV感染的生物标志物[15-17]。目前临床上常用的检测手段包括P16免疫组化、HPV-PCR及HPV DNA 原位杂交。HPV DNA 原位杂交和HPV-PCR是最常用的检测HPV感染的方法。P16 免疫组化和HPV DNA PCR的敏感性极高,而HPV DNA 原位杂交特异性更高,它们都是目前利用活检组织标本检测HPV的常用方法。目前还有可以采用PCR检测细针穿刺标本、唾液、刷取细胞学标本及血清标本检测HPV 也是具有很好应用前景的方法,但它们的敏感性和特异性差别较大[18]。最近Qureishi等[19]报道采用PCR技术检测唾液中的HPV,与P16免疫组化和HPV DNA 原位杂交比较,其敏感性和特异性分别是72.2%和90%, 其阳性和阴性预测值分别为96.3%和47.4%。无不良反应,不受进食、吸烟、饮酒及体育锻炼的影响,不失为一种有应用和推广前景的检测方法。我们对我院从2014年1月—2019年1月收治的38例OPSCC患者进行了临床分析,并对肿瘤组织标本进行了P16免疫组化染色,发现P16阳性 OPSCC患者占比达34.2%,在P16阳性的OPSCC患者中非吸烟饮酒或相对较少吸烟饮酒的患者所占比例相对较高(61.5% vs 20.0%,P=0.014; 61.5% vs 28.0%,P=0.049)。HPV阳性的口咽鳞状细胞癌患者更容易出现颈部淋巴结转移(69.2% vs 32.0%,P=0.032),在这与国内外报道一致[1-2,9-10,20]。
近几十年来,OPSCC的外科治疗发生了巨大的变化。口咽癌由于其位置深在、侵袭性强、早期颈部淋巴结转移的特点,患者就诊时多属中晚期。20世纪90年代,开放根治性手术一直是OPSCC的主要治疗方法。早年头颈肿瘤外科修复手段有限,根治性手术后容易对患者的言语、吞咽功能,软腭闭合防止鼻咽反流等功能产生影响,所以手术在20世纪90年代被同步放化疗所取代。与此同时,新的微创手术方法如经口单极烧灼术开始出现,有可能降低术后的功能障碍,避免同步放化疗的迟发毒性。有研究表明,HPV阳性OPSCC通过延迟DNA修复,G2/M期阻滞,改善肿瘤乏氧状态以及降低增殖能力以达到增加放疗敏感的作用[21],且HPV相关 OPSCC的患者相对更年轻,因此有更好的长期预后。因此,如何降低治疗级别,以减少长期毒性和治疗相关的并发症成为近些年的关注点[22-23]。近几年,微创手术方法不断进步,包括经口激光微创手术(transoral laser microsurgery, TLM)和经口机器人手术(transoral robotic surgery, TORS),这些微创方法提供了良好的功能保留,没有CRT相关的严重毒副作用,因此大大降低了治疗相关的并发症[24]。2017年第8版UICC/AJCC头颈部肿瘤分类将OPSCC按照有无HPV感染分为HPV阳性OPSCC和HPV阴性OPSCC,对HPV阳性OPSCC的患者TNM临床分期进行了降级。NCCN指南同样建议将OPSCC按HPV阳性与阴性进行分组诊疗,鉴于对HPV阳性OPSCC患者进行治疗后,包括手术及放化疗等综合治疗,相比HPV阴性OPSCC患者预后较好,建议临床治疗可以降级。从而在不牺牲疾病控制或生存率的情况下将毒副作用降至最低,以期提高患者的生活质量。
我们对38例OPSCC患者进行了Kaplan-Meier生存分析,发现1年总生存率为89.3%,3年总生存率为 57.5%。且HPV感染状态以及肿瘤临床是影响预后的独立因素,其中HPV阳性患者比HPV阴性患者死亡风险下降91.6%(HR=0.084,95%CI=0.010-0.676,P=0.020),临床III、IV期患者是I、II期患者死亡风险的4.869倍(HR=4.869,95%CI=1.349-17.565,P=0.016)。这也与国内外报道基本一致[18,25-26]。在针对不同治疗方式对患者生活质量的分析中我们发现,虽然不同治疗方式的总体生存率无明显统计学差异,但生活质量存在统计学差异,同步放化疗后患者的吞咽功能与其他治疗方式相比更差。吞咽困难是同步放化疗或根治性放疗之后最常见的问题,也是影响生活质量的一个独立危险因素,主要原因为放化疗对咽上缩肌以及声门上喉结构的损伤。慢性吞咽困难是一个复杂的问题,可以引起营养不良甚至反复误吸、肺炎,有些患者不得不接受胃造瘘术[27-28]。鉴于HPV阳性OPSCC对放化疗更敏感,也根据国内外经验[29],我们对于P16阳性OPSCC患者推荐先行诱导化疗2~3个周期,若可以达到PR水平,则进一步行40~50 Gy的术前放射治疗,以期缩小肿瘤原发灶,将原本临床分期较晚的肿瘤达到降期目的,原发灶再行经口的微创治疗,可以达到降低治疗强度,尽可能保护患者术后功能并且减少了同步放化疗的毒副作用,改善患者的长期生活质量。由于目前收集的OPSCC患者病例资料相对较少,对于如何精准的进行临床治疗方案的选择及判断预后仍需不断的积累治疗经验。本文也有一些不足之处。本文病例数目相对较少影响数据的科学性。需要进一步收集患者资料。扩大样本量提高数据的科学性及准确性。
综上所述,HPV阳性的OPSCC患者更多的为低危烟酒暴露史,临床特点为更容易发生颈部淋巴结转移,但对放化疗更加敏感,预后相对较好,应尽可能的降级治疗以期保护患者的吞咽功能,改善治疗后的生活质量。临床工作中应对OPSCC患者常规行P16检测,有助于指导OPSCC患者的临床分期和治疗方案的选择,也有利于临床预后的判断。
