咔唑基二阶非线性光学生色团的设计与合成
2022-01-07刘家良郑秋颖
刘家良,张 辉,郑秋颖,张 吉,李 明
1.长春工业大学化学与生命科学学院,吉林 长春 130012;2.东北师范大学化学学院,吉林 长春 130032
随着信息时代的到来,光纤通信、移动通信和卫星通信等技术在全球范围内蓬勃发展,二阶非线性光学材料(NLO)在宽带通讯、信息处理、雷达系统和高密度光存储等领域中具有潜在的应用前景,引起了科学界的广泛关注。有机非线性材料具有较强的非线性光学效应、超快响应速度、高激光损伤阀值、低介电常数、低成本、优良的可加工性和集成性以及分子结构易于调控等优点[1-4],逐渐受到人们的重视。目前关于有机二阶非线性光学材料的研究大多围绕D-π-A 型偶极发色团分子展开(其中D,π 和A 分别代表电子给体、共轭电子桥和电子受体)[5-9]。通过对给体端的给电子能力、受体端的吸电子能力和电子桥的共轭性质进行优化,可以提高生色团的微观一阶超极化率。
Xu 等[10]合成了一系列带有杂原子的光学生色团,采用密度泛函数理论(DFT)计算分析了不同原子的引入对生色团的影响。Zhang 等[11]通过引入富电子基团修饰吲哚,合成了具有良好热稳定性的新型光学生色团。Zhou 等[12]在传统的环锁定四烯基(CLD)桥环[13]上引入了不同强度的给体基团(二乙氨基苯基、四氢喹啉基和香芹素基),受体采用强吸电子基团2-二氰基亚甲基-3-氰基-4,5-二甲基-5-三氟甲基-2,5-二氢呋喃(CF3-TCF),在以四氢喹啉和CF3-TCF 为给受体并引入隔离基团后,达到了优化二阶非线性光学活性的目的,最大电光系数(r33)达到了218 pm/V,但其中含有更强给电子能力的久洛尼定基和CF3-TCF 的生色团的二阶非线性光学活性却并不理想。Liu 等[14]以传统二乙烯基噻吩基(FTC)桥环和CLD 生色团的共轭结构以及吡咯环为桥,引入了不同的受体,合成了6 种不同的生色团,在以CLD 桥为共轭结构时,采用三氰基呋喃(TCF)为受体的生色团分子表现出较强的二阶非线性光学活性(r33为150 pm/V),远远大于以CF3-TCF 受体合成的生色团的电光活性(r33为58 pm/V)。说明在优化生色团的二阶非线性光学活性时,电子供体、共轭桥和电子受体三者之间存在着一种匹配性。
咔唑具有良好的供电子能力,是非常好的电子给体[15],但如果作为生色团的共轭桥,与强电子给体有更好的匹配性,而久洛尼定是一种强给电子体,二者叠加会有更好的电荷传递效果。本工作以咔唑为共轭桥,久洛尼定(GLN)为电子给体,2-(3-氰基-4,5,5-三甲基呋喃-2(5H)-亚烷基)丙二腈(TCF)为电子受体,合成了一种新型光学生色团GLN-CBZ-TCF{2-(3-氰基4-((E)-2-(9-乙基-6-((E)-2-(2,3,6,7-四氢-1H,5H-吡啶并[3,2,1-ij]喹啉-9-乙基)乙烯基)-9H-咔唑-3-基)乙烯基)-5,5-二甲基呋喃-2(5H)-亚甲基)丙二腈},并与以咔唑为共轭桥,N,N-二乙基苯胺(DEA)为电子给体,TCF[16]为电子受体的生色团分子DEA-CBZ-TCF{2-(3-氰基-4-((E)-2-(6-((E)-4-(二乙氨基)苯乙烯)-9-乙基-9H-咔唑-3-基)乙烯基)-5,5-二甲基呋喃-2(5H)-亚甲基)丙二腈}进行了性能比较。
1 实验部分
1.1 实验仪器
Bruker Ш HD 400 型核磁共振波谱仪,频率为400 MHz;Agilent Cary 5000 型紫外可见近红外分光光度计;Metter Toledo TGA 2 型热重分析仪,测定温度为30~800 ℃,氮气气氛,升温速率为10 ℃/min。NETZSCH 4 型差示扫描量热仪,氮气气氛,升温速率为10 ℃/min。
1.2 化合物合成
1.2.1 DEA-CBZ-TCF 的合成
生色团DEA-CBZ-TCF 的合成路线如图1 所示[17]。

图1 生色团DEA-CBZ-TCF 的合成路线[17]Fig.1 Synthetic route of chromophore DEA-CBZ-TCF[17]
根据文献[18]合成了化合物1(9-乙基-9H-咔唑)。将化合物1(1 g,14 mmol)和N,N-二甲基甲酰胺(3 mL,40 mmol)溶于25 mL 的1,2-二氯乙烷中,冰浴30 min,冰浴下滴加POCl3发生Vilsmeier 反应。撤去冰浴,常温下反应1 h,氮气保护80 ℃下回流24 h。反应后水解,用二氯甲烷萃取3 次,合并有机相,并通过硅胶色谱法(洗脱剂:石油醚与乙酸乙酯体积比为5:2)纯化得白色固体(化合物2),产率为20%。化合物2(9-乙基-9H-咔唑-3-甲醛)的核磁共振氢谱表征结果如下:
1H NMR (400 MHz,CDCl3),δ10.10 (S,1 H,—CHO),8.62 (S,1 H,Ar—H),8.18 (d,J= 8.5 HZ,1H,Ar—H),8.03 (t,J= 8.5 HZ,1H,Ar—H),7.55 (d,J=8.5 HZ,1H,Ar—H),7.46 (d,J= 8.5 HZ,2H,Ar—H),7.35 (t,J= 8.5 HZ,1H,Ar—H),4.45 (q,J= 7.2 Hz,2H,—CH2—),1.48 (t,J= 6.7 HZ,3H,—CH3)。
将化合物2(1 g,5 mmol)溶于少量的二氯乙烷中,冰浴10 min;向其中加入叔丁醇钾(1.12 g,10 mmol),冰浴30 min;将三苯基磷盐(2.6 g,5 mmol)溶于二氯甲烷,然后用恒压滴液漏斗加入体系;移除冰浴,在N2气氛下常温反应12 h;再将反应液倒入水中并萃取3 次,合并有机相,除去溶剂;并通过硅胶柱色谱(洗脱剂:石油醚与乙酸乙酯体积比为3:1)法纯化得到化合物3[(E)-N,N-二乙基-4-(2-(9-乙基-9H-咔唑-3-基)乙烯基)苯胺],产率为66%。化合物3 的核磁共振氢谱表征结果如下:
1H NMR (400 MHz,CDCl3),δ:8.26 (d,J= 14.9 Hz,2H,Ar—H),7.92(d,J= 14.2 HZ,3H,Ar—H),7.88 (d,J= 10.5 Hz,3H,Ar—H),7.69(d,J= 10.2 Hz,3H,Ar—H),7.42 (d,J= 8.0 Hz,2H,—CH2=CH2—),4.37(q,J= 7.2 Hz,2H,—CH2—),4.29 (d,J= 7.0 Hz, 4H, —CH2—), 1.46(t,J= 7.1 Hz,3H,—CH3),1.37 (t,J= 7.5 Hz,6H,—CH3)。
与化合物3 的合成步骤相同。萃取后有机相的反应产物通过硅胶柱色谱纯化(洗脱剂:石油醚与乙酸乙酯体积比为5:2)得到化合物4[(E)-6-(4-(二乙氨基)苯乙烯基)-9-乙基-9H-咔唑-3-甲醛)],收率为20%。化合物4 的核磁共振氢谱表征结果如下:
1H NMR (400 MHz,CDCl3),δ:10.12 (S,1H, —CHO),9.66 (S,2H,Ar—H),8.36 (d,J= 8.5 HZ,2H,Ar—H),7.77 (d,J= 8.5 HZ,1H,Ar—H),7.64 (d,J= 8.5 HZ,2H,Ar—H),7.47 (d,J= 8.5 HZ,2H,—CH2=CH2—),4.47 (q,J= 7.2 Hz,2H,—CH2),4.13 (d,J= 7.0 Hz,4H,—CH2),1.48 (t,J= 7.1 Hz,3H,—CH3),1.38 (t,J= 7.5 Hz,6H,—CH3)。
将化合物4(0.4 g,1.1 mmol)和3 mL 乙醇加入50 mL 烧瓶,加热至80 ℃使其溶解;然后加入TCF(0.22 g,1.1 mmol)并回流1.5 h;冷却后置于冰箱中使其结晶;通过硅胶柱色谱纯化(洗脱剂:石油醚与四氢呋喃体积比为2:3)得到化合物DEA-CBZ-TCF,产率为33%。化合物DEA-CBZ-TCF 的核磁共振氢谱表征结果如下:
1H NMR (400 MHz,CDCl3),δ:8.18 (d,J= 14.9 Hz,1H,Ar—H),8.06 (d,J= 7.7 Hz,1H,Ar—H),7.91 (S,1H,Ar—H),7.61 (d,J= 8.5 Hz,1H,Ar—H),7.53(d,J= 22.1 Hz,3H),7.40 (d,J=23.5,10.2 Hz,2H,Ar—H),7.24 (d,J= 8.9 Hz,1H,Ar-H),6.86 (d,J= 8.0 Hz,2H,-CH2=CH2-),6.36 (d,J= 8.8 Hz,2H,—CH2=CH2—),4.45 (q,J= 7.2 Hz,2H,—CH2—),3.30 (d,J= 7.0 Hz,4H,—CH2—),1.47 (t,J= 7.1 Hz,3H,—CH3),1.25 (S,6H,—CH3),1.10 (t,J= 7.5 Hz,6H,—CH3)。
1.2.2 GLN-CBZ-TCF 的合成
生色团GLN-CBZ-TCF 的合成路线如图2 所示[17]。
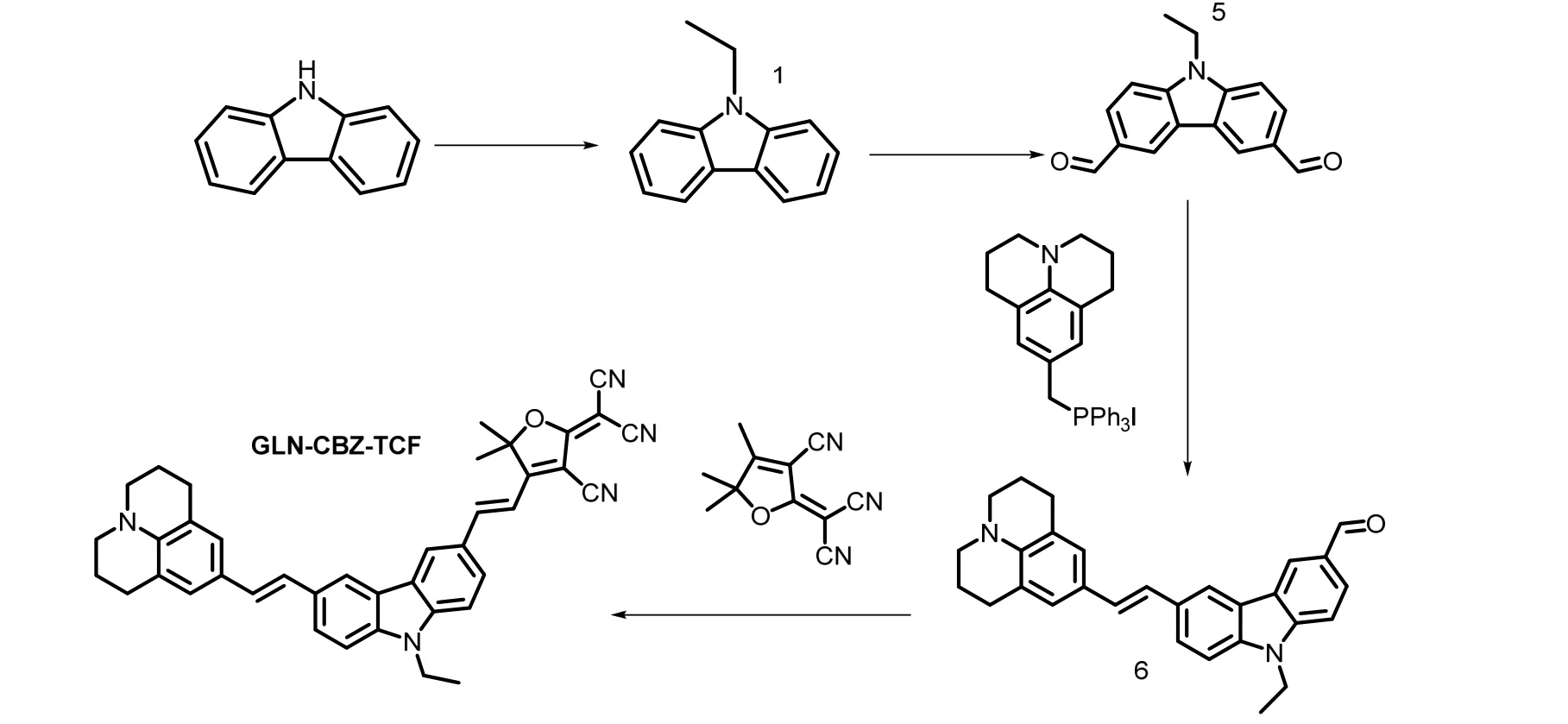
图2 生色团GLN-CBZ-TCF 的合成路线Fig.2 Synthetic route of chromophore GLN-CBZ-TCF
将化合物1(1 g,14 mmol)、DMF(3 mL,40 mmol)溶于25 mL 的1,2-二氯乙烷中,冰浴30 min,冰浴下滴加POCl3;撤去冰浴,常温下反应1 h,氮气保护80 ℃下回流24 h;反应后再水解,然后用二氯甲烷萃取三次,合并有机相;通过硅胶色谱法(洗脱剂:石油醚和乙酸乙酯体积比为5:2)纯化得白色固体化合物5(9-乙基-9H-咔唑-3,6-二甲醛),其产率为20%。化合物5 的结构经核磁共振氢谱表征结果如下:
1H NMR (400 MHz,CDCl3),δ:10.15 (S,2H,—CHO),8.69 (S,2 H,Ar—H),8.11 (d,J=8.5 HZ,2H,Ar—H),7.58 (d,J= 8.5 HZ,2 H,Ar—H),4.47 (q,J=7.2 Hz,2H,—CH2—),1.54 (t,J= 6.7 HZ,3H,—CH3)。
将化合物5(0.8 g,2.7 mmol)溶于少量二氯乙烷中,冰浴10 min;加入叔丁醇钾,冰浴30 min,氮气保护下滴加季磷盐(合成方法见参考文献[19]);撤去冰浴,常温下反应12 h;将反应液倒入水中,然后用二氯乙烷萃取;通过硅胶柱色谱法(洗脱剂:石油醚与二氯甲烷体积比为1:3)纯化得橘黄色固体化合物6[(E)-9-乙基-6-(2-(2,3,6,7-四氢-1H,5H-pyrido[3,2,1-ij]喹啉-9-yl)乙烯基)-9H-咔唑-3-甲醛],产率为32%。化合物6 的核磁共振氢谱表征结果如下:
1H NMR(400 MHz,CDCl3),δ:10.07(S,1H),9.57(S,1H),8.58(d,J=7.6 Hz,1H),8.18(d,J=8.5 Hz,1H),7.97(q,J=8.8 Hz,1H),7.64(d,J=8.4 Hz,1H),7.42(d,J=8.5 Hz,1H),7.36(d,J=8.5 Hz,1H),7.24(d,J=8.5 Hz,1H),7.01(d,J=7.6 Hz,2H),4.35(q,J=7.2 Hz,2H),3.18(t,J=6.3 Hz,4H),2.75(t,J=6.3 Hz,4H),1.99(t,J=6.2 Hz,4H),1.47(t,J=7.1 Hz,3H)。
在50 mL 圆底烧瓶中加入化合物6(0.24 g,0.538 mmol)和2~3 mL 乙醇,加热至底物溶解,再加入TCF(0.13 g,0.638 mmol),回流1 h;终止反应后先冷却,再置于冰箱中使其结晶;通过硅胶柱色谱法(洗脱剂:石油醚与二氯甲烷体积比为1:1)纯化得黑色固体为化合物GLN-CBZ-TCF,产率为36%。化合物GLN-CBZ-TCF 的核磁共振氢谱表征结果如下:
1H NMR (400 MHz,CDCl3),δ:8.62 (S,1H,Ar—H),8.21 (S,1H,Ar—H),7.99 (d,J= 12.1 HZ,2H,Ar—H),7.66 (d,J= 8.5 HZ,1H,Ar—H),7.47 (d,J= 8.5 HZ,2H,Ar—H),7.41 (d,J= 7.7 HZ,1H,Ar—H),7.13 (S,1H,Ar-H),7.03 (d,J= 7.8 HZ,2H,—CH2=CH2—),6.98 (d,J= 7.7 HZ,1H,—CH2=CH2—),6.82 (d,J= 7.5 HZ,1H,—CH2=CH2—),4.41 (q,J= 7.2 Hz,2H,—CH2—),3.19 (t,J= 6.5 Hz,4H,—CH2—),2.81 (t,J= 6.3 Hz,4H,—CH2—),2.00 (t,J= 6.1 Hz,4H,—CH2—),1.47(S,6H,—CH3),1.47 (t,J= 7.0 Hz,3H,—CH3)。
2 结果与讨论
2.1 生色团的热稳定性
大多数NLO 器件制备过程需要高温,即极化过程中的极化温度应高于聚合物的玻璃化转变温度。因此,热稳定性对于NLO 生色团的应用至关重要。为了探究生色团的热稳定性,在相同的加热速率(10 ℃/min)下对生色团GLN-CBZ-TCF 进行热重分析(TGA)和差示扫描量热分析(DSC),结果分别如图3 和图4 所示。由图3 可知,失重达5%的温度(Td)高于200 ℃[20]。分解反应通常会放热或吸热,因此在相同加热条件下将TGA 和DSC 分析相结合是表征热稳定性更合理的方法。由图4可知,在150 ℃以下,生色团GLN-CBZ-TCF 的DSC 曲线没有显著变化。因此,可以认定生色团在170 ℃以下是热稳定的。
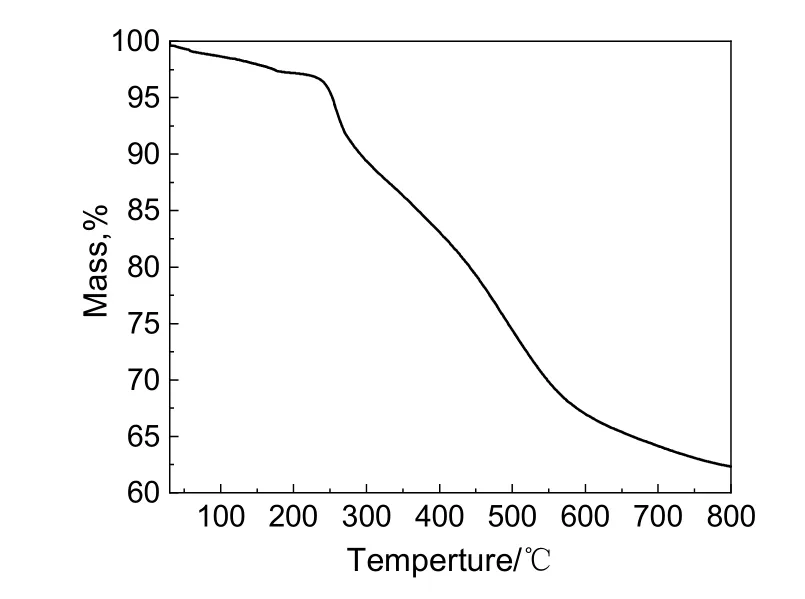
图3 生色团GLN-CBZ-TCF 的TGA 曲线Fig.3 TGA curve of the chromophore GLN-CBZ-TCF

图4 生色团GLN-CBZ-TCF 的DSC 曲线Fig.4 DSC curve of chromophore GLN-CBZ-TCF
2.2 光学性质
通常认为,有机分子的NLO 性质受生色团的分子内电荷转移(ICT)性质和电子密度分布的影响。为了揭示供体受体在ICT 吸收特性上的引入,在具有不同介电常数的5 种溶剂中测定了生色团(浓度为1×10-5mol/L)的紫外可见吸收光谱,以研究生色团的溶致变色行为,探究其在各种介电环境中生色团的极性,结果如图5 所示。由图5 可知,在二氧六环(DO)、甲苯(TO)、二氯甲烷(DCM)、氯仿(CF)和N,N-二甲基甲酰胺(DMF)5 种不同极性的溶剂中,生色团在溶致变色方面表现出非常明显的光学特征。紫外吸收光谱显示,从弱极性溶剂(二氧六环)到一般极性溶剂(二氯甲烷),最大吸收波长(λmax)发生红移,从一般极性溶剂(二氯甲烷)到强极性溶剂(氯仿)发生蓝移。这是因为生色团分子是共轭的D-π-A 结构,基态结构可以视为中性和电荷分离的规范共振形式的组合,这两种共振形式对基态的相对贡献可以通过溶剂的极性来控制。生色团GLN-CBZ-TCF 的正溶剂化变色现象表明其呈中性多烯状电子结构,但在DMF 等强极性溶剂中,偶极发色团电子分布便会接近甚至超过花菁限(两种形式对基态贡献相同)进入两性离子区域[21],部分电子反向跃迁,在外表现为蓝移。同时,GLN-CBZ-TCF 的λmax远远大于DEA-CBZ-TCF(见表1),说明生色团GLN-CBZ-TCF 使用的久洛尼定基团在生色团的电荷转移中起到了更好的作用。值得注意的是,生色团在DMF 中的紫外吸收达到最大,可能是由于生色团与溶剂发生了相互作用。
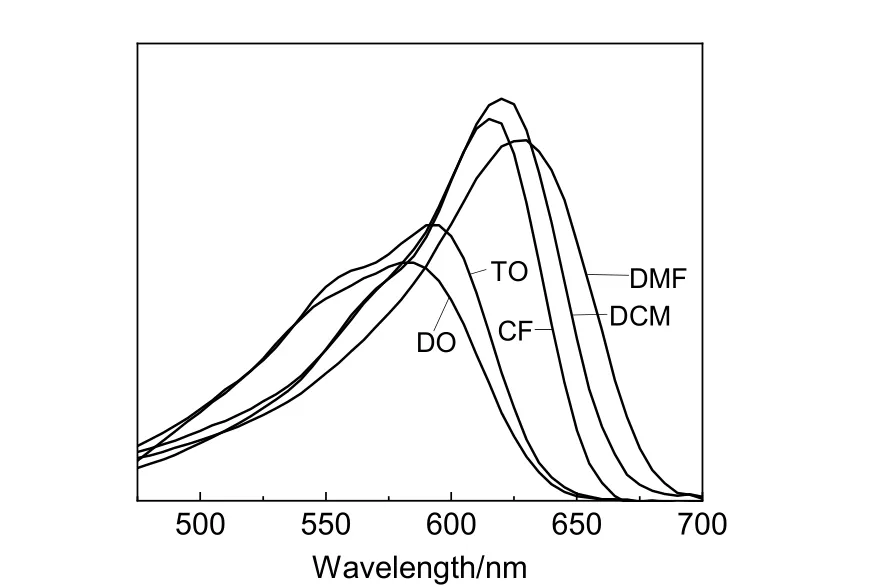
图5 生色团GLN-CBZ-TCF 在不同溶剂中紫外吸收光谱Fig.5 UV-vis absorption spectra of chromophore GLN-CBZ-TCF in different solvents
2.3 非线性光学的理论研究
在优化了基态分子的几何构型之后,通过DFT 理论[22]计算了生色团GLN-CBZ-TCF 的最高占据分子轨道-最低未占分子轨道(HOMO-LUMO)能隙(ΔE),偶极矩(μ)和第一超极化率(β),相关数据见表1。前线分子轨道通常用于表征分子的化学反应性和动力学稳定性,并获得有关其光学和电学性质的定性信息[23]。此外,HOMO-LUMO 能隙还用于了解发生在发色团分子内的电荷转移。
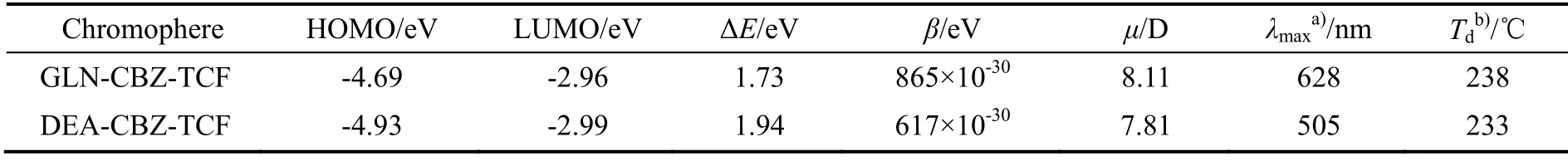
表1 生色团GLN-CBZ-TCF 和DEA-CBZ-TCF 的热光学和电学性质Table 1 Thermal, optical and electrical properties of chromophore GLN-CBZ-TCF and DEA-CBZ-TCF
图6 表示生色团GLN-CBZ-TC 和DEA-CBZ-TCF 的前线分子轨道。由图6 可知,HOMO 的电子分布主要是离域在久洛尼定和咔唑环上的,而LUMO 主要由受体部分组成。由表1 数据可以看出,与以苯胺为电子给体的生色团相对比[14],GLN-CBZ-TCF 的HOMO 能级升高,说明久洛尼定的给电子能力远远大于苯胺,而LUMO 能级几乎没有变化,这是因为受体没有改变。能隙值分别为1.73 eV和1.94 eV,证明引入强电子给体后,电荷转移效果更好。同时,GLN-CBZ-TCF 的β值远远大于DEA-CBZ-TCF,说明咔唑和久洛尼定有更好的匹配效果,并没有发生给体增强,非线性光学活性却下降的情况。
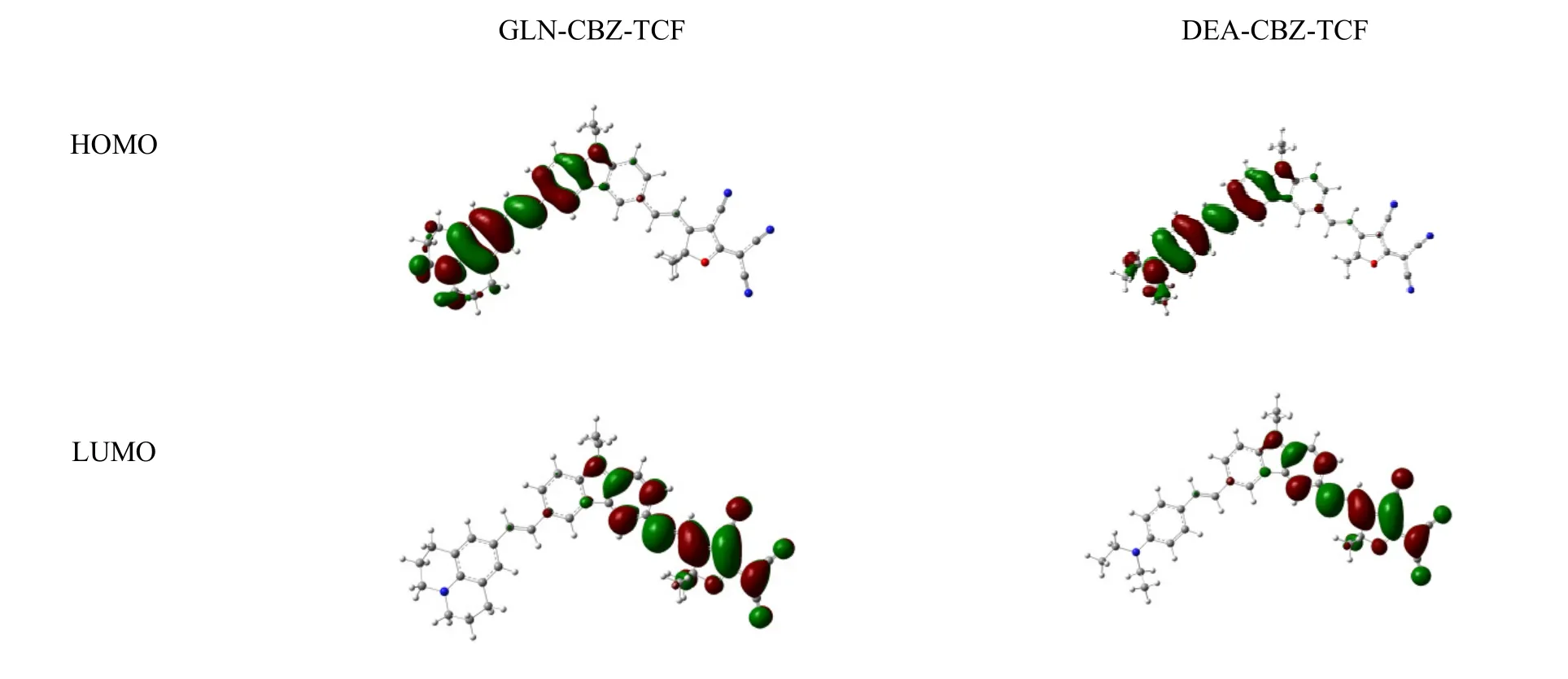
图6 生色团GLN-CBZ-TCF 和DEA-CBZ-TCF 的前沿分子轨道Fig.6 The frontier molecular orbitals of chromophore GLN-CBZ-TCF and DEA-CBZ-TCF
3 结 论
以咔唑作为共轭结构,久洛尼定为电子给体,TCF 为电子受体合成了一种具有明显溶致变色行为的新型生色团,最大紫外吸收波长达到628 nm,具有明显光学特性,5%失重温度高达238 ℃,有良好的热稳定性。另外,前线轨道显示久洛尼定与咔唑之间有良好电荷转移效果,相比于以N,N-二乙基苯胺为电子给体,久洛尼定与咔唑的匹配度较高。证明其具有良好的光电性能,在有机光电材料方面有广泛的应用前景。
