基于网络药理学探讨黄精治疗阿尔茨海默病的作用机制
2022-01-07李文达张少婷朱爱华
李文达,张少婷,方 婷,朱爱华
阿尔茨海默病(Alzheimer′s disease)是一种典型的老年性疾病,临床表现为进行性认知功能障碍及记忆力减退,伴有或不伴有精神行为症状。有研究显示,至2019年全球痴呆症高达5 000万人,预计2050年将增加至1.52亿人[1],其中阿尔茨海默病是常见的痴呆类型。阿尔茨海默病的发生与进展不但威胁老年人的健康与生活质量,同时给家庭带来精神与经济的压力。目前,阿尔茨海默病发病原因尚未明确,临床所用的一线治疗药物未改变病人预期寿命或整体进展[2]。阿尔茨海默病在中医学中属于“痴呆”“呆病”“健忘”等范畴,病机主要为髓海空虚、脑失所养,伴风、火、痰、瘀上扰清窍,以致神机失用,发为痴呆[3]。诸多临床试验表明,中医针药在阿尔茨海默病的治疗中具备独特优势[4-5]。
黄精是百合科植物滇黄精、黄精或多花黄精的干燥根茎[6],最早记载于《名医别录》:“黄精,味甘、平,无毒,主补中益气,除风湿,安五脏。久服轻身、延年、不饥,长久服用身体轻盈、多年不饥饿”[7]。《道藏神仙芝草经》对黄精亦有“宽中益气,使五脏调和,肌肉充盈,骨髓坚强,其力倍增,多年不老,颜色显明,发白更黑,齿落更生”的描述。可见黄精之用与延年益寿相关。现代药理研究提示,黄精具有抗肿瘤、抗氧化、免疫调节、降血糖、抑菌抗炎等作用[8]。基于数据挖掘中药治疗阿尔茨海默病的复方中黄精为高频次单药之一[9]。
目前,关于黄精治疗阿尔茨海默病的具体药理机制尚未明确。网络药理学作为一种新兴的综合性系统方法,通过现代计算机技术结合生物信息学、分子生物学、药理学、统计学等,解释药物与疾病相互作用的内在联系,为中药现代化提供了帮助[10]。本研究基于网络药理学,通过对黄精及阿尔茨海默病作用靶点的挖掘,探讨黄精治疗阿尔茨海默病的药理作用及其可能的作用机制。
1 资料与方法
1.1 检索数据库 中药系统药理学分析平台(TCMSP),UniProt知识库,基因数据库(GeneCards),人类孟德尔遗传数据库(OMIM),药物数据库(DrugBank),PubChem数据库,Swiss Target数据库,Cytoscape 3.7.1软件,String 11在线软件,Metascape数据库。
1.2 方法
1.2.1 黄精药物成分及靶点的获取 通过TCMSP(https://tcmspw.com/tcmsp.php)[11],检索关键词“黄精”,获取中药黄精含有的全部活性成分,并对检出的活性成分进行ADME筛选,设定两个阈值:口服生物利用度(oral bioavailability,OB)≥30%及类药性(drug-like,DL)≥0.18,最终获得黄精的主要活性成分,整理至Excel表格中。
在TCMSP数据库中选择“Related Targets”一栏,检索各个主要活性成分对应的靶点,并利用UniProt知识库 (https:www.uniprot.org/)[12]将筛选出的靶点蛋白名转化为相应的基因名;同时在PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)[13]获取成分的SMILES号,并在Swiss Target平台(http://swisstargetprediction.ch/)[14]预测药物靶点,选择概率≥0.12的靶点,将数据汇总,建立黄精活性成分靶点数据集。
1.2.2 阿尔茨海默病靶点与交叠靶点的获取 通过OMIM数据库(https://www.omim.org/)[15],GeneCards数据库(https://www.genecards.org)[16]及DrugBank数据库(https://www.drugbank.ca)[17]3个平台,检索关键词“Alzheimer′s disease”,查找阿尔茨海默病相关的靶基因。下载表格并进行汇总去重,建立阿尔茨海默病靶点数据集。将所得的黄精活性成分靶点进行去重整理,与疾病基因靶点进行对比,得到药物-疾病交叠靶点数据集,并绘制Venn图。
1.2.3 药物-活性成分-靶点-疾病网络的构建 将药物靶点、交叠靶点及活性成分、疾病之间交互关系数据导入Cytoscape 3.7.1[18]软件,构建药物-活性成分-靶点-疾病网络,并利用“Network analyser”功能对网络进行拓扑分析。其中每个节点(node)代表药物、疾病、活性成分或靶点蛋白,边(edge)代表节点间的相互作用,节点的度值(degree)代表与该节点连接边的数目,即在该网络中的重要程度。
1.2.4 靶蛋白相互作用网络的构建 利用String在线软件(https://string-db.org/)[19]导入黄精治疗阿尔茨海默病的潜在作用靶点,选择物种为“Homo sapines”进行检索,取置信度设置为high confidence(0.7),将网络数据导入Cytoscape软件绘制中药-疾病靶点蛋白-蛋白相互作用(PPI)。
1.2.5 基因本体(GO)功能富集分析和京都基因与基因组百科全书(KEGG)通路富集分析 将共有靶点基因信息导入Metascape数据库(https://metascape.org/)[20],设置参数input as species:H.sapiens;analysis as species:H.sapiens,对关键靶蛋白分别进行生物过程(biological process,BP)、细胞组成(cellular component,CC)、分子功能(molecular function,MF)的GO功能富集分析及KEGG通路富集分析。
2 结 果
2.1 黄精药物成分及靶点信息 在TCMSP数据库中检索得到黄精活性成分共38个,根据OB值和DL筛选后得到活性成分12个,详见表1。TCMSP平台获得主要活性成分靶点149个,其中HJ1为12个,HJ2为3个,HJ3为38个,HJ4为37个,HJ5为19个,HJ6为15个,HJ7为16个,HJ8为8个,HJ9为1个,HJ10为0个,HJ11为0个,HJ12为0个。经Swiss Target平台补充,共得到潜在基因靶点329个。

表1 黄精主要活性成分
2.2 阿尔茨海默病疾病靶点与交叠靶点信息 在OMIM、GeneCards、DrugBank数据库共获得与阿尔茨海默病密切相关的疾病靶点9 846个,其中GeneCards检索到9 554个基因,DrugBank检索到85个基因,OMIM检索到534个基因。选取GeneCards与疾病相关度≥10的基因靶点后将3个平台数据汇总并去重后得到疾病靶点929个。经数据平台收集黄精药物靶点共329个,去除无验证基因的活性分子,9种活性分子共作用于173个基因靶点。将两者对比取交集,获得疾病-药物交叠靶点共60个,Venn图见图1。

图1 药物-疾病靶点Venn图
2.3 中药-活性成分-靶点-疾病网络的分析 利用Cytoscape 3.7.1软件构建药物-活性成分-靶点-疾病网络,由71个节点、174条边组成,详见图2。根据网络节点度值和中介中心度进行分析,活性成分居前5位的节点分别是黄芩素(baicalein),度值95,中介中心度0.41;4,5′-二羟基黄酮(4′,5-dihydroxyflavone),度值80,中介中心度0.28;β-谷甾醇(beta-sitosterol),度值52,中介中心度0.22;(2R)-7-羟基-2-(4-羟基苯基)苯并四氢吡喃-4-酮[(2R)-7-hydroxy-2-(4-hydroxyphenyl)chroman-4-one],度值33,中介中心度0.06;甘草素(liquiritigenin),度值29,中介中心度0.05。黄精的多种活性成分作用于多个靶基因,体现黄精治疗阿尔茨海默病的多靶点特征。
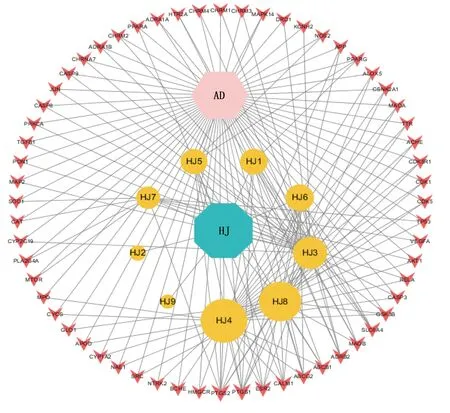
图2 中药-活性成分-靶点-疾病网络图(AD为阿尔茨海默病;HJ为黄精。粉色六边形代表阿尔茨海默病,蓝色八边形代表黄精,黄色圆形代表黄精的有效成分,橘色不规则四边形代表药物的潜在靶点)
2.4 PPI蛋白互作网络分析 利用String平台与Cytoscape软件构建黄精与阿尔茨海默病交叠靶点的PPI网络图,详见图3。共包含60个节点、186条边,平均度值为6.2,其中,节点为靶点蛋白,边为各蛋白间互作关系。PPI网络图表明这些靶点相互联系,且多方面协同作用治疗阿尔茨海默病。节点连接边数越多的代表其在网络中越重要,通过网络拓扑学分析,其中高于平均度值的靶蛋白共有21个,分别为淀粉样β前体蛋白(APP)、转录因子AP-1(JUN)、细胞肿瘤抗原p53(TP53)、丝氨酸/苏氨酸-蛋白激酶1(AKT1)、原癌基因酪氨酸蛋白激酶(SRC)、转录因子p65(RELA)、半胱氨酸天冬氨酸蛋白酶-3(CASP3)、前列腺素G/H合酶2(PTGS2)、血管内皮生长因子A(VEGFA)、丝裂原活化蛋白激酶14(MAPK14)、过氧化氢酶(CAT)、毒蕈碱乙酰胆碱受体M(CHRM1)、半胱氨酸天冬氨酸蛋白酶-8(CASP8)、丝氨酸/苏氨酸-蛋白激酶MTO(MTOR)、一氧化氮合酶2(NOS2)、细胞色素C(CYCS)、过氧化物酶体增殖物激活受体γ(PPARG)、半胱氨酸天冬氨酸蛋白酶-9(CASP9)、糖原合成酶激酶-3β(GSK3B)、5-羟色胺受体2A(HTR2A)、细胞色素P 450 2C19(CYP2C19);度值分别为23,22,20,19,14,13,12,12,12,10,10,9,9,9,8,8,8,8,7,7,7。以上可能为黄精治疗阿尔茨海默病的关键靶点。
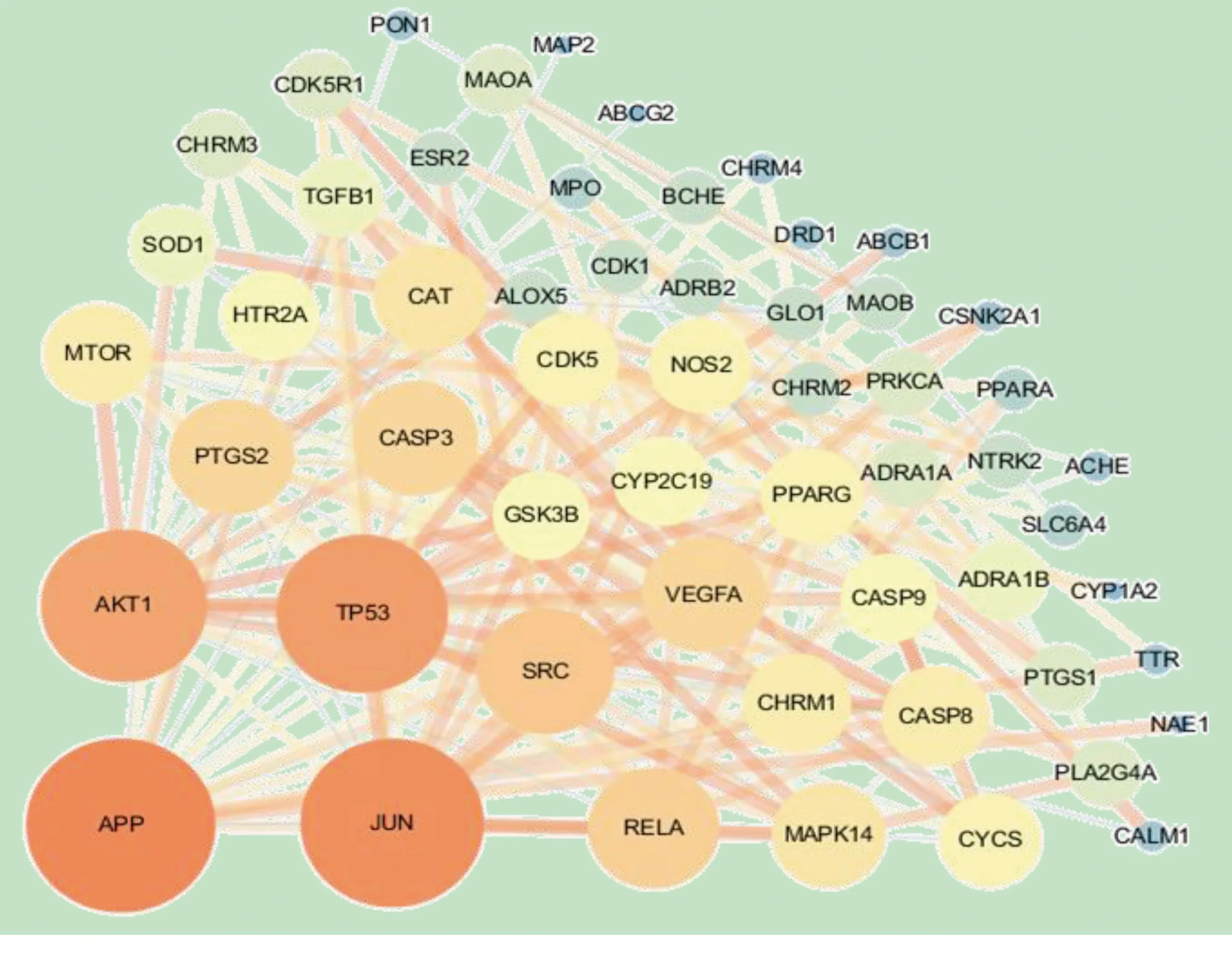
图3 交叠靶点的PPI网络图
2.5 共有靶点GO富集分析及KEGG通路富集分析 将药物-疾病共有靶点导入Metascape数据库进行GO富集分析及KEGG通路富集分析。GO生物途径(biology process,GO-BP)分析共获得1 277个条目,按照P值取前10个条目,分别是血液循环、细胞对氮化合物的反应、老化、对有毒物质的反应、肽链丝氨酸磷酸化、神经元死亡、对铵离子的响应、节律过程、生长调节、对营养水平的反应。GO细胞成分(cellular component,GO-CC)分析共获得73个条目,按照P值取前10个条目,分别是突触后、膜筏、细胞器囊腔、细胞质核周区、线粒体包膜、核包络、神经肌肉接头、过氧化物酶体、血小板α颗粒腔、溶质液泡。GO分子功能(molecular function,GO-MF)分析共获得78个条目,按照P值取前10个条目,分别是G蛋白偶联胺受体活性、血红素结合、铵离子结合、蛋白质同聚活性、泛素蛋白连接酶结合、蛋白激酶活性、磷酸酶结合、肾上腺素能受体活性、半胱氨酸型内肽酶参与凋亡信号通路的研究、转录因子结合。横轴按P值排列,纵轴表示包含的基因数目,详见图4。KEGG通路分析共254条,按P值取前20条通路分别为卡波西肉瘤相关疱疹病毒感染、5-羟色胺能突触、钙信号通路、阿尔茨海默病、可卡因成瘾、血管内皮生长因子信号通路、松弛素信号通路、环腺苷3′,5′-单磷酸(cAMP)信号通路、长寿调节途径、磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)信号通路、心肌细胞的肾上腺素能信号、帕金森病、有丝分裂动物、间隙结、阿米巴、癌组织中的微RNA、腺苷酸活化蛋白激酶(AMPK)信号通路、肾细胞癌、胆汁分泌、细胞周期。详见图5。
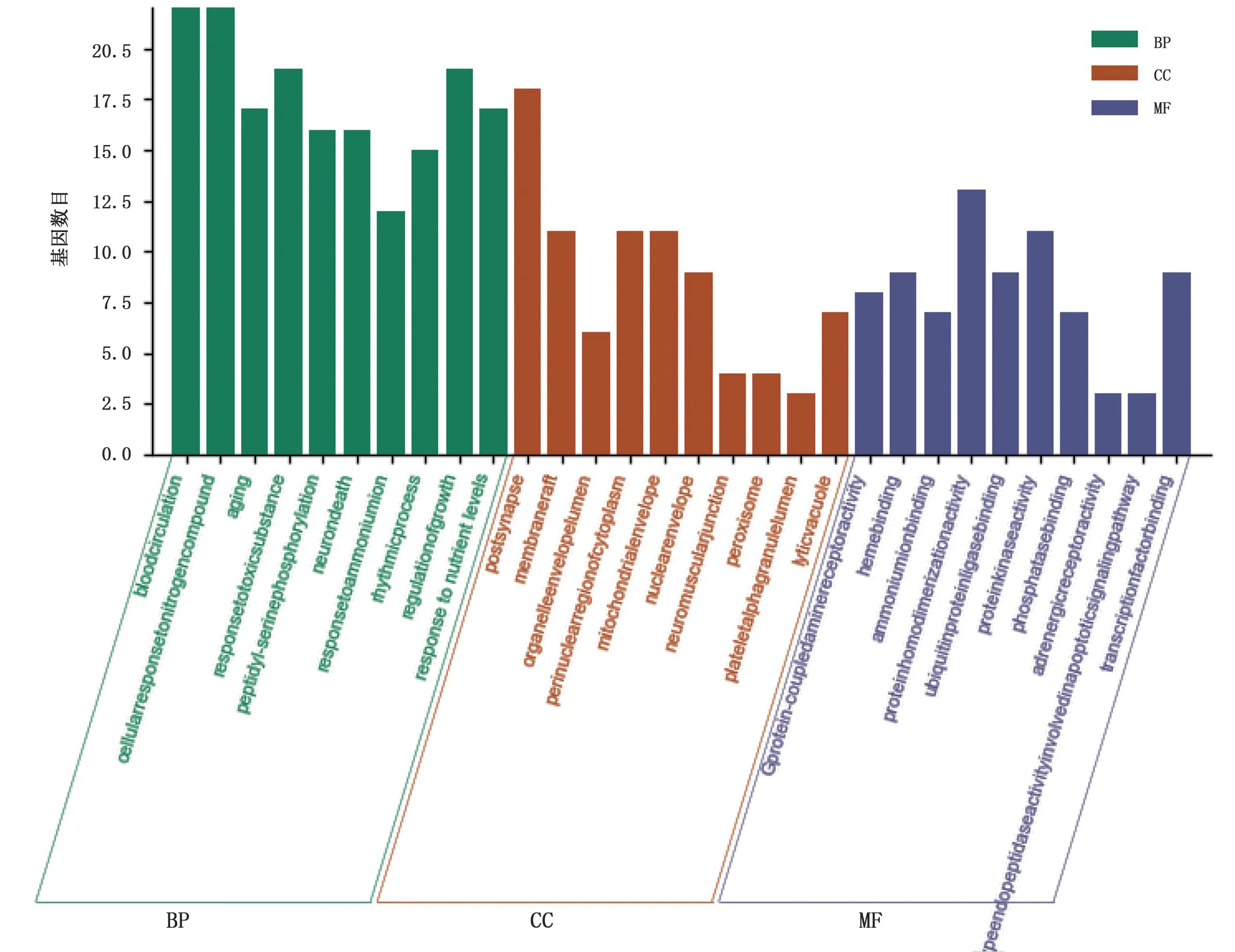
图4 GO功能富集分析

图5 KEGG通路富集分析
3 讨 论
本研究通过网络药理学方法,以黄精为研究对象,探讨其治疗阿尔茨海默的作用机制。根据类药性及口服生物利用度共筛选出12种黄精的药物成分,其中9种具有对应的靶点,主要包括黄酮类[liquiritigenin、baicalein、3′-methoxydaidzein、(2R)-7-hydroxy-2-(4-hydroxyphenyl)chroman-4-one、4′,5-dihydroxyflavone]、皂苷类[diosgenin、(+)-syringaresinol-O-beta-D-glucoside]及植物甾醇类(sitosterol、beta-sitosterol)。有研究发现,甘草素(liquiritigenin)具有抗炎、参与酶反应、抗菌、抗氧化、抗精神抑郁等作用[21]。黄芩素(baicalein)具有抗炎、抗氧化、抗衰老、保护线粒体、清除自由基、免疫调节的功能[22-23]。β-谷甾醇(beta-sitosterol)具有清除自由基、抗氧化、抗炎、免疫调节、抗焦虑、抑制自主活动等作用[24-25]。薯蓣皂苷(diosgenin)具有抗炎、抗骨质疏松、心脏保护、抗氧化营养神经等作用[26]。
由PPI获得关键靶点21个,其中富集程度较高的前6种分别是APP、JUN、TP53、AKT1、SRC、RELA。APP即淀粉样β前体蛋白(amyloid-beta precursor protein),其变异导致蛋白质异常表达及剪切途径改变,致使Aβ蛋白增加及代谢异常,从而沉积形成老年斑,进一步诱发神经原纤维缠结、神经元细胞缺失等。APP是导致家族性阿尔茨海默病神经病理学表现的因果基因,也是阿尔茨海默病中淀粉样蛋白假说的核心[27-28]。JUN是转录因子AP-1(transcription factor AP-1)组的一员,通过细胞周期调节因子的功能和表达控制细胞存亡[29]。TP53即细胞肿瘤抗原p53(cellular tumor antigen p53)具有参与调控细胞周期、细胞凋亡、糖代谢及作为转录因子调节昼夜节律的功能[30],同时与记忆丧失、神经变性相关[31]。AKT1是3种被称为AKT激酶的紧密相关的丝氨酸/苏氨酸蛋白激酶之一,具有多种功能,包括调控机体的新陈代谢、血管生成、影响突触可塑性和神经元存活等,在神经退行性疾病中发挥重要作用[32]。原癌基因酪氨酸蛋白激酶(SRC)主要参与基因转录、免疫反应、细胞黏附、细胞周期进展、凋亡、迁移和转化[33]。转录因子p65(RELA)与炎症、免疫、分化、细胞生长、肿瘤发生和凋亡等生物学过程相关[34]。通过分析发现这些靶点与阿尔茨海默病密切相关,且主要富集于神经变性、细胞凋亡等方面。
GO功能富集分析显示,黄精可调控血液循环、细胞反应与凋亡、衰老、节律等生物过程。KEGG通路富集分析显示,黄精通过多条途径影响阿尔茨海默病的发生发展。其中5-羟色胺能突触通路(serotonergic synapse)共12个基因富集,包括ALOX5、APP、CASP3、CYP2C19、HTR2A、MAOA、MAOB、PLA2G4A、PRKCA、PTGS1、PTGS2、SLC6A4。5-羟色胺是中枢神经系统调节多种生理功能的递质之一,其通路涉及较多基础和高级大脑功能,通过海马体和前额叶皮层影响认知,其活性降低导致认知下降并伴有阿尔茨海默病的精神行为变化[35-36]。钙信号通路(calcium signaling pathway)共有12个基因富集,通过调控突触可塑性变化,影响学习和记忆;通过调节神经元兴奋性,影响信息处理和认知;钙信号转导机制失调可能影响阿尔茨海默病的发生发展[37-38]。血管内皮生长因子信号通路(VEGF signaling pathway)共8个富集基因,VEGF信号级联可激活血管生成、神经营养和细胞保护过程,抑制脑淀粉样血管病变,促进神经细胞存活等影响阿尔茨海默病进程[39]。松弛素具有保护心肌、扩张血管、血管重塑及抗纤维化的作用,松弛素通路(relaxin signaling pathway)引起多种靶组织细胞中PI3K、cAMP增加[40]。有研究表明,高表达的PI3K/Akt可有效对抗Aβ诱导的细胞毒性,减少细胞凋亡,逆转Aβ诱导的Tau蛋白磷酸化[41]。cAMP参与细胞生长和分化、基因转录和蛋白表达的调控,同时cAMP/蛋白激酶a(PKA)信号调节与突触可塑性变化和认知行为相关[42]。
综上所述,黄精通过多成分、多靶点、多途径治疗阿尔茨海默病。网络药理学发现新的富集程度高的靶点基因和新通路,为全面认识与治疗疾病和中医药现代化拓宽了渠道。本研究为黄精治疗阿尔茨海默病提供依据,也为临床治疗阿尔茨海默病及新型药物的开发提供了思路。
