基于网络药理学和分子对接技术探讨参附注射液治疗休克的分子机制
2022-01-07马晓昌于盼盼施保柱
董 妍,马晓昌,于盼盼,李 春,施保柱
参附注射液作为传统方剂参附汤的现代用药形式,最早见于宋代严用和的《济生方》,参附注射液是由红参、附片提取制成的中药注射剂,主要治疗阳气暴脱的厥脱症(感染性休克、心源性休克、低容量性休克等),也可用于阳虚(气虚)所致的惊悸、怔忡、喘咳、胃疼、泄泻、痹症等[1]。现代药理研究发现,参附注射液可提高组织氧摄取和氧利用,改善血流动力学,但作用机制未明确[2-3]。网络药理学结合了系统生物学、多向药理学、计算生物学、网络分析等多学科技术和内容,从多靶点研究角度出发,实现药物作用综合网络分析,其整体性、系统性特点与中药及方剂的多成分、多途径、多靶点协同作用的原理一致[4]。本研究基于网络药理学和分子对接探讨参附注射液治疗休克的分子机制。
1 资料与方法
1.1 参附注射液相关靶点筛选 通过中医药系统药理学平台[5](TCMSP,https://tcmspw.com/tcmsp.php)寻找2味中药化学组成成分,根据口服生物利用度(oral bioavailability,OB)≥30%且类药性(drug-likeness,DL)≥0.18的2个药代动力学(ADME)属性值进行活性成分的初步筛选以获得活性化合物及其作用的蛋白质靶点,并根据已发表的文献报道补充未预测到的活性化合物的已知靶点。筛选结束后,作为标准化蛋白质靶点信息,统一在UniProt蛋白质数据库(https://www.uniprot.org)将化合物作用的蛋白质靶点进行规范。
1.2 休克相关靶点筛选 以“shock”“circulation shock”“休克”为关键词,挖掘基因数据库(GeneCards,https://www.genecards.org)、人类孟德尔遗传数据库(OMIM,http://www.omim.org)、治疗靶点数据库(TTD,http://bidd.nus.edu.sg/group/cjttd)中治疗休克的潜在靶点,合并3个数据库疾病靶点后,删除重复数值得到休克相关的靶点。
1.3 参附注射液-休克成分靶点蛋白-蛋白相互作用(PPI)网络构建 为明确参附注射液相关靶点与休克靶点间的相互作用,采用Cytoscape 3.7.1软件功能构建PPI,并整合提取其交集网络进行拓扑结构分析。以网络节点中的拓扑结构特征值“连接度(degree)”为指标,选择大于其中位数2倍以上的节点作为关键候选靶点;提取分析这些候选节点网络关系,计算每个节点的“连接度”“介度(betweenness)”“紧密度(closeness)”“最近公共祖先(LAC)”“邻域连接度(nighborhood connectivity)”,共5个拓扑结构特征值并进行二次筛选,最终选择上述5个特征值均大于其相应中位数的节点作为关键靶点。进而将交集靶点提交至STRING 11.0数据库(https://string-db.org)构建PPI网络模型[6]。居前10位靶点基因通过Cytoscape 3.7.1软件进行可视处理。
1.4 靶点通路的注释和分析 通过DAVID数据库(https://david.ncifcrf.gov)[7]对上述预测得到的关键靶点信息进行基因本体(GO)富集分析及京都基因与基因组百科全书(KEGG)通路注释分析。将参附注射液有效成分对应的关键靶点直接映射到通路上,通过药物靶点富集得到的通路是药物发挥主要调节作用的重要途径,由此得到参附注射液治疗休克的相关生物学过程及代谢通路信息。应用在线绘图软件微生信(http://www.bioinformatics.com.cn)进行绘图。
1.5 成分-靶点-通路网络图的构建 运用Cytoscape 3.7.1构建参附注射液成分-休克靶点-通路网络图,利用Cytoscape 3.7.1内置工具分析有效成分及靶点的网络拓扑参数,包括连接度、介度及紧密度等,并根据网络拓扑学参数判断核心靶点及发挥药效的主要活性成分。
1.6 成分靶点分子对接 分子对接是通过匹配原则,计算并预测配体与受体的相互作用模式,选取参附注射液主要活性成分,从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)下载化合物的3D结构并转换格式,从PDB数据库(https://www.rcsb.org/)下载靶点蛋白的分子结构PDB格式文件。通过PyMol软件去水分子及自身配体,并运用AutoDock软件去水、加氢后进行分子对接。
2 结 果
2.1 参附注射液成分靶点获取
2.1.1 活性化合物的筛选 通过TCMSP网站检索到红参、附子中化合物共139个,其中74个来自红参、65个来自附子。以OB≥30%且DL≥0.18,筛选出活性化合物共25个,其中4个来自红参,21个来自附子。参附注射液中主要活性化合物基本信息见表1。
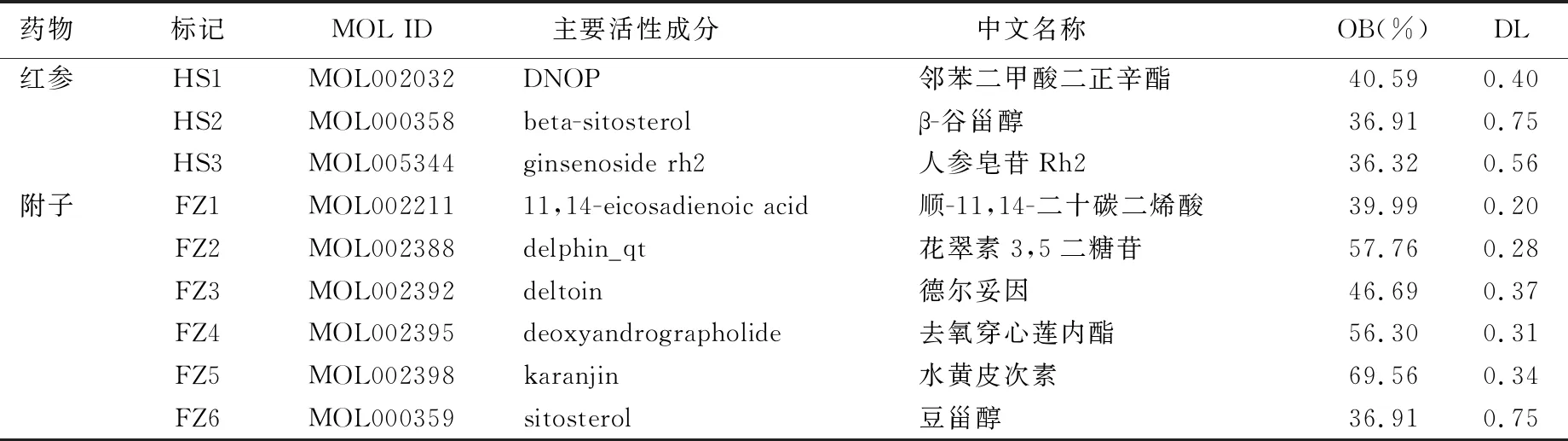
表1 参附注射液中主要活性化合物基本信息
2.1.2 参附注射液成分-靶点网络 对获得的有效成分结合UniProt数据库确认并转换,其中红参共55个靶点、附子共30个靶点,合并后删除重复靶点,最终获得57个。将参附注射液的候选化合物与对应的靶蛋白导入Cytoscape 3.7.1软件构建“成分-靶点”网络,详见图1。图中八边形为靶点基因,三角形为化学成分,共57个靶点、94条边,代表了成分与靶点之间的作用关系。体现了参附注射液多成分、多靶点的整体协同作用。

图1 参附注射液成分-靶点网络(节点的大小、颜色与节点的度值成正比)
2.2 休克相关靶点获取 从GeneCards数据库获得休克相关靶点8 858个。根据经验设定Score大于中位数的目标靶点为休克的潜在靶点,通过GeneCards所得休克靶点Score最大值为66.57,最小值为0.14,中位数为0.80,故设定Score≥0.80的靶点为休克的潜在靶点,根据目标靶点数量再次进行中位数筛选,直至取得目标靶点。结合OMIM数据库(200个)、TTD数据库(1个)筛选、补充相关靶点,合并后删除重复值,最终得到休克相关靶点1 375个。将筛选的参附注射活性成分靶点与休克相关靶点取交集,得到参附注射液成分-休克共同靶点30个,应用在线绘图软件微生信绘制Venn图,详见图2。

图2 药物-疾病靶点Venn图
2.3 参附注射液成分-休克相关靶点PPI网络的构建 将靶点提交至Cytoscape 3.7.1软件构建成分、疾病靶点的PPI,结果发现共2 990个药物预测靶点及12 674个休克治疗靶点具有PPI作用,其中包括2949个重叠靶点。取2个蛋白互作网络的交集靶点并计算每个点的拓扑结构特征值,得到整个网络节点“连接度”的中位数为26,因此选择≥2倍的中位数“连接度≥52”的节点作为候选靶点,共筛选到822个候选靶点;对候选靶点的相互作用信息进行提取分析,并以“连接度”“介度”“紧密度”“最近公共祖先”“邻域连接度”大于其相应中位数为筛选条件进一步选择合适的节点,即连接度≥89,介度≥324.438,紧密度≥0.516,最近公共祖先≥17.661,邻域连接度≥126.366,共得到参附注射液治疗休克的关键靶点146个,详见图3。将全部节点关系信息导出并导入Cytoscape 3.7.1软件,对连接度居前10位的基因进行筛选,并构建PPI网络核心基因图,详见图4。
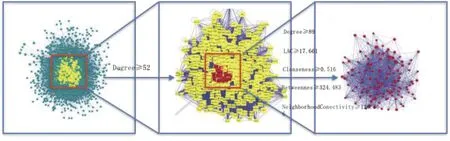
图3 参附注射液治疗休克的关键靶点筛选流程图
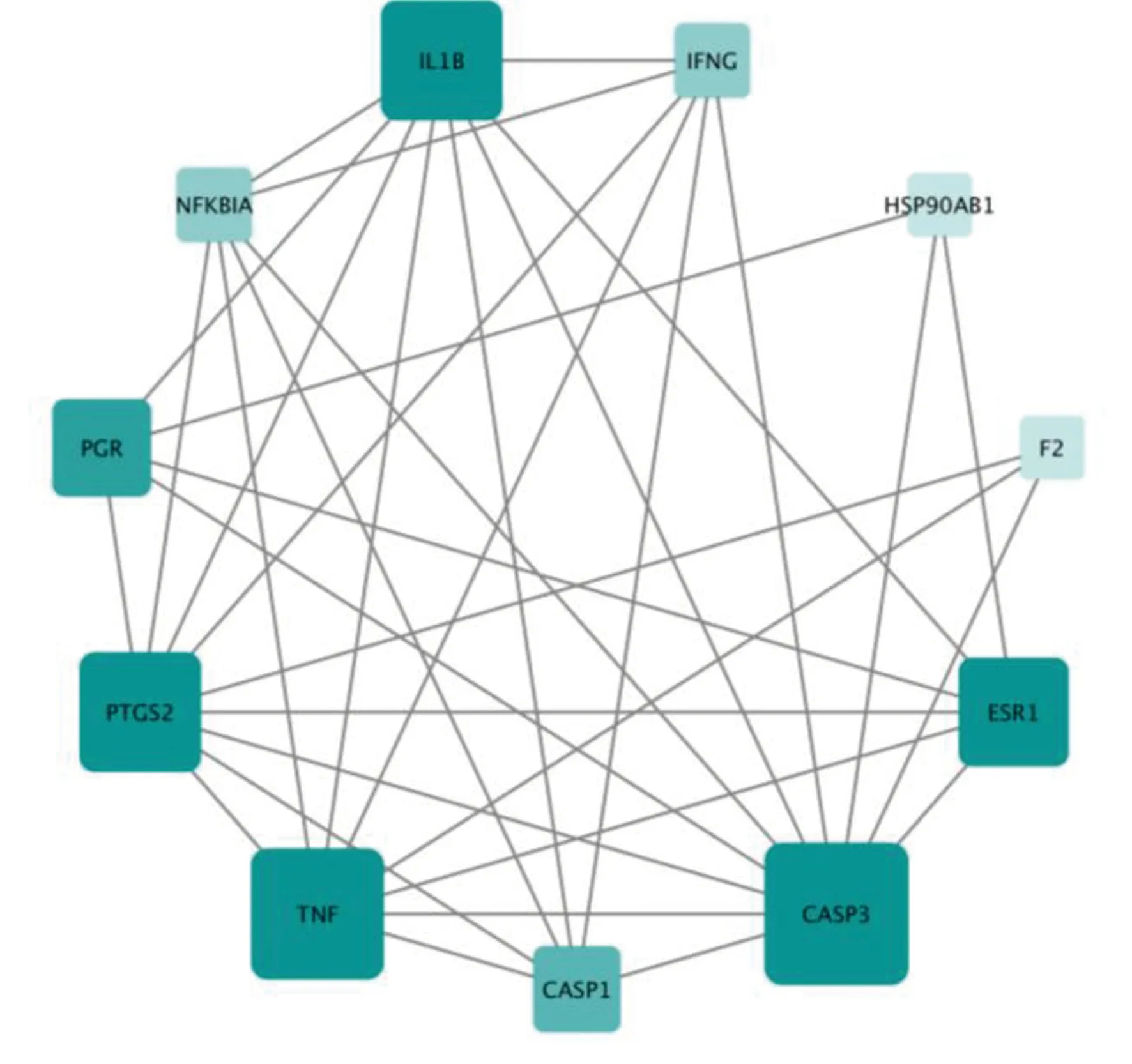
图4 网络核心基因网络图(连接度居前10位)(节点大小、颜色与节点的度值成正比)
2.4 靶点功能与通路的富集分析 利用DAVID数据库中GO功能富集分析得到GO条目273个(P<0.05),其中生物过程(BP)条目207个,细胞组成(CC)条目21个,分子功能(MF)条目45个,对连接度居前10位的信号通路采集相关信息,运用在线绘图软件微生信进行富集分析绘图,详见图5。KEGG通路富集筛选得到86条信号通路(P<0.05),涉及pathways in cancer、hepatitis B、influenza A、chagas disease、TNF signaling pathway等信号通路,对连接度居前10位信号通路进行信息汇总,详见表2。通过在线绘图软件微生信进行绘图,详见图6。
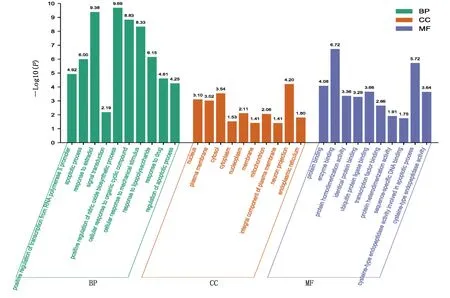
图5 GO功能富集分析柱状图
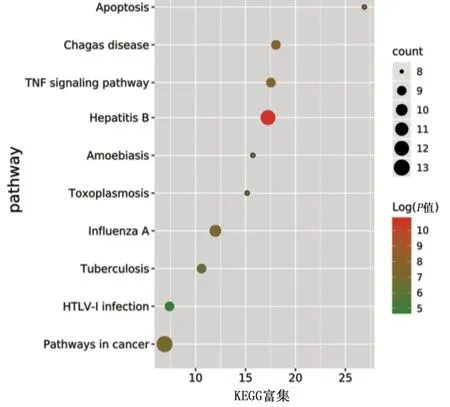
图6 KEGG通路富集分析气泡图

表2 KEGG富集分析连接度居前10位的通路
2.5 “成分-靶点-通路”网络构建 将参附注射液治疗休克的57个关键靶点蛋白及对应的8个潜在成分与KEGG信号通路富集分析居前10位信号通路制作“成分-靶点-通路”网络关系表,并导入Cytoscape 3.7.1软件,构建参附注射液治疗休克的“成分-靶点-通路”网络图,三角形为成分,八边形为通路名称,棱形为靶点名称,详见图7。参附注射液的主要有效成分通过pathways in cancer、hepatitis B、influenza A、TNF signaling pathway等通路,作用于磷酸肌醇3-激酶CG(PIK3CG)、核转录因子κB1A(NF-κB1A)、半胱天冬氨酸蛋白酶-3(CASP3)等靶点,发挥治疗休克的功能,体现了参附注射液多成分-多靶点-多通路治疗作用特点。
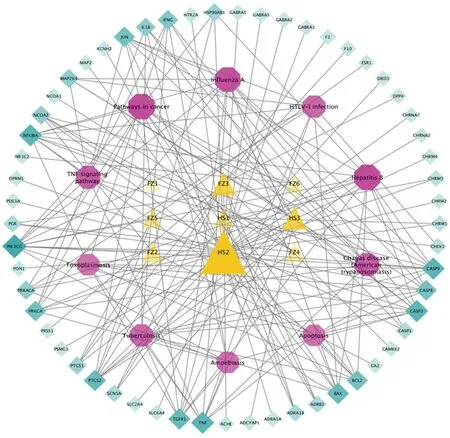
图7 参附注射治疗休克成分-靶点-通路网络图(节点大小、颜色与节点度值成正比)
2.6 参附注射液主要成分与关键靶点进行分子对接 为了阐述参附注射液治疗休克的潜在靶点与对应活性成分之间的结合活性,将参附注射液活性成分分别与PIK3CG、CASP3和NF-κB1A进行分子对接,一般认为分子对接结合能<0表示配体与受体可自发结合,但对于高结合性分子的界定尚无统一标准,根据文献报道,结合能≤-5.0 kJ/mol,小分子配体与受体结合较好[8]。详见图8~图13、表3。

图8 Karanjin-CASP3分子对接结果

图9 Deltoin-CASP3分子对接结果
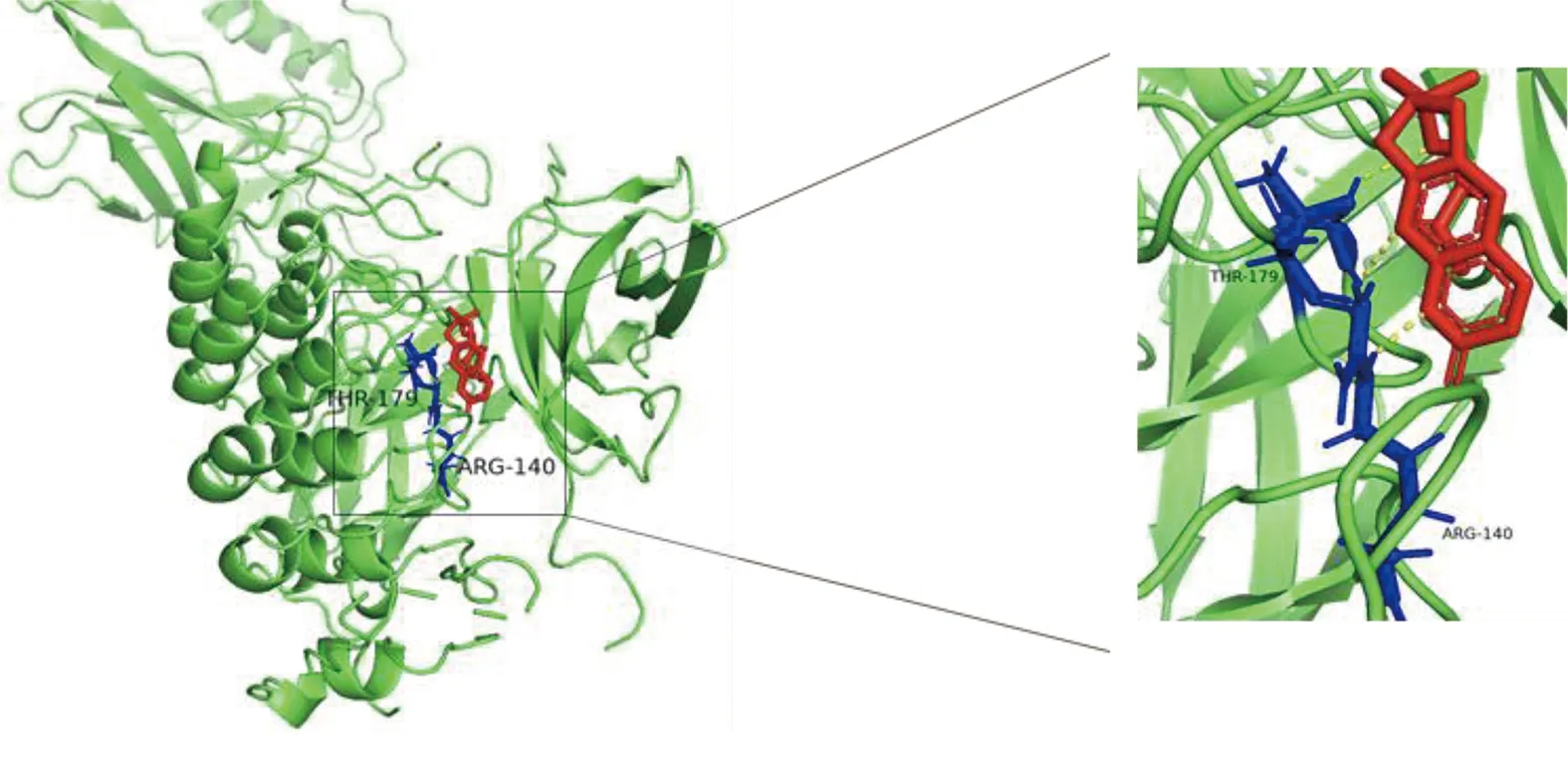
图10 Deltoin-NF-κB1A分子对接结果
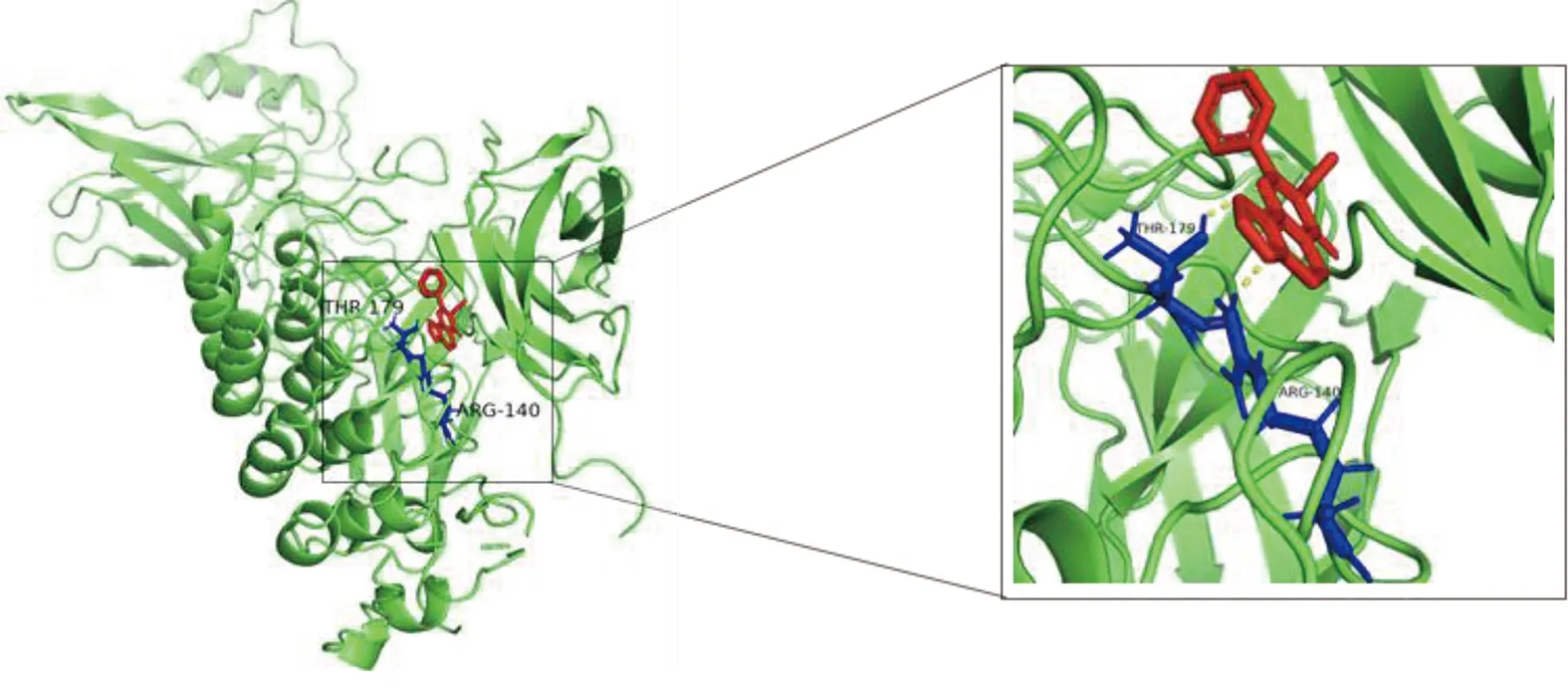
图11 Karanjin-NF-κB1A分子对接结果
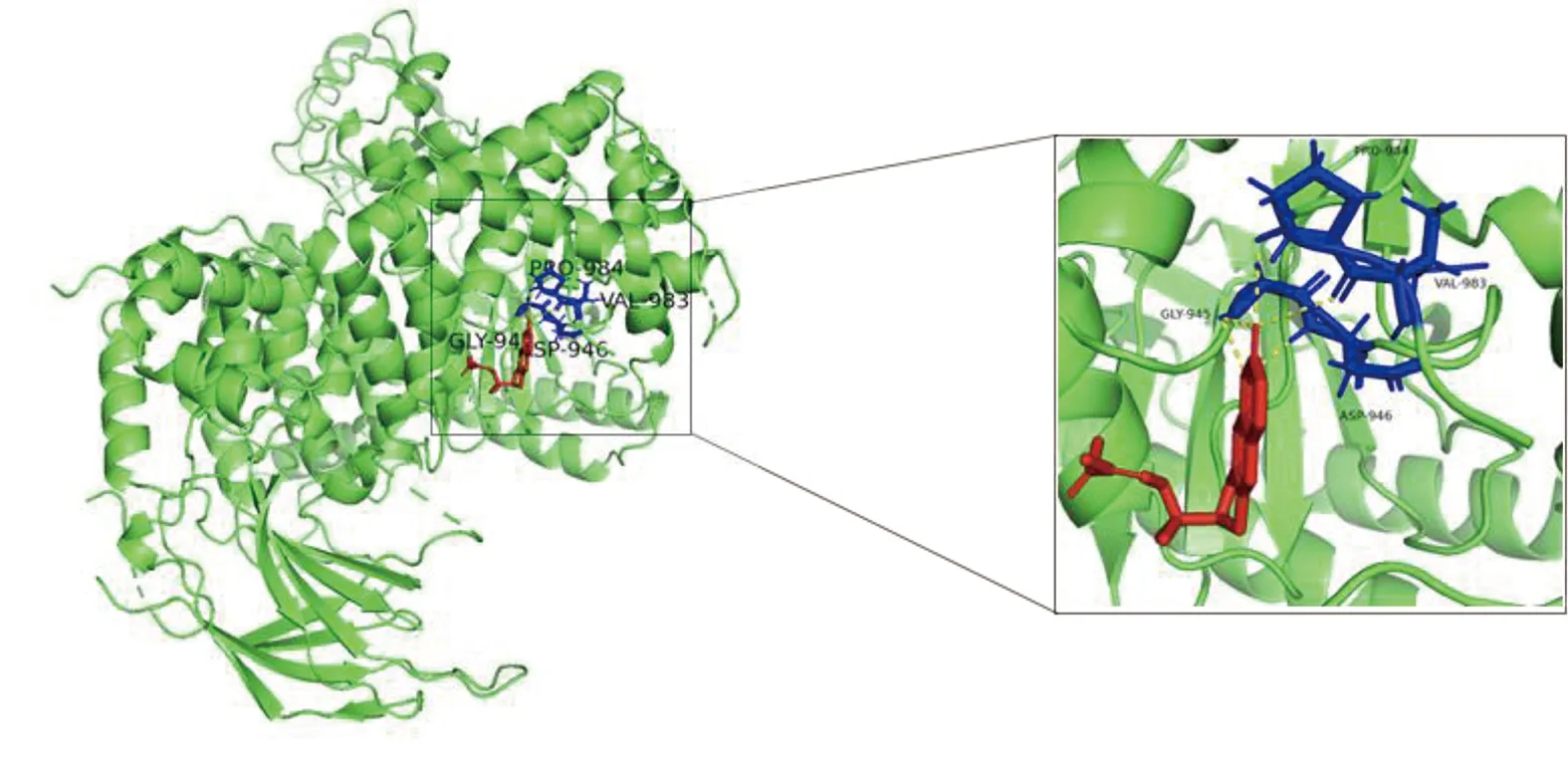
图12 Deltoin-PIK3CG分子对接结果
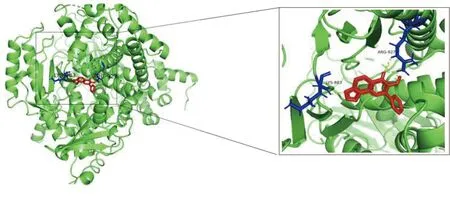
图13 Karanjin-PIK3CG分子对接结果
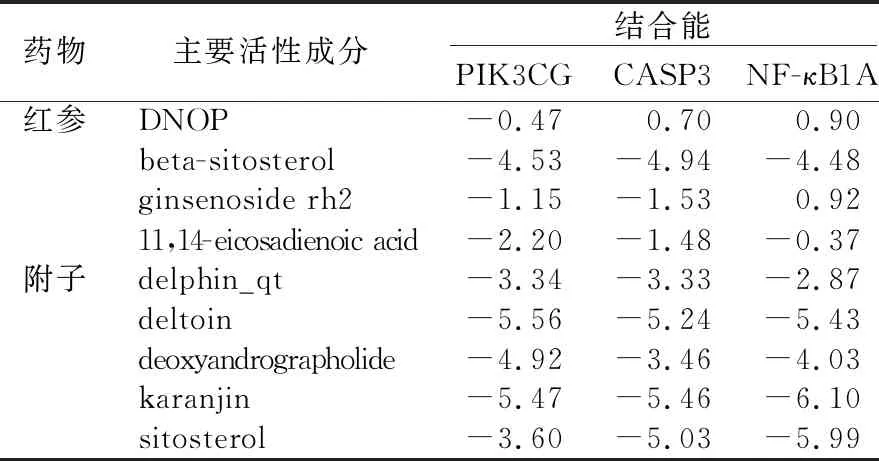
表3 参附注射液主要活性成分分子对接结果 单位:kJ/mol
3 讨 论
休克是指在各种强烈致病因子作用下,机体出现有效循环血量急剧减少,组织灌注严重不足,甚至出现器官功能障碍[9]。有研究显示,能量代谢障碍、过度炎症反应、氧自由基损伤、血管低反应性、凝血功能紊乱是休克的主要机制,其中炎症反应是休克进一步发生发展的重要原因之一[10]。休克发生后,微循环灌注减少,发生广泛的组织缺氧,刺激机体炎症细胞活化,产生大量炎性因子,涉及内毒素的直接攻击、细胞黏附分子过表达、丝裂原活化蛋白激酶通路活化等多种机制[11]。
参附注射液作用广泛,通过调节血压和心率、保护心肌细胞、改善微循环及血液流变学、降低炎性因子表达等达到抗休克的目的。《参附注射液急重症临床应用专家共识》推荐针对脓毒性休克病人,在血管活性药物基础上加用参附注射液以稳定血压,减少血管活性药物用量[12]。现代药理研究发现,参附注射液主要含有乌头类生物碱和人参皂苷类,还含有少量的有机酸、核苷、氨基酸、多糖及金属元素等[13],可降低超敏C反应蛋白、白细胞介素-6及肿瘤坏死因子-α水平,提高白细胞介素-10含量,达到促炎/抗炎因子趋于平衡,有效控制休克时炎症反应[14],还可抑制大鼠心肌组织核转录因子-κB活化及肿瘤坏死因子-α蛋白表达,发挥抗炎作用[15]。
本研究通过网络药理学方法初步筛选出参附注射液治疗休克的活性成分为β-谷甾醇、人参皂苷Rh2、去氧穿心莲内酯、豆甾醇等。β-谷甾醇可明显降低组胺诱发的小鼠毛细血管通透性增加,可能抑制前列环素E2、缓激肽、组胺、5-羟色胺等炎症介质活性,发挥抗炎作用[16]。人参皂苷Rh2是红参中的特有皂苷,具有抗氧化和抗炎的作用。Rh2通过抑制核转录因子-κB活化减轻机体炎症状态[17]。豆甾醇可降低结肠组织炎性因子白细胞介素-1、白细胞介素-6、单核细胞趋化蛋白1和环氧合酶2的mRNA表达[18]。穿心莲内酯能抑制核转录因子-κB、环氧合酶2,降低细胞黏附中E-选择素产生、抑制细胞间黏附分子1,最终起到抗炎效果[19]。
通过PPI与通路的富集分析发现,pathways in cancer (hsa05200)、hepatitis B(hsa04066)、influenza A(hsa05164)等是参附注射发挥抗休克治疗作用的主要信号通路。pathway in cancer信号通路中包括核转录因子-κB、CAPS3、HSP90AB1、JUN等基因,hepatitis B信号通路包含PIK3CG、IL-1β、CASP3、TNF、CASP9等基因。CASP3是执行相关胱天蛋白酶中参与细胞凋亡的重要执行因子,是常见的被激活的凋亡相关蛋白酶[20]。肿瘤坏死因子-α刺激白细胞介素和趋化因子,诱导白细胞在炎症部位大量聚集,还可与靶细胞上受体结合启动信号转导通路,从而诱导炎症反应。肿瘤坏死因子-α可促进蛋白水解酶和氧自由基释放,加速炎症进展[21]。白细胞介素-1β具有激活白细胞介素-1信号通路和髓样分化因子依赖的核转录因子-κB通路,正反馈作用促进白细胞介素-1等促炎性细胞因子转录,诱导机体发生炎症反应[22]。
核转录因子-κB是炎症过程中肿瘤坏死因子-α信号转导的关键调节因子,肿瘤坏死因子触发多种途径的激活,包括核转录因子-κB和丝裂原活化蛋白激酶途径[23]。磷酸肌醇3-激酶(PI3K)参与免疫、炎症和过敏反应。调节白细胞向炎症部位的趋化性和对化学引诱剂的反应[24]。基因靶点主要富集在PIKCG、核转录因子-κB、CAPS3,故与参附注射液主要成分进行分子对接验证。对接结果显示:Karanjin(水黄皮次素)、Deltoin(德尔妥因)与PIKCG、核转录因子-κB、CAPS3结合能≤-5.0 kJ/mol,小分子配体与受体结合较好,可能是参附注射液发挥抗休克作用主要活性成分。德尔妥因可抑制炎症反应[25],水黄皮次素能降低肿瘤坏死因子α产生,显著抑制核转录因子-κB表达,并明显抑制肿瘤坏死因子α诱导的巨噬细胞产生一氧化氮和活性氧,并对枯草芽孢杆菌和大肠杆菌细胞生长有一定的抑制作用[26-27]。
综上所述,基于网络药理学分析结果,认为参附注射液中的活性成分β-谷甾醇、去氧穿心莲内脂、水黄皮次素、豆甾醇、人参皂苷rh2,主要通过pathways in cancer(hsa05200)、hepatitis B(hsa04066)、influenza A(hsa05164)等通路作用于PIK3CG、NF-κB1A、CAPS3等靶点,发挥抗炎、抗休克等作用。分子对接结果表明:水黄皮次素、德尔妥因与PIKCG、NF-κB1A、CAPS3结合力较强,可能是抑制休克炎症反应的主要活性成分。本研究存在一些不足:有效成分相关靶点寻找和确认方法需优化,进一步验证结论开展动物实验研究。
