应用UPLC-QTOF-MS 分析滇乌头碱中毒大鼠尿液非靶向代谢组学
2022-01-07周惠黠刘欢韩雪聂胜洁张荣平于建云李树华
周惠黠,刘欢,韩雪,聂胜洁,张荣平,于建云,李树华
1.昆明医科大学法医学院,云南 昆明 650500;2.昆明医科大学司法鉴定中心,云南 昆明 650500;3.昆明医科大学药学院,云南 昆明 650500;4.云南中医药大学中药学院,云南 昆明650500
黄草乌(Aconitum vilmorinianum Komarov)为毛茛科乌头属植物,云南特色中草药,有镇痛、抗感染等药理活性,具有较高的医学药用价值[1]。但黄草乌毒性强、安全窗口小,因加工不当或过量使用引起中毒或死亡病(案)例多发,限制了黄草乌及其制剂的开发利用。黄草乌中化学成分复杂,滇乌头碱(Yunaconitine)是其主要毒性或活性成分之一,为二萜类双酯型生物碱。目前对黄草乌及滇乌头碱的研究,主要集中于黄草乌中生物碱成分的分离及其含量测定[2]、毒性试验研究[3-4]等。
现代毒理学研究结果[5-6]表明,药物的药效和毒性与其代谢过程及影响的体内代谢通路密切相关。代谢组学(metabolomics)通过定量检测内源性小分子代谢物的变化,客观反映药物或毒物扰动所引起的整体代谢变化,作为一种毒性评价手段,代谢组学在中草药毒性机制、整体疗效和安全性评价等研究中被广泛应用。DONG等[7]通过超高效液相色谱-四极杆-飞行时间高分辨质谱(ultra-performance liquid chromatography-quadrupole-time of flight high definition mass spectrometry,UPLC-Q-TOF/HDMS)对川乌中毒大鼠尿液进行代谢组学分析,发现17 种差异代谢物的变化与川乌的心脏和肝毒性有关。川乌与黄草乌同属毛茛科乌头属,但川乌为北草乌,其主要毒性成分为乌头碱等生物碱,而黄草乌中的主要毒性成分为滇乌头碱等生物碱,乌头碱与滇乌头碱的毒性存在差异[8]。卢发焕等[4]采用稀盐酸溶剂溶解滇乌头碱,成功建立滇乌头碱大鼠急性中毒模型,结合云南多见的食用油脂性食物炖煮黄草乌中毒案例[9],本研究拟通过超高效液相色谱-四极杆-飞行时间质谱(ultra performance liquid chromatography-quadrupole-time of flight mass spectrometry,UPLC-QTOF-MS)非靶向代谢组学技术对不同溶剂中滇乌头碱中毒的代谢变化进行研究,通过分析毒性相关的潜在生物学标志物的变化和病理形态学改变来探讨滇乌头碱中毒的可能毒性机制,丰富黄草乌中毒的法医毒理学研究数据,为法医学鉴定提供依据。
1 材料与方法
1.1 主要仪器与试剂
1290 Infinity Ⅱ液相色谱系统(美国Agilent 公司),Triple TOF 6600 高分辨质谱(美国AB SCIEX 公司),Waters ACQUITY UPLC BEH Amide 色谱柱(2.1 mm×100 mm,1.7 μm;美国Waters 公司),Heraeus Fresco 17 微量离心机(美国Thermo Fisher Scientific公司),BSA124S-CW 天平(德国Sartorius 公司)。
滇乌头碱(纯度为98.89%,成都曼斯特生物科技有限公司),L-2-氯苯丙氨酸(纯度≥98%,上海恒柏生物科技有限公司),甲醇、乙腈、乙酸铵、氨水(色谱纯,德国CNW Technologies公司),盐酸(分析纯,重庆川东化工有限公司),橄榄油(福建福满佳食品有限公司)。
1.2 实验动物
成年健康雄性SD 大鼠16 只(湖南斯莱克景达实验动物有限公司),体质量(270±20)g,于安静环境昼夜交替各12 h、温度22 ℃~23 ℃、湿度50%~60%的环境饲养,自由饮水摄食。
本研究动物实验经昆明医科大学伦理委员会审查批准(审批号kmmu2021005)。
1.3 动物分组及药液配制
动物分组:滇乌头碱+橄榄油组、滇乌头碱+稀盐酸溶液组,每组各5 只大鼠,橄榄油组、稀盐酸溶液组,每组各3 只大鼠。
给药剂量的设置:据文献[1,10]报道,小鼠滇乌头碱半数致死量(lethal dose 50,LD50)为2.81 mg/kg(溶剂为1%羧甲基纤维素钠),经体表面积换算和前期预实验得出大鼠滇乌头碱LD50为2.2 mg/kg(溶剂为稀盐酸溶液),通过设置1、1/2、1/3、1/4、1/5、1/6、1/7、1/8、1/10 LD50剂量灌胃给药,获得能保证大鼠可以连续给药40 d 以上、又能表现出病理损伤改变的给药剂量为1/8 LD50(0.27 mg/kg)。
滇乌头碱+橄榄油组灌胃药液:准确称取1.21 mg滇乌头碱于具塞试管中,加入16 mL 橄榄油振荡混匀得到。滇乌头碱+稀盐酸溶液组灌胃药液:准确称取1.21 mg 滇乌头碱于具塞试管中,加入300 μL 稀盐酸(0.1 mol/L)溶解后,加入300 μL NaOH(0.1 mol/L),将pH 值调至7,再加入15.4 mL 蒸馏水振荡混匀得到。稀盐酸溶液组灌胃药液:取300 μL 稀盐酸(0.1 mol/L)于具塞试管中,加入300 μL NaOH(0.1 mol/L),将pH值调至7,再加入15.4 mL 蒸馏水振荡混匀得到。橄榄油组灌胃药液:橄榄油原液,不做其他处理。
1.4 动物染毒与样品采集
尿液采集:4 组大鼠连续40 d 于每日15:00 灌胃给药或溶剂,给药滇乌头碱后大鼠出现恶心、呕逆、心率加快、精神萎靡、步态不稳等症状。实验第39 天先将大鼠禁食12 h,自由饮水,给药后将大鼠置于代谢笼中,收集各组大鼠24 h 尿液样本于尿液采集管中,-80 ℃保存。
1.5 组织病理学检验
尿液采集完成后,腹腔注射10%水合氯醛溶液麻醉大鼠,经升主动脉灌注冰生理盐水、4%多聚甲醛溶液灌注固定后,提取大鼠心、肝、脑组织,再于4%多聚甲醛溶液中固定48 h,制作石蜡切片。
对前述固定后的4 组大鼠心、肝、脑组织进行取材,经脱水、透明、浸蜡、石蜡包埋、切片等处理后制成石蜡切片,进行苏木精-伊红(hematoxylin-eosin,HE)染色和脑组织的Nissl 染色。
1.6 UPLC-QTOF-MS 分析
1.6.1 样品处理
取尿液样品100 μL,加入400 μL 提取溶剂(V甲醇∶V乙腈=1∶1),经振荡、13 800×g离心15 min、滤膜过滤后,取75 μL 上清液进行UPLC-QTOF-MS 检测;所有样品另取10 μL 制成3 个质控(quality control,QC)样品,在相同条件下进行UPLC-QTOF-MS 检测。
1.6.2 UPLC-QTOF-MS 分析条件
液相色谱条件:柱温25 ℃,流动相A 为水相(含25 mmol/L 乙酸铵与25 mmol/L 氨水),流动相B 为乙腈,采用梯度洗脱程序(0~0.5 min,95%B;0.5~7 min,95%~65%B;7~8 min,65%~40%B;8~9 min,40%B;9~9.1 min,40%~95%B;9.1~12 min,95%B),流速为0.5 mL/min。
质谱条件:电喷雾电离(electrospray ionization,ESI),采用正、负离子模式(ESI+、ESI-)扫描,雾化气压60 psi,辅助气压30 psi,气帘气压35 psi,温度600 ℃,去簇电压60 V,喷雾电压5 000 V(正离子)/-4 000 V(负离子);碰撞诱导解离的能量为30 eV,循环时间为0.56 s。通过信息依赖性采集(information-dependent acquisition,IDA)模式进行高分辨质谱数据采集,Analyst TF 1.7 数据采集软件(美国AB SCIEX 公司)依据一级质谱数据和预先设定的标准,自动选择离子并采集其二级质谱数据。每个循环选取12 个峰强度最强且大于100 的离子进行二级质谱扫描。
1.7 数据处理
1.7.1 峰物质鉴定
使 用ProteoWizard V3 软 件(http://proteowizard.sourceforge.net/)将质谱原始数据转成mzXML 格式。再使用XCMS 3.6.2 对实验样品和3 个质控样品的二级质谱数据进行保留时间矫正、峰识别、峰提取和过滤、缺失值进行模拟、内标归一化处理后,使用R 软件包和二级质谱数据库对峰进行物质鉴定。
1.7.2 数据分析
对数据进行一系列的多元变量模式识别分析,使用SIMCA 15.0.2 软件(瑞典Sartorius Stedim Data Analytics AB 公司)将获得的数据进行主成分分析(principal component analysis,PCA)、正交偏最小二乘法-判别分析(orthogonal projections to latent structures-discriminant analysis,OPLS-DA)和t检验,通过组间比较找到橄榄油组与滇乌头碱+橄榄油组、稀盐酸溶液组与滇乌头碱+稀盐酸溶液组的差异代谢物,获得直观反映滇乌头碱给药组与对应溶剂对照组组间代谢物差异的火山图。设定筛选标准为OPLSDA 模型的第一主成分的变量投影重要度(variable importance in the projection,VIP)大于1、变化倍数(fold change,FC)大于3或小于0.33、P<0.05。
比较2 种不同溶剂滇乌头碱给药组与其对应溶剂组所得的共同差异代谢物,使用SPSS 17.0 软件(美国IBM 公司)进行t检验,比较共同差异代谢物变化倍数的差异,将符合筛选标准的差异代谢物作为与滇乌头碱毒性相关的潜在生物学标志物,将其信息通过HMDB(https://hmdb.ca/about)、PubChem(https://pubchem.ncbi.nlm.nih.gov/)、KEGG(https://www.kegg.jp/)等数据库进行检索,确定潜在生物学标志物的结构。
通过MetaboAnalyst(https://www.metaboanalyst.ca/)网站进行代谢通路的拓扑分析和富集分析,获得通路分析气泡图,筛选出差异显著的关键代谢通路。检验水准α=0.05。
2 结果
2.1 组织病理学检验
组织病理学检验结果(图1~3)显示,与橄榄油组相比,滇乌头碱+橄榄油组大鼠的肝窦扩张,肝细胞内出现多量散在的小空泡样变性;与稀盐酸溶液组相比,滇乌头碱+稀盐酸溶液组大鼠肝小叶中央静脉周围中央带出现肝索连续性中断、肝索紊乱,肝小叶结构不清等;滇乌头碱+橄榄油组与滇乌头碱+稀盐酸溶液组大鼠的心脏组织出现局部少量心肌细胞均质嗜酸样变性,大脑皮质神经元和海马神经元出现少部分神经元固缩变性。
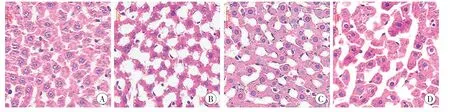
图1 各组大鼠肝组织病理学检验(HE×400)Fig.1 Histopathological examination of rats hepatic tissue in each group(HE×400)

图2 各组大鼠心肌组织病理学检验(HE×400)Fig.2 Histopathological examination of rats myocardium in each group(HE×400)

图3 各组大鼠脑组织病理学检验(Nissl×400)Fig.3 Histopathological examination of rats brain tissue in each group(Nissl×400)
2.2 代谢组学研究
PCA 显示,滇乌头碱+橄榄油组和橄榄油组、滇乌头碱+稀盐酸溶液组和稀盐酸溶液组的样本代谢轮廓分离,而滇乌头碱+橄榄油组、滇乌头碱+稀盐酸溶液组的代谢轮廓有差异,但存在部分重叠交叉(图4)。

图4 全部样本的PCA 得分散点图Fig.4 PCA score scatter plot of total samples
OPLS-DA 分析结果显示,滇乌头碱+橄榄油组、滇乌头碱+稀盐酸溶液组与橄榄油组、稀盐酸溶液组样品区分非常显著;OPLS-DA 置换检验结果显示,模型R2Y 值接近于1,Q2的回归线与纵轴的截距小于零,说明所建模型有良好的稳定性,不存在过拟合现象。
差异代谢物筛选结果显示,滇乌头碱+橄榄油组和橄榄油组、滇乌头碱+稀盐酸溶液组和稀盐酸溶液组的代谢物差异明显,且两种不同溶剂滇乌头碱药物组的代谢物也存在差别(图5~6)。

图5 橄榄油组和滇乌头碱+橄榄油组的火山图Fig.5 Volcano plot for olive oil group against Yunaconitine plus olive oil group
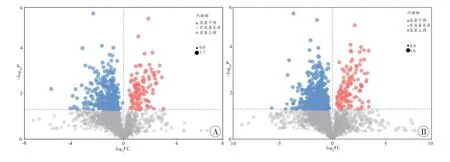
图6 稀盐酸溶液组和滇乌头碱+稀盐酸溶液组的火山图Fig.6 Volcano plot for dilute hydrochloric acid solution group against Yunaconitine plus dilute hydrochloric acid solution
在两组不同溶剂滇乌头碱组与其对应溶剂组对比所得的共同差异代谢物中,最终筛选出16种与滇乌头碱毒性相关的潜在生物学标志物(表1)。16 种代谢物中,甲基丙二酸与尿囊素在滇乌头碱+橄榄油组与橄榄油组对比所得的FC较滇乌头碱+稀盐酸溶液组与稀盐酸溶液组对比的FC低,差异有统计学意义(P<0.05)。
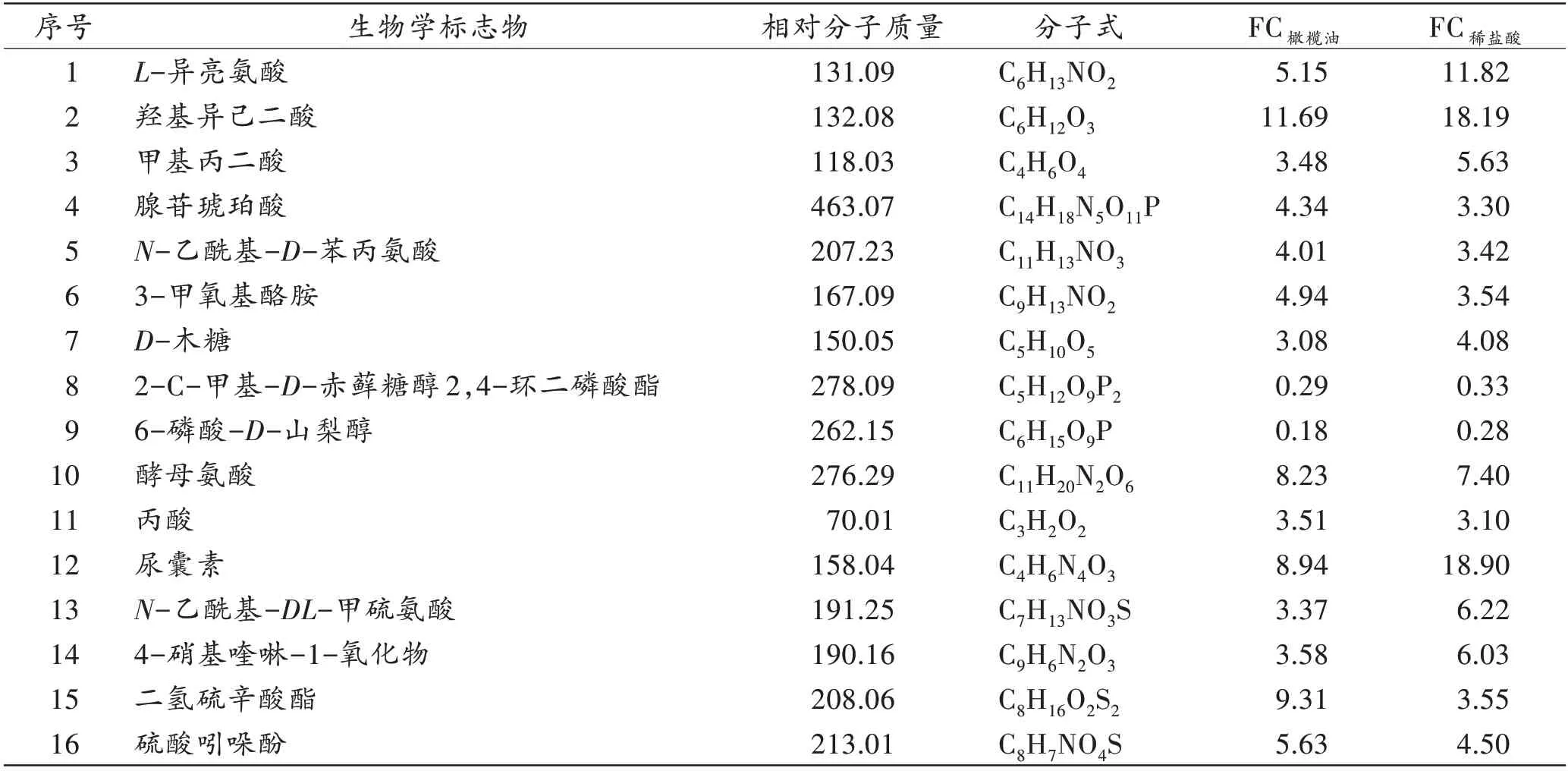
表1 滇乌头碱中毒相关潜在生物学标志物信息Tab.1 Information on potential biomarkers related to intoxication of Yunaconitine
通过差异代谢物筛选出的代谢通路中,有6 条可能与滇乌头碱毒性作用相关的潜在代谢通路(图7):(1)缬氨酸、亮氨酸与异亮氨酸的生物合成;(2)缬氨酸、亮氨酸与异亮氨酸的降解;(3)戊糖和葡萄糖醛酸的相互转化;(4)丙酸代谢;(5)丙氨酸、天冬氨酸和谷氨酸代谢;(6)酪氨酸代谢。

图7 代谢通路分析(气泡图)Fig.7 Metabolic pathway analysis(bubble chart)
3 讨论
本研究采用UPLC-QTOF-MS 技术研究滇乌头碱中毒大鼠尿液中代谢组学谱的特征,结合组织病理学检验所见,探索内源性代谢物与生物体病理生理之间的关系,以此探讨滇乌头碱中毒的可能机制,发现16种与滇乌头碱毒性相关的潜在生物学标志物。异亮氨酸、亮氨酸、缬氨酸是支链氨基酸(branched chain amino acid,BCAA),可由苏氨酸或丙酮酸经若干酶促反应合成,羟基异己二酸、甲基丙二酸是BCAA 的代谢产物,BCAA 可为神经递质的合成提供氮,有研究[11]报道,高浓度的支链氨基酸会诱导大脑皮层神经元的兴奋性毒性,本研究结果与此相符。腺苷琥珀酸可由其前体L-天冬氨酸合成而来,据报道[12],腺苷琥珀酸酶缺乏会导致体内腺苷琥珀酸堆积,并与神经系统疾病有关。N-乙酰基-D-苯丙氨酸是苯丙氨酸的衍生物,苯丙氨酸可由羟化酶生成酪氨酸,进一步生成多巴胺。3-甲氧基酪胺是多巴胺的代谢产物,多巴胺作为一种单胺类神经递质,在脑内主要参与调节运动、精神情绪活动、神经内分泌功能等,其水平异常与帕金森病、双相情感障碍、抑郁症等疾病密切相关[13]。本研究中,滇乌头碱中毒大鼠尿液L-异亮氨酸、羟基异己二酸、甲基丙二酸、腺苷琥珀酸、N-乙酰基-D-苯丙氨酸、3-甲氧基酪胺含量增加,表明滇乌头碱诱导的神经系统毒性,可能与缬氨酸、亮氨酸与异亮氨酸的生物合成与降解,丙氨酸、天冬氨酸、谷氨酸、酪氨酸等氨基酸代谢通路紊乱有关。
D-木糖、2-C-甲基-D-赤藓糖醇2,4-环二磷酸酯、6-磷酸-D-山梨醇均是葡萄糖的代谢产物,可通过磷酸戊糖、糖醛酸以及多元醇等途径生成。磷酸戊糖途径主要为核酸的合成提供磷酸核糖和产生还原型烟酰胺腺嘌呤二核苷酸磷酸,参与多种反应,对维持肝、脂肪组织等生理功能发挥重要作用。糖醛酸途径的主要作用是生成尿苷二磷酸葡萄糖醛酸,参与肝生物转化的结合反应。此外,葡萄糖代谢还可经多元醇途径生成木糖醇、山梨醇等,多元醇对肝、脑等组织具有重要生理作用[14]。大鼠在给药滇乌头碱后,尿液中D-木糖含量增加,2-C-甲基-D-赤藓糖醇2,4-环二磷酸酯、6-磷酸-D-山梨醇含量降低,提示滇乌头碱诱导的肝毒性可能与戊糖和葡萄糖醛酸的相互转化失调、糖代谢异常有关。酵母氨酸是在肝经赖氨酸分解代谢的中间体,是一种线粒体毒素,可通过破坏线粒体的稳态损害发育[15]。常见支链氨基酸代谢障碍会导致丙酸、甲基丙二酸等有机酸的蓄积,导致有机酸血(尿)症,有研究[16]报道丙酸可抑制肝细胞的氧化代谢。大鼠滇乌头碱给药后尿液酵母氨酸、丙酸含量升高,丙酸代谢紊乱,说明滇乌头碱的肝毒性可能与其相关。
人体内尿酸是嘌呤核苷酸分解代谢的终产物,而在大多数哺乳动物体内尿酸可进一步被分解代谢为尿囊素排出体外,有研究[17]报道,外源性尿囊素可通过减轻糖尿病肾病大鼠的氧化应激和炎症,从而发挥对肾的保护作用。本研究中给药滇乌头碱的大鼠尿液中尿囊素含量升高,可能与体内核酸大量分解致嘌呤代谢紊乱有关,推测滇乌头碱可能产生肾毒性。N-乙酰基-DL-甲硫氨酸是甲硫氨酸的衍生物,甲硫氨酸属于含硫必需氨基酸,主要参与体内甲基的转移,有研究[18]表明甲硫氨酸水平与慢性心衰密切相关。本研究中给药滇乌头碱的大鼠尿液中N-乙酰基-DL-甲硫氨酸含量增高,提示滇乌头碱的心脏毒性可能与其有关。
4-硝基喹啉-1-氧化物,是一种诱变剂,可诱导脂质过氧化产生氧化应激而致癌[19]。二氢硫辛酸酯具有抗氧化活性,有研究[20]显示,二氢硫辛酸酯可通过减少体内活性氧的积累而起到保护神经元免受缺血性损伤的作用。硫酸吲哚酚,主要源于结肠微生物对色氨酸分解代谢产生的吲哚,在肝代谢为硫酸吲哚酚,通过肾小管清除随尿排泄,是一种尿毒症毒素,可诱导氧化应激,参与慢性肾疾病、心血管疾病和骨骼疾病的进展[21]。本研究中给药滇乌头碱的大鼠尿液中4-硝基喹啉-1-氧化物、二氢硫辛酸酯、硫酸吲哚酚含量增高,推测滇乌头碱毒性作用可能与氧化应激有关。值得关注的是,本研究筛选出的16 种与滇乌头碱毒性相关的潜在生物学标志物中,甲基丙二酸与尿囊素在滇乌头碱+橄榄油组与橄榄油组对比所得的FC 较滇乌头碱+稀盐酸溶液组与稀盐酸溶液组对比的FC 低,这与肝组织病理学表现相吻合,提示滇乌头碱在橄榄油中以原药存在,而在稀盐酸溶液中以盐的形式存在,后者水溶性强,更容易被生物体吸收和利用,致使其毒性增强。
综上所述,本研究采用UPLC-QTOF-MS 技术研究了不同溶剂(橄榄油和稀盐酸溶液)中的滇乌头碱对大鼠尿液代谢组学谱的影响,结果表明,给药滇乌头碱的大鼠出现了明显的代谢紊乱,代谢轮廓发生偏移,滇乌头碱在不同溶剂中的代谢组学谱存在部分交叉重叠,从中筛选出的16 种与滇乌头碱毒性相关的潜在生物学标志物,结合组织病理学改变,提示滇乌头碱可能扰动氨基酸和糖代谢紊乱,诱发氧化应激引起神经系统、心脏、肝等毒性,其毒性作用机制可能与缬氨酸、亮氨酸与异亮氨酸的生物合成、降解,戊糖和葡萄糖醛酸的相互转化,丙酸代谢,丙氨酸、天冬氨酸、谷氨酸、酪氨酸代谢等代谢通路紊乱有关。但相较于滇乌碱+稀盐酸溶液组,溶解于橄榄油中的滇乌头碱的肝毒性和代谢扰动的趋势相对较小,本研究丰富了黄草乌的毒理学实验数据,对法医学鉴定实践具有指导作用。
