溶瘤病毒的研究现状与临床进展
2022-01-07曾鑫王辰席瑞李运张正平
曾鑫,王辰,席瑞,李运,张正平
(正大天晴药业集团股份有限公司,江苏 南京 211122)
自19世纪以来,病毒疗法治疗癌症一直被研究,但由于基因工程技术壁垒和安全问题,直到最近20年才有巨大进展。目前,病毒用作肿瘤治疗手段的主要方法是基因治疗病毒载体(viral vectors for gene therapy)和溶瘤病毒(oncolytic viruses,OVs)。基因治疗病毒载体和OVs之间的主要区别是基因治疗病毒载体中使用的病毒是非复制病毒,而OVs使用的载体是有复制能力的病毒[1]。
目前,经过基因修饰/改造的溶瘤病毒(genetically modified OVs,GMOVs)在肿瘤治疗领域取得较大进展,成为肿瘤免疫治疗研究的热点方向。OVs是一种野生型病毒[如呼肠孤病毒(reovirus,RV)和新城疫病毒(newcastle disease virus,NDV)等]或工程病毒[如单纯疱疹病毒(herpes simplex virus,HSV)、腺病毒(adenovirus,AdV)、牛痘病毒(vaccinia virus,VV)和水疱性口炎病毒等],可以选择性地感染肿瘤细胞并在其中复制,从而直接杀死被感染的细胞。此外,OVs可诱导肿瘤细胞对病毒表位的免疫应答,进而实现全身抗肿瘤免疫反应[2]。因此,OVs治疗也被认为是一种癌症免疫治疗。与传统的免疫治疗相比,OVs疗法具有复制高效、肿瘤靶向性好、肿瘤杀伤途径多、不良反应小、不易产生耐药性等优势[3]。
1 溶瘤病毒药物载体及特征
从非基因编辑型到基因编辑型,OVs包含众多种类及特征。根据病毒基因组核苷酸类型的不同,OVs载体可分为DNA病毒载体和RNA病毒载体。其中,DNA病毒主要以HSV、AdV、VV和细小病毒H1(parvovirus H1)为主;RNA病毒主要以RV、柯萨奇病毒(coxsackie virus,CV)、脊髓灰质炎病毒(poliovirus,PV)、麻疹病毒(measles virus,MV)、NDV及水泡性口炎病毒(vesicular stomatitis virus,VSV)为主[2,4]。
目前,全球共有4款OVs产品获批上市(见表1),国内也有多款产品获国家药品监督管理局(national medical products administration,NMPA)批准进入临床阶段(见表2)。据临床试验统计,全球在开发的OVs药物所属病毒载体主要是以下4种:AdV(n= 30,30.9%)、HSV(n= 23,23.7%)、RV(n= 19,19.6%)和VV(n= 12,12.4%)[5]。

表1 已上市的溶瘤病毒药物Table 1 Approved oncolytic viruses on the market
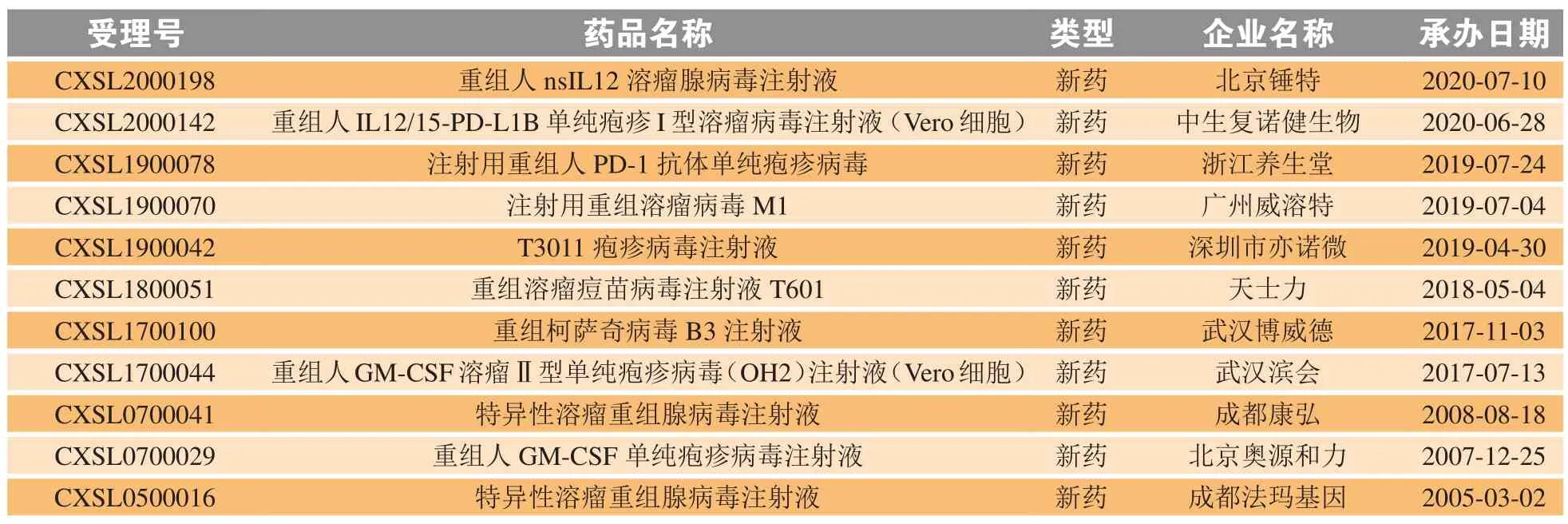
表2 NMPA登记的溶瘤病毒药物项目Table 2 Oncolytic virus projects registered in NMPA
1.1 腺病毒
AdV是一种无包膜的双链DNA病毒,进入细胞后在细胞核中表达病毒复制所必需的基因E1A和E1B。E1A和E1B能调节视网膜母细胞瘤相关蛋白(retinoblastoma-associated protein,pRb)和p53信号转导通路,促进宿主细胞的分裂和增殖,从而实现在细胞内大量复制。因此,缺失E1A和E1B基因可构建特异性感染pRb/p53突变型肿瘤的OVs[6]。
1.2 单纯疱疹病毒
HSV是一种有包膜的嗜神经性双链DNA病毒,具有HSV-1和HSV-2这2种血清型,是研究最广泛的DNA病毒之一。HSV有很大的基因组(约150 kb),其中部分基因对病毒复制不是必需的,这为在不限制病毒的包装效率的前提下插入外源功能性基因提供了足够的空间,使其成为OVs治疗领域的一个极具吸引力的候选载体[7]。
1.3 牛痘病毒
VV是一种有包膜的双链DNA病毒,基因组长约190 kb,可携带较大外源基因片段,倾向于感染代谢旺盛的细胞。目前,VV主要通过缺失胸苷激酶(thymidine kinase,TK)、牛痘生长因子(vaccinia growth factor,VGF)、Ⅰ型干扰素结合蛋白(B18R)等增强肿瘤选择性[8]。
1.4 呼肠孤病毒
RV是一种无包膜的双链RNA病毒,天然存在于哺乳动物呼吸系统和肠道系统中,无明显致病性,但对大鼠肉瘤病毒同源癌基因(rat sarcoma viral oncogene homologue,RAS)通路激活的细胞具有靶向裂解作用。由于80%以上恶性胶质瘤RAS信号通路异常,恶性胶质瘤常作为RV治疗的理想适应证[9]。
2 溶瘤病毒的抗肿瘤机制
OVs作为癌症治疗药物,其抗肿瘤作用不仅表现为病毒在肿瘤细胞中的选择性感染和复制、裂解肿瘤细胞,而且还体现在其可通过多种途径激发全身抗肿瘤免疫反应,如促进抗原提呈、调节肿瘤微环境(tumor microenvironment,TME)、活化免疫细胞、通过携带的免疫调节因子等激活机体免疫系统等。总的来说,OVs主要通过下述4种机制发挥抗肿瘤作用。
2.1 直接裂解肿瘤细胞
由于恶性肿瘤细胞的抗病毒应答存在缺陷,OVs在肿瘤细胞中可以特异性感染和复制,导致肿瘤细胞直接被裂解[2]。
2.2 诱导不同类型免疫原性细胞死亡
除了直接溶解肿瘤细胞外,OVs可以通过诱导内质网应激反应产生不同类型的免疫原性细胞死亡(immunogenic cell death,ICD),包括坏死、坏死性凋亡、免疫性凋亡、细胞焦亡和自噬等[10]。肿瘤细胞的死亡或裂解导致肿瘤相关抗原(tumorassociated antigens,TAAs)、新抗原(neoantigens,TANs)和损伤相关分子模式(damage-associated molecular patterns,DAMPs)的释放,进而招募更多的树突状细胞(dendritic cells,DCs)等免疫细胞到达肿瘤组织,激活抗肿瘤免疫应答,起到“原位疫苗”的作用。同时,OVs利用“原位疫苗”效应促使远端转移灶消退,产生“远端效应”[11-12]。
2.3 破坏肿瘤血管系统
研究表明,一些OVs(如HSV、VV、VSV)可以靶向肿瘤相关成纤维细胞(tumor-associated fibroblasts,TAFs)、 血 管 内 皮 细 胞(vascular endothelial cells,vECs)和周细胞(pericytes)等肿瘤间质细胞,从而破坏肿瘤的复杂结构,导致肿瘤坏死,促进免疫细胞浸润到TME[13]。肿瘤的生长依赖于肿瘤血管系统提供营养物质,破坏肿瘤血管系统能够有效地抑制肿瘤的生长。肿瘤vECs分泌的血管内皮生长因子(vascular endothelial growth factor,VEGF)可以抑制抗病毒反应,使得OVs通过细胞外信号调节蛋白激酶1/2(extracellular regulated protein kinase1/2,ERK1/2)和信号转导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)信号通路在肿瘤vECs中复制。OVs在肿瘤vECs中感染和复制之后,会减少被感染细胞产生的VEGF,从而抑制肿瘤中的血管生成。OVs的抗血管生成特性又通过减少氧气和营养供应进一步限制了肿瘤的生长[14-15]。
2.4 调节肿瘤微环境
免疫治疗在肿瘤(尤其是实体瘤)中的长期效果大多不理想,部分原因是TME的免疫抑制和免疫细胞浸润较低。TME是由肿瘤细胞、TAFs、vECs、间充质细胞、髓源性抑制细胞(myeloidderived suppressor cells,MDSCs)和肿瘤浸润性白细胞(tumor-infiltrating leukocytes,TILs)[如T细胞、B细胞、DC细胞、自然杀伤细胞(natural killer,NK)、巨噬细胞和中性粒细胞等]组成[16]。TME的免疫抑制通常是由于细胞毒性T淋巴细胞(cytotoxic T lymphocytes,CTLs)、辅助 T细胞(helper T-cells,Ths)和NK细胞被耗竭以及免疫抑制细胞因子[如白细胞介素10(interleukin 10,IL-10)、IL-27、IL-35和转化生长因子-β(transforming growth factor-β,TGF-β)等]的过度分泌导致。OVs特别是GMOVs可以通过诱导抗病毒反应、炎症反应、细胞因子(如GM-CSF等)的产生和共刺激分子[如肿瘤坏死因子相关激活蛋白(TNF associated activation protein,TRAP)]的表达,从而增强肿瘤抗原呈递以及TME中的免疫反应,使TME产生免疫原性,打破免疫耐受,将“冷”肿瘤转化为“热”肿瘤,实现从多维度杀伤肿瘤细胞[11,17]。
3 溶瘤病毒的改造
目前,应用于临床试验的OVs除具有天然特异感染肿瘤的野生型病毒株(如NDV、CV、RV等)外,大部分均进行了基因改造。为了获得更好的抗肿瘤效果,基因改造主要通过提高OVs对肿瘤细胞的靶向性和增强机体免疫应答两方面进行。
3.1 增强对肿瘤细胞的靶向性
1)缺失病毒在正常细胞中复制的必需基因,但不影响其在肿瘤细胞中的复制。如T-VEC(talimogene laherparepvec,Imlygic)是一种 HSV-1型病毒,其基因组中有2个缺失:RL-1[表达神经毒性因子ICP34.5,可以抑制宿主通过双链RNA激活的蛋白激酶(PKR)-干扰素(IFN)通路的抗病毒免疫反应]和α47(表达早期蛋白ICP47,抑制抗原递呈)。ICP34.5表达缺失可阻止病毒在正常细胞中的复制,而不影响其在肿瘤细胞中的复制。2015年10月,FDA首次批准OVs药物T-VEC在美国上市,用于晚期黑色素瘤的治疗。2016年T-VEC又分别在欧洲和加拿大获批上市,标志OVs技术的成熟和对OVs治疗癌症的正式认可。2)缺失病毒复制的关键基因,使病毒仅在部分肿瘤细胞内复制,在正常细胞内少量存在或不能增殖。如Pexa-Vec(JX-594),是一种GM-CSF增强的VV,通过TK基因缺失来增加肿瘤选择性。Pexa-Vec已在结肠直肠癌、肝细胞癌(HCC)、肾细胞癌患者的多项Ⅰ期和Ⅱ期临床试验中进行了评估[18]。3)在病毒复制必需基因上游插入肿瘤或组织特异性启动子,使病毒只在肿瘤或特异组织中复制,如人端粒酶逆转录酶(hTERT)启动子、癌胚抗原(CEA)启动子等[19-20]。
3.2 增强机体的免疫应答
3.2.1 表达免疫刺激细胞因子如OVs在局部表达并释放GM-CSF,可以促进DC细胞、巨噬细胞等的成熟、迁移,并增强T细胞的免疫应答。除GMCSF外,其他常用的细胞因子有IL-2、IL-12、IL-15等[21]。
3.2.2 表达趋化因子趋化因子是细胞因子中最大的亚家族,介导免疫细胞迁移和淋巴组织发育。目前,在研的趋化因子包括CCL5(可以增加病毒在肿瘤局部的存续时间)、CCL19(控制肿瘤生长,增加DC、CD4+T细胞迁移至TME)、CCL20和CCL21等[22]。
3.2.3 表达肿瘤抗原将肿瘤相关抗原(tumorassociated antigens,TAAs)基因整合在病毒基因组后,OVs在肿瘤局部裂解肿瘤并释放TAAs,增强特异性的T细胞免疫应答。如使用MG1 Maraba溶瘤病毒可表达黑色素瘤抗原-A3(melanoma antigen family A3,MAGE-A3),治疗恶性实体瘤[23]。
3.2.4 表达免疫激活配体如表达簇分化抗原40配体(cluster of differentiation 40 ligand,CD40L)OVs的研究结果表明,其可以抑制肿瘤生长,上调TME中效应T细胞比例[24]。表达肿瘤坏死因子配体超家族成员 4(tumor necrosis factor superfamily member 4,TNFSF4)的OVs可促进效应T细胞和记忆T细胞的存活,使它们保持稳态,同时控制并调节T细胞的分化和功能表达[25]。
3.2.5 表达双特异性T细胞连接器双特异性T细胞连接器(BiTE)的一个单链可变片段(single chain variable fragment,scFv)臂与T细胞表面的CD3或其他T细胞激活受体特异性结合,另一个scFv臂可与肿瘤细胞表面的目标抗原结合。双臂与相应的靶抗原结合刺激T细胞活化,导致靶肿瘤细胞凋亡。由于BiTE分子在血清中半衰期短,对肿瘤的渗透有限,并表现出剂量限制毒性,因此研究者开发了编码表达BiTE的OVs[26]。首个装载BiTE的OVs是一种靶向肿瘤表面抗原ephrin A2的溶瘤痘苗病毒EphA2-TEA-VV。研究发现,EphA2-TEA-VV与人外周血单核细胞(peripheral blood mononuclear cells,PBMCs)联合使用对小鼠肺癌移植瘤具有显著的抑制作用[27]。目前,已有多个基于此类策略改造的OVs处于临床前以及临床研究阶段,如ICOVIR-15K-cBiTE(靶向CD3/EGFR)、NG-641(靶向 CD3/FAP)等[28-29]。
4 国内外溶瘤病毒临床研究现状
目前,OVs药物治疗的肿瘤范围以实体瘤为主,包括黑色素瘤、肝细胞癌、结肠癌、乳腺癌、脑胶质瘤、多发性骨髓瘤、头颈癌及恶性胸膜间皮瘤等[5]。
虽然OVs可为不同类型、不同进展阶段的肿瘤患者带来临床获益,但OVs作为单一疗法对实体瘤的治疗仍然存在挑战。为了克服OVs单药治疗的局限性,研究人员尝试了以OVs为基础的联合治疗,包括与放疗、化疗、免疫检查点抑制剂(immune checkpoint inhibitor,ICI)、嵌合抗原受体(chimeric antigen receptor,CAR)-T细胞治疗等联合,协同增效显著[30-31]。
4.1 溶瘤病毒与放疗的联合治疗
OVs与放疗在机制上相辅相成,具有协同作用。一方面,放疗造成DNA损伤,一些OVs可以隔离DNA损伤反应蛋白,抑制DNA修复机制,实质上充当了放疗敏化剂。另一方面,放疗诱导肿瘤细胞凋亡,释放TAAs和DAMPs,促进了OVs的复制和扩散[32]。在一项溶瘤HSV病毒G207联合放疗治疗复发性恶性胶质瘤的I期试验中,9例接受联合治疗的患者中有6例显示出协同活性[33]。
4.2 溶瘤病毒与化疗药物的联合治疗
同放疗相似,化疗也通过多种机制提升OVs治疗的临床获益,如抑制抗病毒免疫应答、释放TAAs、提高肿瘤细胞免疫原性和直接杀死肿瘤细胞并释放病毒粒子等[34]。
在一项治疗复发性头颈癌的Ⅱ期试验中,一种改良的溶瘤腺病毒ONYX-015、顺铂和5-氟尿嘧啶(5-FU)联合治疗增强了抗肿瘤效果;在接受联合治疗(OVs+顺铂+5-FU)的患者中,联合治疗的有效率为63%,而在接受单独ONYX-015治疗的患者中,有效率仅为15%[35]。
4.3 溶瘤病毒与免疫检查点抑制剂的联合治疗
ICI通过靶向检查点受体或配体,如程序性细胞死亡受体1(PD-1)、程序性细胞死亡配体1(PD-L1)或细胞毒T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4,又名CD152)等,阻断肿瘤免疫抑制信号,从而恢复机体抗肿瘤免疫应答。目前,已有多种ICIs获美国FDA批准,包括CTLA-4抑制剂(ipilimumab)、PD-1抑制剂(nivolumab、pembrolizumab、cemiplimab)和PD-L1抑制剂(avelumab、durvalumab和atezolizumab)等。由于OVs能通过对TME的调控将“冷”肿瘤变为“热”肿瘤,提高ICIs的抗肿瘤活性,研究OVs和ICIs联合使用的临床试验数量近年持续增加,表明ICIs与OVs联合使用可协同增强免疫应答,具有很好的治疗潜力[36-37]。
一项治疗晚期不可切除黑色素瘤的随机、开放标签的Ⅱ期临床试验(NCT01740297)结果显示:溶瘤病毒T-VEC联合CTLA-4抗体ipilimumab组患者的客观缓解率(objective response rate,ORR)为39%(38/98),而ipilimumab单药组患者的ORR仅为18%(8/100);其中,联合组中有13例患者完全缓解(complete response,CR),单药组中有7例患者CR[38]。2017年,一项多中心的Ⅰb期临床试验评估了PD-1抗体Keytruda与溶瘤病毒T-VEC联合用药的安全性和有效性,结果表明,联合治疗组患者的ORR高达62%,其中33%为CR,比单独使用Keytruda或T-VEC治疗的预期缓解率(通常约为35% ~ 40%)要高得多[39]。在不久的将来,相信随着越来越多的OVs和ICIs进入临床开发阶段,这一策略将为癌症治疗带来更多曙光。
4.4 溶瘤病毒与CAR-T细胞疗法的联合治疗
CAR-T细胞治疗通过基因修饰T细胞来表达CAR,使得CAR-T细胞能够识别、杀死具有相应特异性抗原的肿瘤细胞。CAR-T细胞治疗结合基因修饰的OVs可以显著诱导CAR-T细胞穿透TME,提高CAR-T细胞在实体肿瘤中的治疗效果[40]。一项研究溶瘤腺病毒Ad-mTNFα-mIL2 [表达肿瘤坏死因子 -α(tumor necrosis factor-α,TNF-α)和 IL-12]与定向间皮素的CAR-T联合治疗的临床前研究显示,联合疗法使人胰腺导管腺癌异种免疫缺陷小鼠的肿瘤显著消退[41]。
5 面临的挑战
OVs是肿瘤治疗的新分支,已引起业界的广泛关注,尽管其对癌症的治疗有很大的潜力,但目前在临床应用以及产业化中均存在一些挑战。为了提高OVs的有效性、安全性和递送效率,研究人员主要提出4个方面的解决策略:克服基质壁垒、增强给药有效性、限制抗病毒免疫反应、选择合适的受试者[42-43]。
TME内的物理屏障细胞外基质(extracellular matrix,ECM)是能够干预和影响OVs发挥其治疗潜力的主要障碍之一。ECM主要由胶原蛋白、弹性蛋白和蛋白聚糖等组成,可阻碍抗癌药物在实体肿瘤中的分布。表达ECM降解酶的OVs,如编码松弛素(relaxin)和核心蛋白聚糖(decorin)的溶瘤腺病毒已被证实可以选择性地降解ECM,增强病毒在肿瘤中的扩散,诱导肿瘤细胞凋亡,产生显著的抗肿瘤作用[44]。此外,为了适应机制壁垒的压力以及TME的酸性和缺氧,OVs还被设计为表达高融合性包膜糖蛋白,诱导合胞体形成,从而通过细胞间融合促进病毒扩散。一些临床前研究已经证实,表达长臂猿白血病病毒致融性外膜糖蛋白(GALV.fus)的OVs可促进肺腺癌细胞间的直接融合,进而提高病毒的扩散能力[45]。
OVs治疗的另一个巨大挑战是如何有效地将OVs送入肿瘤细胞。目前,临床试验中最有效和最安全的OVs给药途径是瘤内注射,多用于体表肿瘤或部位局限肿瘤。为了有效地将OVs注射到靶标,识别肿瘤至关重要。因此,开发基于肿瘤形态学和肿瘤分子标志物的图像导向的递送方法成为了一种共识方案。虽然瘤内注射OVs不会使OVs迁移到转移灶肿瘤,但瘤内注射OVs能激活宿主抗肿瘤免疫反应,导致转移灶肿瘤也被控制(“远端效应”)。临床试验表明,T-VEC可通过“远端效应”使黑色素瘤患者非注射部位肿瘤体积缩小[46]。然而,由于“远端效应”效力有限,不足以治愈转移性肿瘤,在治疗转移性肿瘤或血液肿瘤中系统性给药(如静脉注射)更具临床应用前景和商业价值。然而,在一些病例中,曾接种过疫苗或血清阳性者采用系统性给药的治疗效果并不理想[47]。
为了限制系统性给药的抗病毒免疫反应,研究者尝试了各种方法。如OVs与环磷酰胺联合使用可抑制或延迟机体抗病毒反应。用阳离子脂质体将病毒包裹在脂质双分子层中,可以保护病毒不被初始识别和凝集,极大地扩大了病毒的自然宿主范围。除了脂质体外,还可以通过包覆纳米粒和涂覆聚合物[如聚乙二醇(PEG)、聚甲基丙烯酸羟丙酯(PHPMA)]来实现病毒的保护[48]。近年来,基于细胞的递送载体成为最具潜力的OVs递送载体之一。将OVs隐藏入细胞载体中,可以规避宿主免疫系统对OVs的识别。间充质细胞和神经干细胞已被证实具有肿瘤归巢特性,已被用于递送OVs到肿瘤。目前,细胞递送载体已被成功应用于NDV、AdV、HSV-1、MV和VSV的递送[49]。
选择合适的患者是OVs临床治疗的又一个挑战。通常,接受OVs试验的患者前期通常经过了多个常规治疗,这可能导致免疫系统受损。因此,通过特定的预测性生物标志物选择合适的患者,监测接受积极治疗的患者的免疫反应,确定哪些患者可通过治疗临床获益,有助于最大限度地提高治疗效果。例如,IFN信号通路和干扰素刺激基因(interferon stimulated genes,ISGs)是肿瘤耐OVs治疗的关键调控因子,这使得它们成为IFN诱导耐药的潜在预测生物标志物[50]。研究显示,对于高表达IFN和ISGs的肿瘤,OVs和IFN抑制剂联合可提高治疗效果[51]。
目前,肿瘤免疫疗法已成为抗肿瘤药物市场的中坚力量。OVs使“冷”肿瘤变“热”肿瘤的特性,使其成为了肿瘤免疫组合治疗的重要组成部分。随着OVs产品研究的不断深入、治疗方案的不断完善,OVs疗法的临床安全性和有效性提升,未来OVs疗法必将会为更多的肿瘤患者带来希望。
