减数分裂联会复合体异常与不孕不育相关性研究进展
2022-01-06聂辉张译文李佳宁王楠楠徐澜
聂辉,张译文,李佳宁,王楠楠,徐澜
减数分裂联会复合体异常与不孕不育相关性研究进展
聂辉,张译文,李佳宁,王楠楠,徐澜
山东师范大学生命科学学院,济南 250014
减数分裂是由二倍体的生殖细胞产生单倍体的配子的过程,是有性生殖的核心。联会复合体是同源染色体之间形成的超分子结构,具有稳定同源染色体配对、促进遗传交叉形成等功能。越来越多的研究表明联会复合体异常是造成人类不孕不育的重要原因之一。本文主要综述了联会复合体中央区域异常(如SYCE1/2/3、TEX12、SIX6OS1、SYCP1突变)及侧向元件缺陷(如SYCP2、SYCP3突变)与不孕不育的相关性研究,以期为深入理解减数分裂错误导致生殖健康问题的病理机制提供理论参考。
减数分裂;联会复合体;不孕不育
不孕不育(infertility)是临床常见的生殖问题,影响着全球约8%~12%的育龄夫妇,其中男性不育与女性不孕所占比例大致相当[1]。尽管不孕不育的病因复杂多样,包括感染、代谢性疾病、激素失衡等,但遗传因素在其中所起的作用越来越清晰[2,3]。
减数分裂是包括人类在内的真核生物有性生殖过程中配子形成的必经阶段,其异常与人类不孕不育密切相关[2,4,5]。联会复合体(synaptonemal complex, SC)是减数第一次分裂前期配对的同源染色体之间形成的梯状蛋白结构,其正确组装对于减数分裂的顺利进行至关重要[6]。研究表明,SC在稳定同源染色体配对以及促进遗传交叉(crossover, CO)形成方面发挥着重要的作用,而SC异常往往可造成减数分裂进程出错或停滞,是不孕不育等生殖健康问题产生的重要原因之一[5,7]。本文总结了SC异常与不孕不育相关性的近期研究进展,为深入了解人类生殖健康问题的病理机制提供参考和借鉴。
1 减数分裂与SC
减数分裂是真核生物有性生殖必需的一种细胞分裂方式,由二倍体的生殖细胞产生单倍体的配子(精子或卵子)。在减数分裂过程中,DNA复制一次而细胞连续分裂两次,包括减数第一次分裂和减数第二次分裂,其中减数第一次分裂主要进行同源染色体的分离,细胞中的染色体数目减半,减数第二次分裂类似于有丝分裂,姐妹染色单体彼此分开,最终得到单倍体的配子[8,9]。
减数第一次分裂前期具体可分为细线期、偶线期、粗线期、双线期和终变期五个时期,减数分裂一系列的关键事件,包括同源染色体配对、联会、同源重组、染色体重塑等均发生于该阶段,上述环节若出现错误常常造成减数分裂出错甚至停滞,配子发生受到影响,进一步引发人类不孕不育、自发性流产、出生缺陷(如唐氏综合征)等生殖健康问题[10,11]。因此,对减数分裂的进程和调控机制进行深入的研究,对于促进人类生殖健康、降低出生缺陷等具有重要意义。
SC是减数分裂前期配对的同源染色体之间形成的一种复杂的梯状超分子复合物,是减数分裂前期的一个标志性特征。在细线期,减数分裂染色体轴进行组装;偶线期阶段,同源染色体配对排列,SC中央区域(central region, CR)开始在配对的同源染色体之间组装;进入粗线期,SC延伸至同源染色体全长(性染色体非同源染色体臂除外)。染色体片段的交换通过同源重组发生。SC于粗线期结束或双线期阶段解离[12]。
SC的整体结构在酵母()、线虫()、果蝇()和小鼠()等物种中高度保守,其宽度也较为相似,均为100 nm左右[13,14]。粗线期完整的SC由三部分组成:位于中间的中央区域和两侧的侧向元件(lateral element, LE),而前者又可细分为中心元件(central element, CE)和横向纤丝(transverse filaments, TFs)两个亚组分(图1)。
SC的组成蛋白在多个模式生物中被逐渐发现和鉴定。随着研究技术和方法的不断进步和成熟,一些新的SC组分不断被报道,例如近来在秀丽隐杆线虫中发现了SC的两个新组分:SYP-5和SYP-6[15,16]。超高分辨率显微镜分析结果表明,SYP-5和SYP-6均定位于SC中央区域;SYP-6只在减数分裂早期的前期表达,于粗线期晚期表达消失,而SYP-5的表达则贯穿于减数分裂前期,直至终变期结束。进一步研究发现,SYP-5与SYP-6可分别与细胞中的其他SYPs蛋白互作形成不同的SC组装单元,组装单元之间的多价互作驱动了SC的形成和联会进程[16]。
SC在减数分裂过程中的重要性越来越引起人们的关注。研究表明,SC对于稳定同源配对相互作用和促进CO形成是必需的,进而有利于后续同源染色体的精确分离;其组分倘若出现异常则可能导致严重的减数分裂错误,最终引起不孕不育等生殖缺陷[9,12,17]。
2 SC异常与不孕不育
如前所述,SC是减数第一次分裂前期非常重要的蛋白复合物,其组分异常与不孕不育高度相关。SC的组分主要分为CR组分和两侧的LE组分,在哺乳动物中,CR组分主要包括SYCE1/2/3、TEX12、SIX6OS1、SYCP1,LE组分主要包括SYCP2、SYCP3 (表1)。下面分别阐述各组分与不孕不育的相关性。
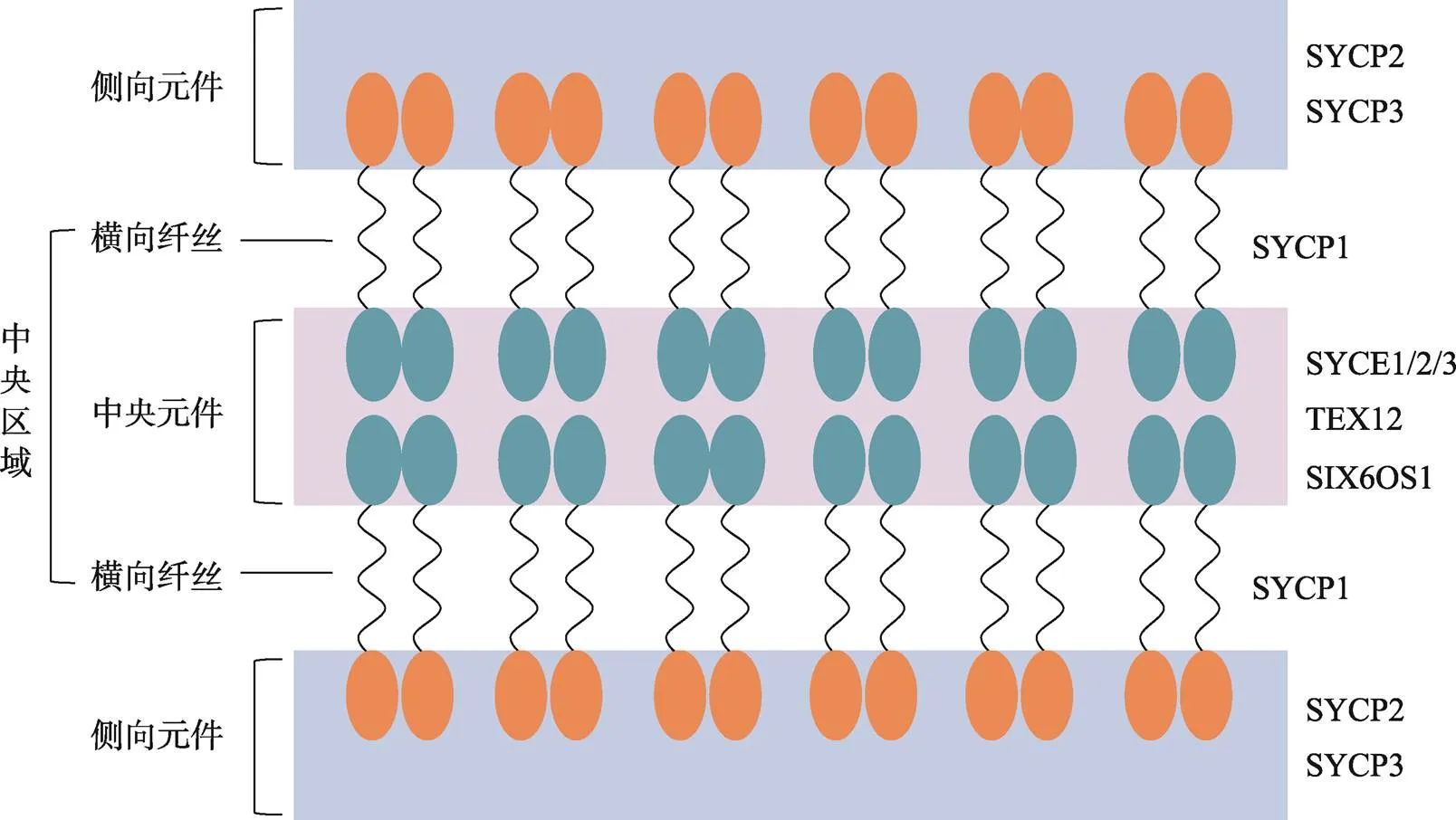
图1 小鼠联会复合体结构示意图

表1 SC组分缺陷与不孕不育的相关性
2.1 CR组分缺陷
哺乳动物SC的CR组分又可细分为CE蛋白和TFs蛋白两类,其中CE蛋白主要包括SYCE1/2/3、TEX12、SIX6OS1;TFs蛋白由SYCP1组成。5种CE蛋白为SYCP1提供了必要的结构支持,使其能够沿着整个染色体长度连续延伸。
已有多项研究表明SYCE1蛋白与不育的相关性。Bolcun-Filas等[18]发现SYCE1对小鼠的育性是必须的。在SYCE1缺失的小鼠的生殖细胞中,尽管LE正常组装,但LE之间的SYCP1显著减少且不连续,双链断裂(double-strand breaks,DSBs)修复异常,减数分裂停滞,最终造成小鼠不育。对人类而言,已在非梗阻性无精子症(nonobstructive azoospermia, NOA)家族病例[19,20]和原发性卵巢功能不全(primary ovarian insufficiency, POI)家族病例[21,22]中发现相关突变。已报道的2例NOA病例中突变均为剪接位点突变(c.197-2A>G、c.375-2A> G),c.197-2A>G导致产生氨基酸1-65的截短产物,c.375-2A>G导致氨基酸126-155的缺失[19,20]。POI相关的突变c.613 C>T是通过对一对患有POI的姐妹的DNA样本进行全外显子组测序分析发现的。该突变导致出现未成熟的终止密码子(p.Gln241*),进而产生氨基酸1~240的截短产物[21]。另外,Zhe等[22]通过对两名来自中国汉族家庭的、确诊为POI的姐妹及其父母的基因突变的研究发现了一个纯合缺失突变与POI相关。
近来有研究对上述报道的突变造成不育的分子机制进行了探索,结果表明,SYCE1与SIX6OS1之间存在多重相互作用,这一相互作用对于SC组装是必需的,而上述突变破坏了这种相互作用。SIX6OS1 N末端结合并打破SYCE1的核心二聚体结构(25~179位氨基酸)从而形成1∶1复合体作为一个互作界面;SIX6OS1的下游序列结合SYCE1的177~305位氨基酸作为第二个互作界面。突变c.375-2A>G (NOA)与c.613-2A>G (POI)分别破坏了第一个和第二个互作界面,造成SC无法正常组装,进而引发减数分裂失调,造成生育问题[23]。
SYCE2早先被命名为CESC1[24],是小鼠等哺乳动物SC中心元件的另一组分。研究表明缺乏SYCE2蛋白的雄性小鼠和雌性小鼠均不育;细胞学分析显示,SYCE2敲除小鼠可以产生DSBs,同源染色体正常排列,并启动重组过程,但不能完成SC的完整组装,重组进程在RAD51/DMC1移除、MSH4装载于AE后停滞,最终导致雄性和雌性小鼠均无法产生配子[25]。
SYCE3蛋白在不同物种中具有高度保守性。针对SYCE3敲除小鼠的研究结果表明,SYCE3对于雄性小鼠和雌性小鼠的可育性是必需的[26]。进一步研究表明,SYCE3缺失可阻断联会起始,造成减数分裂停滞。
TEX12是生殖细胞中特异表达的蛋白,在人类和小鼠的体细胞中几乎检测不到。TEX12是雄性和雌性生殖细胞中同源染色体联会所必需的[27],研究发现NOA患者相对于对照组,其睾丸组织中TEX12表达显著降低[28]。
SIX6OS1蛋白与不育的相关性也已有报道。研究表明,缺乏SIX6OS1的雄性小鼠和雌性小鼠均是不育的,细胞学分析表明,缺乏SIX6OS1的精母细胞和卵母细胞均无法完成联会过程,停滞于粗线期阶段[29]。Fan等[30]报道在某些NOA和POI患者中通过对其DNA样本进行全外显子组测序发现了3种纯合突变,包括移码突变(c.204_205del [p.His68Glnfs*2])、无义突变(c.958G>T[p.Glu320*])和剪接突变(c.1180-3C>G),这些突变导致产生的截短体蛋白虽能够与SYCE1的结合,但两者之间无法形成正常的多聚复合物。细胞学分析显示,携带移码突变的患者的生殖细胞中同源染色体完全不联会,而携带无义突变和剪接突变的患者的生殖细胞呈现不完全联会。
SYCP1是哺乳动物TFs的组成蛋白。Dunce等[31]通过X射线晶体学和生物物理学的一系列研究揭示了人SYCP1的结构和自我组装机制。SYCP1具有四聚体结构,其中N末端四螺旋束分叉成两个细长的C末端二聚体卷曲螺旋。这一结构单元通过两个自组装位点组装成拉链状的格子。N末端位点在中央区域进行头-头联合组装,而C末端位点在染色体轴上背对背相互作用。研究表明,缺乏SYCP1的小鼠不育;对SYCP1缺失的精母细胞进行细胞学分析表明,其可以形成正常的AE,但同源染色体不联会,其中大部分停滞在粗线期,只有小部分到达双线期或中期;几乎无法形成遗传交叉,不形成XY小体[32]。
2.2 LE组分缺陷
SYCP2和SYCP3均为哺乳动物SC的侧向元件蛋白,SYCP2敲除小鼠和SYCP3敲除小鼠在生育力上均展现出性别差异性,即雄性为不育,而雌性只是生育力低下。细胞学分析显示,或突变的精母细胞均无法形成侧向元件,染色体联会失败[33,34]。而SYCP2或SYCP3缺失的卵母细胞的表型没有如此严重,其同源染色体呈现部分联会,因而雌性缺失突变体小鼠能够怀孕和分娩,尽管与野生型相比后代数量显著降低。例如SYCP2缺失的雌性小鼠的后代数量减少了大约一半[33];SYCP3缺失的雌性突变体小鼠的后代中约有1/3因非整倍体而在子宫内死亡[34]。两性生育力存在差异性可能是由于监控联会和重组的粗线期检验点的严格程度不同而造成的,雄性中这一检验点相对于雌性可能更为严格[35,36]。
对人类而言,突变与不孕不育的相关性报道较为匮乏。最近, Schilit等[37]通过对隐匿精子症和无精子症男性患者的基因进行外显子组测序发现了3个杂合的移码突变(c.2022_2025del、c.2793_2797del、c.3067_3071del),从而揭示了SYCP2与人类男性不育的关联性。
目前已有多项研究揭示患有生殖缺陷的病患携带突变。Miyamoto等[38]在2例NOA患者中发现了一个1bp缺失突变(643delA),该突变导致终止密码子过早出现,产生截短体突变蛋白。体外实验表明,SYCP3截短体突变蛋白与野生型蛋白的相互作用显著减少,进而干扰了SYCP3纤丝的形成。Bolor等[39]在26例患有不明原因反复流产(recurrent pregnancy loss, PRL)的日本女性中发现有2例携带突变,一位女性携带c.IVS7-16_19delACTT突变,另一位女性携带T657C突变,这些突变在150位可育女性中均未发现。Sazegari等[40]在另一项针对100名不明原因RPL的伊朗女性和100名至少有一个健康孩子的正常生育女性的调查中也发现了T657C突变。
然而在另一项于日本开展的T657C基因突变检测研究中并没有发现该突变与RPL具有临床相关性[41]。该研究对101例有3次或3次以上不明原因RPL史的患者和82例无流产史的可育对照者进行T657C基因突变检测,结果表明只有1例有6次RPL史的患者和1例对照组的可育女性携带该突变,因而无法明确T657C基因突变与RPL的相关性。这一争议可能需要更多的相关研究和深入的机制探索予以确认。
3 结语与展望
生殖健康是全民健康的重要组成部分,然而目前不孕不育等生殖疾病正困扰着越来越多的育龄夫妇。减数分裂作为有性生殖的核心,包括了一系列复杂有序的进程,其中SC的组装、维持和解聚是该过程中非常关键的环节。越来越多的研究表明,SC组分出现异常可造成减数分裂过程出错甚至停滞,导致非整倍体或不孕不育等生殖缺陷(表1)。
SC是一复杂的超分子蛋白复合体,其组装、解聚以及动态性的维持受到细胞严格而精密的调控,该调控过程出错或相关调控蛋白缺陷与不孕不育的相关性近些年来引起人们的注意,但相关报道目前较少。Liu等[42]在小鼠生殖细胞中发现新蛋白SCRE (SC增强元件),该蛋白是小鼠生殖细胞减数第一次分裂前期维持SC完整性的关键分子。敲除可引起雄性小鼠和雌性小鼠的生殖细胞中SC提前解聚,减数分裂停滞,最终造成不育。围绕SC调控与不孕不育相关性的研究尚不多,但随着人们对于SC的了解的不断深入,未来将有更多参与SC组装、维持与解聚调控过程的蛋白或分子被发现,从而更全面地揭示其与不孕不育等生殖健康问题的关联及机制。
随着技术的不断进步以及研究的愈发深入,SC的组成和结构以及相关调控途径正越来越清晰的展现在人们面前,其与不孕不育的关联性也在不断补充和完善。这些探索和分析如何为临床不育提供解决方案?针对SC的组分蛋白或调控分子进行药物靶点的筛选和挖掘未来是否成为可能?相信这些问题在不久后的将来会有答案。
[1] Szamatowicz M, Szamatowicz J. Proven and unproven methods for diagnosis and treatment of infertility., 2020, 65(1): 93–96.
[2] Gheldof A, Mackay DJG, Cheong Y, Verpoest W. Genetic diagnosis of subfertility: the impact of meiosis and maternal effects., 2019, 56(5): 271–282.
[3] Bala R, Singh V, Rajender S, Singh K. Environment, lifestyle, and female infertility., 2021, 28(3): 617–638.
[4] Kulkarni DS, Owens SN, Honda M, Ito M, Yang Y, Corrigan M W, Chen L, Quan A L, Hunter N. PCNA activates the MutLγ endonuclease to promote meiotic crossing over., 2020, 586(7830): 623–627.
[5] Biswas L, Tyc K, El Yakoubi W, Morgan K, Xing JC, Schindler K. Meiosis interrupted: the genetics of female infertility via meiotic failure., 2021, 161(2): R13–r35.
[6] Xie WJ, Shi DY, Cai ZX, Chen XY, Jin WW. Organization, function and genetic controlling of synaptonemal complex., 2012, 34(2): 167–176.谢文军, 史典义, 蔡泽熙, 陈晓阳, 金危危. 联会复合体的组成、功能及遗传控制. 遗传, 2012, 34(2): 167– 176.
[7] Rog O, Köhler S, Dernburg AF. The synaptonemal complex has liquid crystalline properties and spatially regulates meiotic recombination factors., 2017, 6: e21455.
[8] Bolcun-Filas E, Handel M A. Meiosis: the chromosomal foundation of reproduction., 2018, 99(1): 112–126.
[9] Láscarez-Lagunas L, Martinez-Garcia M, Colaiácovo M. SnapShot: meiosis-prophase I., 2020, 181(6): 1442– 1442.e1.
[10] Handel MA, Schimenti JC. Genetics of mammalian meiosis: regulation, dynamics and impact on fertility., 2010, 11(2): 124–136.
[11] Tyc KM, Mccoy RC, Schindler K, Xing JC. Mathematical modeling of human oocyte aneuploidy., 2020, 117(19): 10455–10464.
[12] Gao JM, Colaiácovo MP. Zipping and unzipping: protein modifications regulating synaptonemal complex dynamics., 2018, 34(3): 232–245.
[13] Fraune J, Brochier-Armanet C, Alsheimer M, Volff JN, Schücker K, Benavente R. Evolutionary history of the mammalian synaptonemal complex., 2016, 125(3): 355–360.
[14] Zwettler FU, Spindler MC, Reinhard S, Klein T, Kurz A, Benavente R, Sauer M. Tracking down the molecular architecture of the synaptonemal complex by expansion microscopy., 2020, 11(1): 3222.
[15] Hurlock M E, Čavka I, Kursel LE, Haversat J, Wooten M, Nizami Z, Turniansky R, Hoess P, Ries J, Gall JG, Rog O, Köhler S, Kim Y. Identification of novel synaptonemal complex components in., 2020, 219(5): e201910043.
[16] Zhang ZG, Xie SB, Wang RX, Guo SQ, Zhao QC, Nie H, Liu YY, Zhang FG, Chen M, Liu LB, Meng XQ, Liu M, Zhao L, Colaiácovo MP, Zhou J, Gao JM. Multivalent weak interactions between assembly units drive synaptonemal complex formation., 2020, 219(5): e201910086.
[17] Geisinger A, Benavente R. Mutations in genes coding for synaptonemal complex proteins and their impact on human fertility., 2016, 150(2): 77–85.
[18] Bolcun-Filas E, Hall E, Speed R, Taggart M, Grey C, De Massy B, Benavente R, Cooke HJ. Mutation of the mouse Syce1 gene disrupts synapsis and suggests a link between synaptonemal complex structural components and DNA repair., 2009, 5(2): e1000393.
[19] Maor-Sagie E, Cinnamon Y, Yaacov B, Shaag A, Goldsmidt H, Zenvirt S, Laufer N, Richler C, Frumkin A. Deleterious mutation in SYCE1 is associated with non-obstructive azoospermia., 2015, 32(6): 887–891.
[20] Pashaei M, Rahimi Bidgoli MM, Zare-Abdollahi D, Najmabadi H, Haji-Seyed-Javadi R, Fatehi F, Alavi A. The second mutation of SYCE1 gene associated with autosomal recessive nonobstructive azoospermia., 2020, 37(2): 451–458.
[21] De Vries L, Behar DM, Smirin-Yosef P, Lagovsky I, Tzur S, Basel-Vanagaite L. Exome sequencing reveals SYCE1 mutation associated with autosomal recessive primary ovarian insufficiency., 2014, 99(10): E2129–2132.
[22] Zhe J, Ye DS, Chen X, Liu YD, Zhou XY, Li Y, Zhang J, Chen SL. Consanguineous Chinese familial study reveals that a gross deletion that includes the SYCE1 gene region is associated with premature ovarian insufficiency., 2020, 27(2): 461–467.
[23] Sánchez-Sáez F, Gómez-H L, Dunne OM, Gallego-Páramo C, Felipe-Medina N, Sánchez-Martín M, Llano E, Pendas A M, Davies O R. Meiotic chromosome synapsis depends on multivalent SYCE1-SIX6OS1 interactions that are disrupted in cases of human infertility., 2020, 6(36): eabb1660.
[24] Costa Y, Speed R, Ollinger R, Alsheimer M, Semple C A, Gautier P, Maratou K, Novak I, Höög C, Benavente R, Cooke H J. Two novel proteins recruited by synaptonemal complex protein 1 (SYCP1) are at the centre of meiosis., 2005, 118(Pt 12): 2755–2762.
[25] Bolcun-Filas E, Costa Y, Speed R, Taggart M, Benavente R, De Rooij DG, Cooke HJ. SYCE2 is required for synaptonemal complex assembly, double strand break repair, and homologous recombination., 2007, 176(6): 741–747.
[26] Schramm S, Fraune J, Naumann R, Hernandez-Hernandez A, Höög C, Cooke HJ, Alsheimer M, Benavente R. A novel mouse synaptonemal complex protein is essential for loading of central element proteins, recombination, and fertility., 2011, 7(5): e1002088.
[27] Hamer G, Wang H, Bolcun-Filas E, Cooke H J, Benavente R, Höög C. Progression of meiotic recombination requires structural maturation of the central element of the synaptonemal complex., 2008, 121(Pt 15): 2445–2451.
[28] Boroujeni P B, Sabbaghian M, Totonchi M, Sodeifi N, Sarkardeh H, Samadian A, Sadighi-Gilani MA, Gourabi H. Expression analysis of genes encoding TEX11, TEX12, TEX14 and TEX15 in testis tissues of men with non-obstructive azoospermia., 2018, 22(3): 185–192.
[29] Gómez-H L, Felipe-Medina N, Sánchez-Martín M, Davies OR, Ramos I, García-Tuñón I, De Rooij DG, Dereli I, Tóth A, Barbero JL, Benavente R, Llano E, Pendas AM. C14ORF39/SIX6OS1 is a constituent of the synaptonemal complex and is essential for mouse fertility., 2016, 7: 13298.
[30] Fan SX, Jiao YY, Khan R, Jiang XH, Javed AR, Ali A, Zhang H, Zhou JT, Naeem M, Murtaza G, Li Y, Yang G, Zaman Q, Zubair M, Guan HY, Zhang XX, Ma H, Jiang HW, Ali H, Dil S, Shah W, Ahmad N, Zhang YW, Shi QH. Homozygous mutations in C14orf39/SIX6OS1 cause non-obstructive azoospermia and premature ovarian insufficiency in humans., 2021, 108(2): 324–336.
[31] Dunce JM, Dunne OM, Ratcliff M, Millán C, Madgwick S, Usón I, Davies OR. Structural basis of meiotic chromosome synapsis through SYCP1 self-assembly., 2018, 25(7): 557–569.
[32] De Vries FAT, De Boer E, Van Den Bosch M, Baarends WM, Ooms M, Yuan L, Liu JG, Van Zeeland AA, Heyting C, Pastink A. Mouse Sycp1 functions in synaptonemal complex assembly, meiotic recombination, and XY body formation., 2005, 19(11): 1376–1389.
[33] Yang F, De La Fuente R, Leu NA, Baumann C, Mclaughlin K J, Wang P J. Mouse SYCP2 is required for synaptonemal complex assembly and chromosomal synapsis during male meiosis., 2006, 173(4): 497–507.
[34] Yuan L, Liu JG, Zhao J, Brundell E, Daneholt B, Höög C. The murine SCP3 gene is required for synaptonemal complex assembly, chromosome synapsis, and male fertility., 2000, 5(1): 73–83.
[35] Wang H, Höög C. Structural damage to meiotic chromosomes impairs DNA recombination and checkpoint control in mammalian oocytes., 2006, 173(4): 485–495.
[36] Roeder GS, Bailis JM. The pachytene checkpoint., 2000, 16(9): 395–403.
[37] Schilit SLP, Menon S, Friedrich C, Kammin T, Wilch E, Hanscom C, Jiang SZ, Kliesch S, Talkowski ME, Tüttelmann F, Macqueen AJ, Morton CC. SYCP2 Translocation-Mediated Dysregulation and Frameshift Variants Cause Human Male Infertility., 2020, 106(1): 41–57.
[38] Miyamoto T, Hasuike S, Yogev L, Maduro MR, Ishikawa M, Westphal H, Lamb DJ. Azoospermia in patients heterozygous for a mutation in SYCP3., 2003, 362(9397): 1714–1719.
[39] Bolor H, Mori T, Nishiyama S, Ito Y, Hosoba E, Inagaki H, Kogo H, Ohye T, Tsutsumi M, Kato T, Tong MQ, Nishizawa H, Pryor-Koishi K, Kitaoka E, Sawada T, Nishiyama Y, Udagawa Y, Kurahashi H. Mutations of the SYCP3 gene in women with recurrent pregnancy loss., 2009, 84(1): 14–20.
[40] Sazegari A, Kalantar SM, Pashaiefar H, Mohtaram S, Honarvar N, Feizollahi Z, Ghasemi N. The T657C polymorphism on the SYCP3 gene is associated with recurrent pregnancy loss., 2014, 31(10): 1377–1381.
[41] Mizutani E, Suzumori N, Ozaki Y, Oseto K, Yamada-Namikawa C, Nakanishi M, Sugiura-Ogasawara M. SYCP3 mutation may not be associated with recurrent miscarriage caused by aneuploidy., 2011, 26(5): 1259–1266.
[42] Liu HB, Huang T, Li MJ, Li M, Zhang CX, Jiang J, Yu XC, Yin YY, Zhang F, Lu G, Luo MC, Zhang LR, Li JS, Liu K, Chen ZJ. SCRE serves as a unique synaptonemal complex fastener and is essential for progression of meiosis prophase I in mice., 2019, 47(11): 5670–5683.
Progress on the correlation between the abnormal synaptonemal complex and infertility
Hui Nie, Yiwen Zhang, Jianing Li, Nannan Wang, Lan Xu
Meiosis, the process of producing haploid gametes from diploid germ cells, acts as the core of sexual reproduction. The synaptonemal complex (SC) is a complex structure formed between homologous chromosomes, which can stabilize the pairing of homologous chromosomes and promote the formation of genetic crossover. More and more evidence suggested that the abnormal synaptonemal complex is closely associated with human infertility. In this review, we summarize the correlation between aberrant central region (CR) components (such asSYCE1/2/3, TEX12, SIX6OS1, SYCP1 mutations ) or lateral elements (LE) (such as SYCP2, SYCP3 mutations) and infertility, in order to provide references for further understanding of the pathological mechanisms underlying reproductive health problems caused by meiotic errors.
meiosis; synaptonemal complex; infertility
2021-09-06;
2021-10-23
山东省自然科学基金项目(编号:ZR2019PC050)和山东师范大学大学生创新创业训练计划项目(编号:S202010445162)资助[Supported by the Natural Science Foundation of Shandong Province (No. ZR2019PC050) and the Innovation and Entrepreneurship Training Program of Shandong Normal University (No. S202010445162)]
聂辉,博士,讲师,研究方向:减数分裂与生殖健康。E-mail: niehui@sdnu.edu.cn
10.16288/j.yczz.21-319
2021/11/25 18:58:43
URI: https://kns.cnki.net/kcms/detail/11.1913.R.20211124.1649.003.html
(责任编委: 张锋)
