主动脉支架置入对大动脉炎所致中主动脉综合征患者左心室功能和结构的影响
2022-01-06华倚虹车武强马文韬董徽何际宁邹玉宝蒋雄京
华倚虹,车武强,马文韬,董徽,何际宁,邹玉宝,蒋雄京
大动脉炎(TA)是一种罕见的累及主动脉及其主要分支的非特异性慢性血管炎。受累血管会出现管壁增厚、纤维化、狭窄、动脉瘤等变化[1]。其中,引起胸降主动脉中远段和腹主动脉近段狭窄的类型被称为中主动脉综合征(MAS)[2],往往导致狭窄近端高血压而远端低血压,持续严重的高血压导致左心室肥厚甚至进展为心力衰竭[3]。本中心既往研究表明经皮主动脉支架置入治疗对于TA-MAS 患者安全可行,且靶血管长期通畅率较高[4-5]。主动脉支架置入能否改善这类患者左心室功能和结构,阻止或逆转左心室肥厚和心力衰竭的进程,这是临床疗效的主要关注点之一,需要进一步明确。为此,我们回顾性收集并分析我院近20 年来诊断为TA-MAS且接受主动脉支架置入治疗患者的临床资料,评估支架置入治疗前后患者左心室功能和结构的变化,并分析其转归因素。
1 资料与方法
1.1 研究对象
回顾性连续收集2000 年4 月至2019 年11 月期间因TA-MAS 在中国医学科学院阜外医院接受经皮主动脉支架置入治疗的患者62 例。所有患者符合1990 年美国风湿协会的大动脉炎诊断标准[6]或2008 年欧洲风湿病联盟(EULAR)儿童大动脉炎诊断标准[7]。中主动脉综合征定义为胸降主动脉中远段和(或)腹主动脉近段直径狭窄≥50%,跨狭窄收缩压差≥20 mmHg(1 mmHg=0.133 kPa)。
1.2 超声心动图检查
使用Phillip CX50 图像采集机器进行超声心动图检查,首先指导其平静状态下处于左侧卧位,摄取心尖部四腔与两腔心切面,并且获得左心室长轴切面。检查医师测量时严格控制于房室瓣关闭时或者心室容积扩张至最大时,即舒张末期进行。升主动脉测量时取主动脉窦上缘1.0 cm 处,垂直于血管壁测量,或测量升主动脉近端的最大径线。检测数据有:左心室舒张末期内径(LVEDd)、舒张末期左心室后壁厚度(LVPWd)、左心室射血分数(LVEF)、室间隔舒张末期厚度(IVSd)、升主动脉内径、主动脉瓣及二尖瓣反流情况等。通过公式:左心室质量(g)=1.04×0.8[ (LVEDd+IVSd+LVPWd)3-LVEDd3]+0.6;并依据公式:体表面积=0.0061×身高(cm)+0.0128×体重(kg)-0.1529,算出体表面积值。左心室质量指数(LVMi)的计算方法:LVMi(g/m2) =左心室质量/体表面积。左心室肥厚程度根据性别采用不同的界值[8-9]:轻度肥厚(女性96~108 g/m2,男性116~131 g/m2),中度肥厚(女性109~121 g/m2,男性132~148 g/m2),重度肥厚(女性≥122 g/m2,男性≥149 g/m2)。采用二维改良Simpson 双平面法计算LVEF。
1.3 实验室检查和临床资料收集
从住院患者电子病历系统中收集年龄、性别、身高、体重,既往病史,基线血压、踝臂指数、N末端B 型利钠肽原(NT-proBNP)、NYHA 心功能分级、血肌酐、血沉、C 反应蛋白(CRP)、出院带药等,介入术前及术后的踝臂指数(ABI)和NT-proBNP。根据术前增强血管CT(CTA)检查结果记录受累血管部位并进行Hata 分型[10]。根据术前和术后CTA记录狭窄处主动脉最小管径。
1.4 支架置入治疗
确诊TA-MAS 后,一般在炎症缓解期予主动脉支架置入治疗。如在炎症活动期,则需抗炎治疗至血沉和CRP 水平正常1~2 个月后方可进行。TA-MAS介入指征包括:(1)符合MAS 的定义;(2)出现MAS导致的临床症状至少一种(下肢间歇性跛行、高血压或左心室功能不全)。排除标准:(1)不能耐受抗血小板药物;(2)病变部位的血管解剖不适合支架置入;(3)病情严重,严重器官功能不全,无法耐受介入手术;(4)炎症急性活动期,(5)对比剂过敏。
介入术前所有患者的血压需控制在160/100 mmHg 以下,能达标更佳。术前连续服用阿司匹林(100 mg/d)和氯吡格雷(75 mg/d)至少2 d。常规经股动脉路径,采用Seldinger 技术进行穿刺。置入6 F 鞘,一次性动脉内给普通肝素50 mg。随后行胸腹主动脉造影,测量并记录病变位置、狭窄程度、病变长度以及跨狭窄峰值收缩压差(PSG)。造影后按拟置入支架导管的外径,把6 F 股动脉鞘交换为大小合适的大鞘(一般8~11 F)并静脉予以5 mg 吗啡镇痛。病变处用直径≤50%~80%临近正常主动脉参考直径的球囊进行顺序预扩张,如在加压扩张过程中患者出现胸部明显胀痛不适,则立刻停止加压。随后撤出球囊,通过留置的长导丝置入自膨支架(Wallstent,波科公司;Luminexx,巴德医疗公司)。支架直径较临近正常主动脉参考直径大约10%~20%,长度覆盖至临近正常直径主动脉约10 mm。支架置入后,复查主动脉造影,并再次测量PSG。如果残余狭窄≥50%,和(或)PSG ≥20 mmHg,则使用较上一个更大直径球囊进行支架内后扩张,直至达标。操作完成后拔除股动脉鞘管,局部止血(压迫止血或者器械止血)后加压包扎,卧床24 h。术后继续双联抗血小板1~3 个月,随后阿司匹林(100 mg/d)维持。
抗炎及降压治疗对于TA 合并高血压的患者十分重要[11]。围术期一般应用泼尼松剂量20~30 mg/d,可以根据需要配合其他免疫抑制剂。定期监测血沉和CRP 水平,如炎症指标正常,泼尼松每4 周减量2.5~5.0 mg,并逐渐减量至5~10 mg/d 维持。根据血压水平调整降压药物,维持血压达标。
1.5 随访
定期复查研究指标,记录有关的临床结果以及不良事件等。建议患者介入术后每年复查超声心动图。建议所有患者在术后平均1 年左右进行电话或门诊随访。
1.6 统计学方法
所有统计学分析采用SPSS 22.0 软件完成。连续变量采用均数±标准差表示,分类变量采用计数或百分比表示。手术前后比较采用配对t检验,组间比较采用方差分析。使用线性回归模型分析主要基线因素及介入治疗对随访时LVMi 较基线的改善率(LVMi%) [(基线LVMi -随访LVMi)/ 基线LVMi]的影响。P<0.05 表示差异具有统计学意义。
2 结果
2.1 临床基线资料
2000 年4 月至2019 年11 月期间,TA 住院患者共785 例,其中诊断为TA-MAS 且行主动脉支架置入治疗的患者62 例(7.9%)。这62 例患者平均年龄(31.3±13.0)岁,女性47 例(75.8%)。TA Hata 分型[10]Ⅴ、Ⅳ、Ⅲ、Ⅱ、Ⅰ分别占比29.0%、22.6%、24.2%、24.2%和0%。62 例TA-MAS 患者的具体基线资料见表1。
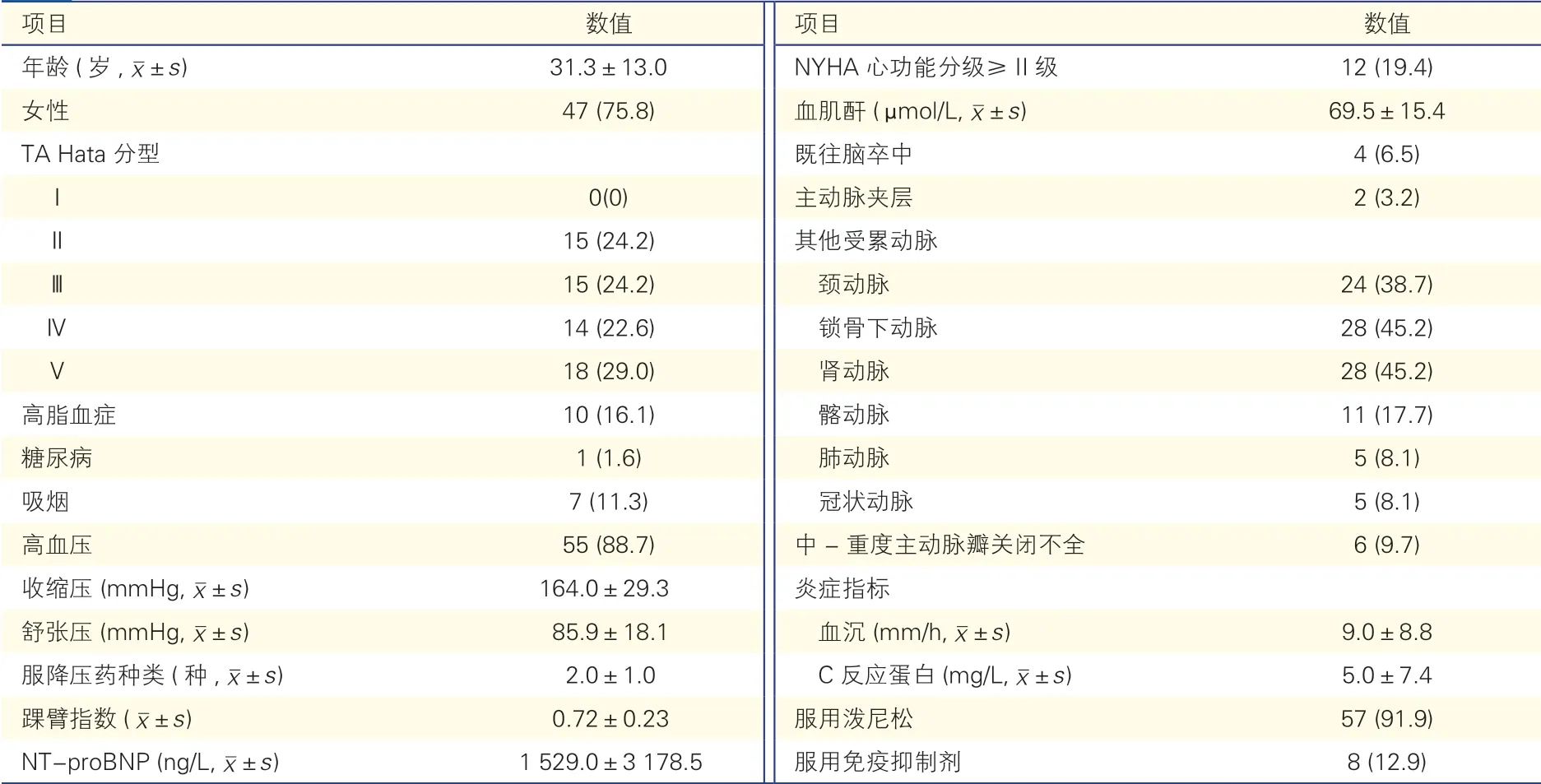
表1 62 例TA-MAS 患者临床基线特征[例(%)]
2.2 主动脉狭窄支架置入治疗相关指标及变化
主动脉狭窄位于肾动脉开口以近的35 例(56.5%),跨肾动脉开口20 例(32.3%),肾动脉开口以远7 例(11.3%)。平均病变长度为(36.5±15.9)mm。所有患者均支架置入治疗成功,平均支架直径为(18.3±4.4)mm,平均支架长度为(50.3±13.2)mm。病变平均狭窄程度由(82.2±9.0)%下降至(14.6±8.5)%,支架置入治疗前降主动脉平均最小管径(5.7±2.1)mm,术后平均最小管径(10.0±2.8)mm,PSG 从(75.6±20.6)mmHg 降 至(18.7±6.8)mmHg。主动脉狭窄在肾动脉开口以远的7个病例中,4 例合并不同程度肾动脉狭窄。1 例患者术中发生腹主动脉夹层累及双侧肾动脉,通过置入自膨式支架覆盖夹层病变,但是左侧肾动脉仍没有有效血流。另1 例发生穿刺部位出血致腹膜后血肿,局部球囊压迫后出血停止,两例患者随访期间均未出现严重不良事件。其余患者均未出现手术并发症。
2.3 按主动脉狭窄部位支架置入术前、后比较(表2)
表2 将TA-MAS 患者按主动脉狭窄部位支架置入术前、后比较(±s)

表2 将TA-MAS 患者按主动脉狭窄部位支架置入术前、后比较(±s)
注:TA-MAS:大动脉炎所致的中主动脉综合征;PSG:跨狭窄峰值收缩压差;LVMi:左心室质量指数;LVEF:左心室射血分数。1 mmHg=0.133 kPa。与肾动脉开口以近比*P<0.05
项目 主动脉狭窄部位 P 值肾动脉开口以近(n=35) 跨肾动脉开口(n=20) 肾动脉开口以远(n=7)术前病变长度(mm) 34.7±15.6 40.4±17.3 34.0±13.7 0.411病变最小管径(mm) 5.7±1.7 5.7±2.7 5.8±3.1 0.991狭窄程度(%) 82.4±7.5 80.5±11.0 85.7±9.3 0.411 PSG(mmHg) 81.1±22.7 67.3±12.9* 62.8±10.8* 0.036收缩压(mmHg) 165.9±31.9 164.6±23.8 152.6±31.6 0.550降压药种类(种) 2.0±1.1 2.2±1.0 1.6±1.1 0.394 LVMi (g/m2) 133.8±59.1 121.3±35.8 98.2±40.7 0.223 LVEF(%) 59.4±14.2 59.8±12.7 64.6±9.8 0.643术后支架直径(mm) 20.5±3.6 15.4±3.9* 14.6±2.5* 0.000支架长度(mm) 53.0±11.3 45.3±10.6 49.9±23.5 0.130病变最小管径(mm) 11.0±2.5 8.2±2.8* 9.9±2.0 0.001残余狭窄程度(%) 11.3±7.2 21.5±7.8* 15.6±7.2 0.001 PSG(mmHg) 18.0±7.9 19.6±4.1 21.5±4.0 0.533收缩压(mmHg) 130.4±21.6 138.4±15.9 133.9±15.5 0.353降压药种类(种) 1.1±0.7 1.2±0.7 1.3±1.0 0.845 LVMi (g/m2) 108.1±43.2 99.0±37.4 92.5±21.4 0.536 LVEF(%) 62.6±11.3 62.0±8.2 65.1±3.3 0.764
62 例患者中55 例(88.7%)病变位于胸主动脉中远段及跨肾动脉开口的腹主动脉。所有患者均成功置入自膨型裸支架。
跨肾动脉开口和肾动脉开口以远病变术前PSG显著低于肾动脉开口以近病变(P<0.05)。跨肾动脉开口和肾动脉开口以远的支架直径均小于肾动脉开口以近的支架直径(P均<0.05)。跨肾动脉开口病变术后最小管径显著小于肾动脉开口以近病变(P<0.05)。跨肾动脉开口病变术后残余狭窄程度显著大于肾动脉开口以近病变(P<0.05)。
2.4 随访时心脏结构、功能及其他相关指标较术前的变化(表3)
表3 随访时左心室功能、结构及其他相关指标较术前的变化(±s)
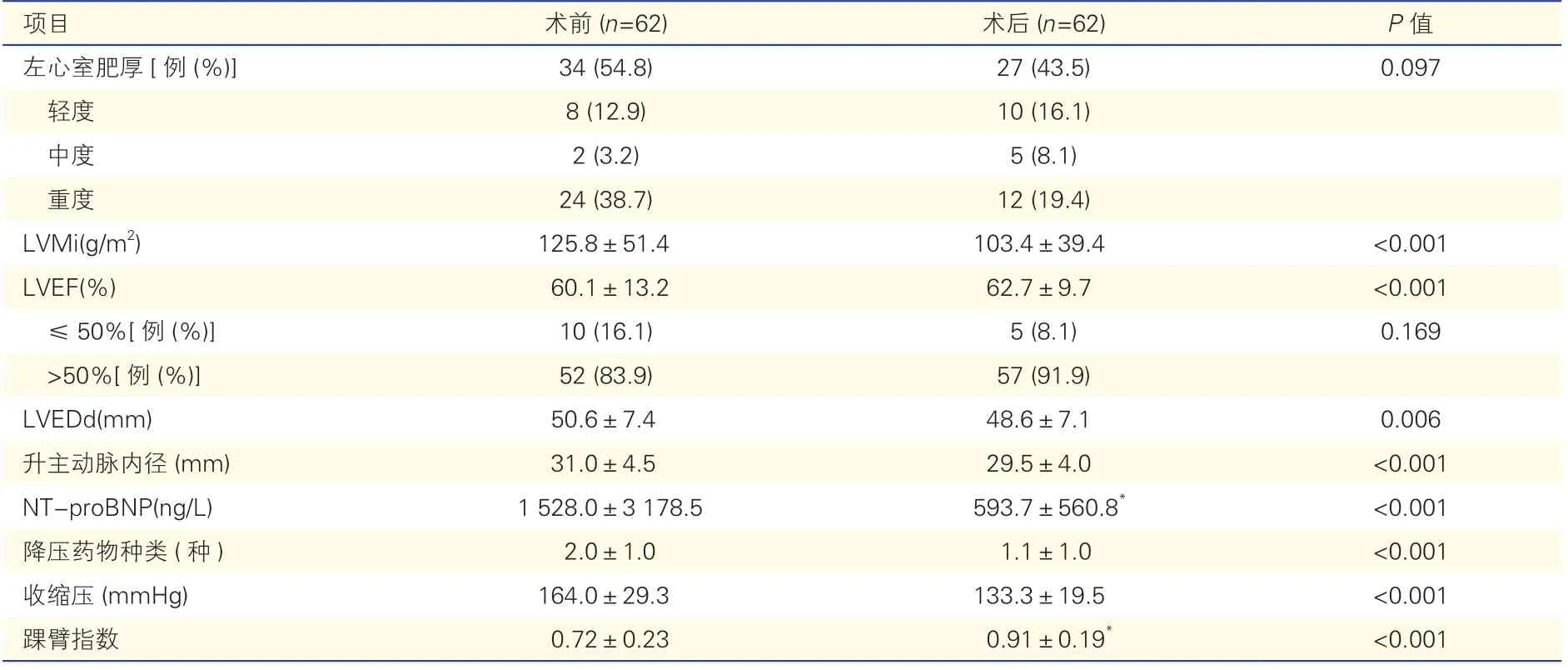
表3 随访时左心室功能、结构及其他相关指标较术前的变化(±s)
注:LVMi:左心室质量指数;LVEF:左心室射血分数;LVEDd:左心室舒张末期内径;NT-proBNP:N 末端B 型利钠肽原。1 mmHg=0.133 kPa。*:指出院前数据,其余均为中期随访数据
项目 术前(n=62) 术后(n=62) P 值左心室肥厚[例(%)] 34 (54.8) 27 (43.5) 0.097轻度 8 (12.9) 10 (16.1)中度 2 (3.2) 5 (8.1)重度 24 (38.7) 12 (19.4)LVMi(g/m2) 125.8±51.4 103.4±39.4 <0.001 LVEF(%) 60.1±13.2 62.7±9.7 <0.001≤50%[例(%)] 10 (16.1) 5 (8.1) 0.169>50%[例(%)] 52 (83.9) 57 (91.9)LVEDd(mm) 50.6±7.4 48.6±7.1 0.006升主动脉内径(mm) 31.0±4.5 29.5±4.0 <0.001 NT-proBNP(ng/L) 1 528.0±3 178.5 593.7±560.8* <0.001降压药物种类(种) 2.0±1.0 1.1±1.0 <0.001收缩压(mmHg) 164.0±29.3 133.3±19.5 <0.001踝臂指数 0.72±0.23 0.91±0.19* <0.001
术前54.8%患者超声心动图有左心室肥厚表现,其中38.7%为重度肥厚。出院前复查NT-proBNP 和踝臂指数均较前明显改善,差异均有统计学意义(P均<0.001)。
术后中位随访时间0.80(0.36,2.31)年。患者LVMi、LVEDd(P=0.006)、收缩压、升主动脉内径、降压药物种类较术前显著降低,LVMi 降幅约12%,LVEF 显著提高(P均<0.001)。15 例(24.2%)患者术后随访时LVMi 没有下降,其中13 例(86.7%)术前就没有左心室肥厚,1 例(6.7%)术后新发肾动脉狭窄,1 例(6.7%)术前合并中度主动脉瓣关闭不全及双侧肾动脉狭窄未同期干预。
2.5 患者的基线因素和支架置入治疗因素对左心室功能和结构转归的影响
先采用单元线性回归模型,把患者的主要基线资料,包括:年龄、性别、血压、是否吸烟、是否合并高脂血症、是否合并糖尿病、降压药种类、主动脉瓣中重度关闭不全、主动脉狭窄部位(肾动脉开口以近、跨肾动脉开口,肾动脉开口以远)、PSG 等作为自变量,单独分析其对LVMi%的影响,发现仅基线PSG 和主动脉狭窄部位与LVMi%相关(P均<0.05)。随后,引入肾动脉狭窄介入是否成功、主动脉支架置入术后ABI 改善进入回归模型进行分析,结果发现术后ABI 改善和肾动脉狭窄介入是否成功均与LVMi%无明显相关(P均>0.05)。
将有相关性的指标纳入多元线性回归分析发现:仅基线PSG 与中位随访0.8(0.36,2.31)年时LVMi% 显 著 相 关(β=0.003, 95%CI: 0.000~0.006,P=0.027),即 基 线PSG 每 增 加1 mmHg,接 受 支架置入术后LVMi% 增加0.3%。主动脉狭窄的部位与术后LVMi% 无相关性(r=-0.060, 95%CI:-0.133~0.012,P=0.102)。
3 讨论
通过文献检索发现,本研究是国内外支架置入治疗TA-MAS 最大样本量的一项回顾性研究。本研究结果显示TA-MAS 支架置入治疗可以显著改善血流动力学参数,减轻或延缓左心室肥厚。支架置入术后患者主动脉最小管径从5.7 mm 提高至10.0 mm,PSG 从(75.55±20.60) mmHg 下降至(18.73±6.81)mmHg。中位随访时间0.8(0.36,2.31)年时LVMi的降幅约12%,与主动脉瓣狭窄术后[12]、先天性主动脉缩窄术后[13-14]的降幅13%~15%基本相当。另外支架置入术后LVEF 和LVEDd 均明显改善。由于TA 血管壁严重纤维化或伴有钙化的病理特点,很多学者担心其管壁增厚僵硬,难以扩张,或球囊扩张可能导致主动脉夹层、破裂等严重后果。总体而言,本研究62 例患者仅一例出现主动脉夹层致一侧肾动脉闭塞,一例腹膜后出血,表明TA-MAS 行球囊扩张加自膨胀支架置入术安全、有效,能显著改善患者的心脏左心室功能和结构。
本研究也发现,与主动脉瓣狭窄及先天性主动脉缩窄术后一样,TA-MAS 支架置入术后也有部分患者LVMi 没有改善。这种现象有以下几个可能的原因。第一,部分患者术前没有左心室肥厚,仅表现为血压升高,因此支架置入术后左心室肥厚改善也不显著,或者说及时置入主动脉支架有效避免患者进展至左心室肥厚阶段。第二,部分患者术后狭窄并没有完全纠正,如本研究显示的术后最小管径为10 mm,其中跨肾动脉病变患者,因担心扩张所致的肾动脉夹层风险,术后最小管径仅为8 mm,均明显低于正常降主动脉管径。第三,左心室对于后负荷增加形成的向心性重构部分可逆[15]。在心肌细胞体积增加,变厚,细胞外基质还没有广泛纤维化以前,减轻左心室后负荷可以有效逆转向心性重构,临床获益最大。第四,TA-MAS 除了降主动脉狭窄带来的机械性梗阻以外,还存在其他引起左心室后负荷增加的因素。比如TA 动脉壁炎症浸润,管壁增厚的基础上,狭窄近段压力升高,胶原沉积增加,血管僵硬,心室-动脉相互作用使得左心室应力增加[16],因此单纯解除狭窄未能明显降低部分患者的左心室后负荷。第五,TA 合并主动脉瓣中重度关闭不全或双侧肾动脉重度狭窄等造成左心室负荷过重的因素不能单纯通过主动脉支架置入来解决。本研究中,在15 例术后LVMi 没有改善的患者中,除外13 例术前不存在左心室肥厚,另外2 例患者,1 例术后出现肾动脉狭窄,1 例合并肾动脉狭窄和中度主动脉瓣关闭不全未同期处理。
本研究中影响LVMi 较基线的改善率LVMi%的因素主要是基线PSG 水平,其通常与狭窄程度是正相关的,也提示严重的TA-MAS 病变应进行及时的干预。另外分析术后PSG下降幅度也与LVMi%相关,但因两者意义相近,未同时列出。临床实践中发现,MAS 病变位于肾动脉或者肾动脉上方时,患者的血压水平和心肾功能损害会更加严重,支架置入术后获益更显著,但本研究亚组分析显示:病变在肾动脉以近时,术前PSG 和LVMi 更大,术后PSG 下降更明显,术后残余狭窄更小,支架直径和血管最小管径显著大于跨肾动脉开口病变和肾动脉开口以远病变。但回归分析并没有发现MAS 病变位置对左心室功能和结构的改善有影响,一方面可能与肾动脉以远主动脉狭窄的7 个病例中的4 例都合并不同程度肾动脉狭窄这一混杂因素有关,另一方面可能也与统计效能有一定关系。另外,临床中关注的术后踝臂指数改善,是否合并主动脉瓣中重度关闭不全,以及肾动脉介入是否成功等因素,可能限于本研究样本量较小,也都未能得到统计学的阳性结果,后期可以通过更大样本量的临床研究进行验证。
本研究显示PSG 与术后心脏功能和结构的恢复密切相关,但研究中患者支架置入术后的PSG 仍可达20 mmHg 左右,为何不选用更大球囊或支架,进一步降低术后PSG,其实这也是由TA 疾病的血管特点所决定,如为了达到更好效果而换用更大的球囊和支架,可能会引起严重的血管夹层,甚至血管破裂的情况。本研究中心经过长期实践发现,对于TA-MAS 的治疗,采用适度的治疗是较为合适的策略,即在狭窄明显改善的基础上,尽量避免夹层的发生。同时,我们中心对于TA-MAS 常规置入自膨胀支架,因支架本身直径较大,相比于小血管,再狭窄风险相对较低;另外这种支架后续还会继续膨胀,这个过程引起夹层风险也很低,还能抵消后续的再狭窄风险,这一点对于患者也是很有益处的。如果选用覆膜支架进行高压力扩张,以达到完全解除狭窄的目的,由于TA 动脉壁的病理特点,一方面可能会大大增加发生主动脉壁内血肿、夹层或破裂的风险;另一方面往往无法充分扩张狭窄病变,支架的覆膜仍卷曲折叠,容易形成血栓或再狭窄;再有中主动脉这个特殊的病变部位结构复杂,重要分支多,覆膜支架可能覆盖重要分支。这三方面均可导致严重不良事件的发生。
对于介入治疗无法开通或开通后残余狭窄严重的病例,可考虑进行外科手术治疗。外科手术远期通畅率高于腔内治疗[17],但是中主动脉这个特殊的病变部位结构复杂,重要分支多,使得外科手术技术难度高,创伤大,且TA 患者容易导致吻合口瘘,吻合口动脉瘤形成或吻合口再狭窄等问题,一旦出现难以再次处理。同时,以往对比两种术式的研究显示主动脉这个特殊病变部位腔内治疗后随访3.2~6.2 年再狭窄率较低[18-19]。综合上述原因,外科手术通常不作为TA-MAS 治疗的首选方式。
本研究也存在一定的局限性:首先,仅选择TA-MAS 支架置入治疗病例进行回顾性分析,无法评估其与保守治疗效果的差别。其次,用LVMi 来衡量左心室压力后负荷的累积效应具有简便、易得的特点,然而LVMi 在病程相对较晚才会有明显的改变,综合更多反映左心室功能和结构的影像检查参数能否更好地把握干预时机值得探索[20]。另外,本研究中患者随访跨度较大(0.36~2.31 年),可能对结果产生一定偏倚,但TA-MAS 是罕见疾病,研究中多数病例分布在全国各地,多数患者不能按计划进行复查,长期规律随访存在较大困难。最后,本研究并未采用临床预后事件作为结果进行分析,鉴于TA 可以累及多处血管床,预后事件与重要脏器血管床是否受累以及临床是否发现有关,因此预后事件并不能完全反映降主动脉单一部位介入治疗的效果。
总之,本研究表明,TA-MAS 患者进行支架置入治疗是比较合适的一个治疗方法。它能显著改善患者的左心室功能和结构;同时对于已经发生左心室功能和结构恶化的患者,如干预及时,大部分在支架置入术后是可逆的,且术前PSG 越大,支架置入治疗后改善越明显。后期我们也将进一步延长随访时间,以期了解其长期临床结果。
利益冲突:所有作者均声明不存在利益冲突
