基于氧化应激探讨中药活性成分防治非酒精性脂肪性肝病的研究进展
2022-01-06张德新
周 静, 张德新
湖北中医药大学 检验学院, 武汉 430065
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)受基因、代谢、环境和肠道菌群的影响,是一种多病因参与的代谢性疾病,包括非酒精性脂肪肝(non-alcoholic fatty liver,NAFL)、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)以及NASH相关肝硬化及其肝细胞癌[1]。研究[2]报道,到2030年NAFLD总人数预计将增长18.3%,达到1.009亿,患病率为28.4%。氧化应激在NAFLD进展中扮演着重要角色,可激活多种转录因子,包括活化核因子κB(NF-κB)、激活蛋白1、p53、缺氧诱导因子1α、过氧化物酶体增殖物激活受体γ(PPARγ),β-catenin/Wnt和核因子E2相关因子2(Nrf2)等,导致多种基因表达[3]。这促进肝星状细胞、巨噬细胞、Kupffer细胞活化,加重NAFLD的炎症、纤维化和凋亡[4]。目前,尚无批准用于NAFLD的药物治疗方案[5]。研究[6]表明,中药在抗氧化应激防治NAFLD方面取得了一定成果。本文就近年来从氧化应激途径对中药活性成分抗NAFLD的研究进展进行阐述,以了解氧化应激在NAFLD的作用机制以及中药活性成分抗氧化应激机理,为预防和控制NAFLD提供科学依据。
1 基于氧化应激对NAFLD的机制探讨
氧化应激由体内自由基、反应性代谢产物如活性氧(ROS)/活性氮(RNS)产生以及抗氧化保护机制之间失衡导致,偏向于氧化[3]。多项研究表明线粒体功能紊乱[7]、细胞色素P450酶2E1(CYP2E1)活性升高[8]、内质网应激[9]、氧化酶家族上调[10]、铁超载[11]引起的氧化应激与NAFLD有关。
1.1 线粒体功能紊乱 Simöes等[7]发现线粒体功能障碍、ROS过度生成、氧化应激损伤等相互作用会促进NAFLD的发生和发展。ROS主要来源于线粒体电子传递链,从而导致线粒体功能障碍,最终使得NAFLD发展的机制主要有:(1)饮食摄入或胰岛素抵抗,线粒体脂肪酸β氧化增加,使电子传递链中电子通量增加,电子传递链产生的电子不通过细胞色素C而直接与氧反应,使ROS增加[12],导致线粒体DNA和蛋白亚基受损,进而增加氧化应激和对线粒体的氧化损伤,以此恶性循环[13];(2)ROS也易氧化线粒体膜磷脂成分,如多不饱和脂肪酸使丙二醛 (malondialdehyde,MDA)和4-羟基壬烯醛(4-hydroxynonenal, 4-HNE)水平升高[14],从而抑制细胞色素C氧化酶,诱导解偶联蛋白2,最终导致线粒体功能异常[15];(3)转录共激活因子过氧化物酶体增殖物激活受体γ共激活因子1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC1α)表达减少,可能导致抗氧化失活[16]。
1.2 CYP2E1活性升高 NAFLD中ROS的另一个主要来源是CYP2E1,它是微粒体氧化系统的一种主要酶,可由乙醇、酮体、游离脂肪酸等诱导[17]。CYP2E1在催化生物转化过程中会产生ROS,诱导脂质过氧化,产生MDA、4-HNE等活性醛类物质,ROS还可以攻击核酸和蛋白质,诱导线粒体膜通透性,损害线粒体呼吸链关键酶,进一步增加电子泄漏和ROS的形成,引起严重的氧化应激、线粒体功能障碍和细胞死亡[18]。Diesinger等[19]发现作为CYP2E1活性位点的竞争性抑制剂,ω-咪唑烷基衍生物 Ⅰ-ol和 Ⅰ-An部分呈剂量依赖性缓解NAFLD小鼠模型氧化应激,可能成为治疗NAFLD的一种新途径。
1.3 内质网应激 脂质过载也会引起内质网应激,主要通过激活未折叠蛋白反应途径[20]。未折叠蛋白反应通过激活特定下游信号通路使得ROS生成增加,还可通过需要肌醇的信号蛋白1(inositol-requiring signaling protein 1,IRE1)途径激活c-Jun氨基末端激酶(JNK),诱发炎症反应使ROS升高,而IRE1可抑制胰岛素受体底物活性,加重胰岛素抵抗[21]。饱和脂肪酸也会诱导内质网钙储存的破坏,这可以通过形成细胞色素C的通透性转换孔作用于线粒体,从而增加ROS和诱导细胞凋亡[22]。Xu等[23]发现miR-26a过表达可降低衣霉素或毒胡萝卜素处理的NAFLD模型细胞磷酸化真核翻译起始因子2亚基α(p-eIF2α)、IRE1α和C/EBP 同源蛋白(CHOP)表达,与高脂饮食喂养的野生型(WT)小鼠相比,肝脏特异性miR-26a转基因小鼠中p-eIF2α、磷酸化PEK内质网激酶、结合免疫球蛋白、CHOP和蛋白质二硫键异构酶降低,表明miR-26a缺乏加重内质网应激和NAFLD进展。
1.4 氧化酶家族上调 尼克酰胺腺嘌呤二核苷酸磷酸氧化酶(NADPH oxidase,NOX)在许多病理条件下都是ROS的主要来源,其中肝脏主要的活性氧产生氧化酶NOX1、NOX2(主要产超氧化物)和NOX4(主要产H2O2)[10]。且CYP2E1可以增强NOX活性,促进ROS形成[14]。也有研究[24]发现NASH患者NOX2显著上调,摄入黑巧克力(含可可多酚)2周会降低NASH患者血清可溶性NOX2衍生肽、异前列腺素和细胞角蛋白18水平,表明NOX2可能是对抗NASH的一个靶点。
1.5 铁超载 铁是生物必须的微量营养素,一旦铁过量,常蓄积在肝脏、心脏、内分泌器官等。通过Fenton反应产生ROS,引起脏器或组织的损伤,而肝脏铁超载可能有助于大泡性脂肪变性的初始发展和进展为NASH[25]。在约1/3的NAFLD患者中发现了肝脏的铁蓄积[11]。铁沉积于网状内皮系统(RES)对肝脏以及心血管致命和非致命事件的综合原因特异性危险比(csHR)为2.4(95%CI:1.0~5.8,P=0.048)和3.2( 95%CI:1.2~8.2,P=0.015),肝细胞/网状内皮系统(HC/RES)混合铁沉积模式csHR更高,为3.6(95%CI:1.4~9.5,P=0.010)。表明RES与不良结局相关,会增加总体死亡率和肝脏相关或心血管事件的风险[26]。分析其原因,RES铁沉积更可能是全身和肝脏炎症机制的指标,从而推动NAFLD的发展。
2 中药活性成分抗NAFLD氧化应激作用
近年来多种中药活性成分被证明具有改善NAFLD的作用,主要包括黄酮类、多糖类、多酚类、生物碱类、三萜类、苷类等,多种中药活性成分不仅有抗炎、抑菌、降脂、抗癌、免疫调节等作用,还具有抗氧化的作用。下文将各中药活性成分对NAFLD抗氧化作用进行阐述,为后续中药防治NAFLD提供参考。
2.1 黄酮类 Zhong等[27]发现黄芩苷给药组能显著降低高脂肪高胆固醇饮食(HFC)诱导的NAFLD小鼠体内的MDA、4-HNE、8-羟基脱氧鸟苷(8-OhdG)水平,明显增加谷胱甘肽(glutathione,GSH)和超氧化物歧化酶(superoxide dismutase,SOD)水平,黄芩苷抗氧化应激作用可能与同时抑制CYP2E1和JNK的活化有关。Ou等[28]发现水飞蓟宾治疗可明显减轻蛋氨酸及胆碱缺乏饮食(MCD)诱导的NASH小鼠模型的肝脂肪变性,降低模型组CYP2E1和4-HNE的组织水平,提高SOD水平,水飞蓟宾在这项研究中显示出抗氧化作用,与上调依赖于Nrf2的抗氧化剂基因谷氨酰半胱氨酸连接酶调节亚基(GCLM),谷氨酸半胱氨酸连接酶催化亚基(GCLC),醌氧化还原酶1(NQO1),血红素加氧酶1(HMOX1)和谷胱苷肽S转移酶M1(GSTM1)有关,表明水飞蓟宾可能充当新型Nrf2诱导剂。刘皎皎等[29]利用高脂饮食喂养雄性SD大鼠建立NAFLD模型,发现虎杖苷以剂量依赖方式提高大鼠肝脏SOD和GST水平,降低MDA水平,提示虎杖苷具有明显的抗氧化作用,能有效抑制NAFLD大鼠模型肝脏脂质过氧化。Porras等[30]发现槲皮素不仅能调节脂质代谢基因表达、降低CYP2E1的过度表达,还能逆转肠道微生物失调、抑制内毒素血症介导的TLR-4-NF-κB的炎症反应、降低内质网应激标志物葡萄糖调节蛋白78(GRP78)、CHOP表达。
2.2 多糖类 黄芪多糖能改善高脂饮食诱导的NAFLD小鼠模型肝损伤,降低MDA,提高血清总SOD活性,护肝作用优于辛伐他汀组,具有抗氧化性[31]。舒涛等[32]发现玉米须多糖能够明显降低高脂饮食诱导的NAFLD大鼠体质量、TG、TC和ROS水平,能显著升高miR-146a且下调NOX4的表达水平从而缓解肝脏脂肪累积以及氧化应激损伤,表明玉米须多糖对NAFLD大鼠的保护作用与调控miR-146a/NOX4/ROS通路有关。Li等[33]发现灵芝多糖可显著降低T2DM合并NAFLD小鼠的体质量、MDA和TNFα水平,增加SOD、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和Nrf2及下游靶基因HO-1的蛋白表达,表明灵芝多糖通过调节Nrf2/HO-1信号通路,以减轻模型小鼠肝脏脂肪变性、氧化应激和炎症反应。郭怡琼等[34]发现枸杞多糖能够降低高脂饮食诱导的NAFLD大鼠的TG、TC、MDA水平,升高HDL、SOD水平,枸杞多糖改善NAFLD大鼠肝脏脂肪变性和降低氧化应激损伤与上调PGC1α有关。
2.3 酚类 Gheibi等[35]通过检测NAFLD模型大鼠血清TG、HDL、LDL以及肝脏MDA、SOD、GSH-Px、总抗氧化剂能力(total antioxidant capacity,TAC)、NO水平,发现与未治疗组相比,姜黄素和去氧胆酸均可显著降低血清NO、TAC和GSH-Px、SOD的水平,共同给药组降低更加明显,表明姜黄素单用和联合去氧胆酸均能降低NAFLD肝脏脂肪变性,提高抗氧化能力,联合使用效果更佳。也有学者[36]比较洛伐他汀,姜黄素、小檗碱在治疗NAFLD中的作用,发现姜黄素、小檗碱均能降低模型小鼠的TG、TC、LDL、MDA水平,提高HDL、GSH-Px水平,且姜黄素联用小檗碱对改善NAFLD大鼠氧化应激效果优于洛伐他汀。白藜芦醇(10和20 μmol/L)可以降低HepG2细胞的脂肪变性,通过线粒体膜电位和染色发现,白藜芦醇显著降低了游离脂肪酸混合物处理HepG2细胞的氧化应激[37]。Xia等[38]发现绿茶多酚(200 mg/kg)干预能显著降低高脂饮食诱导NAFLD大鼠模型的空腹血糖、胰岛素抵抗、肝脏脂肪以及TNFα、IL-6、MDA水平。相比之下,肝脏中的SOD升高。综上,多酚类具有强大的抗氧化能力。
2.4 生物碱类 小檗碱干预降低了高脂饮食诱导的NAFLD小鼠血清TG、TC和LDL水平,增加了HDL水平,能逆转模型小鼠SIRT3的下调并降低长链酰基辅酶A脱氢酶(LCAD)脱乙酰化,将SIRT3敲除后,小檗碱这种有益作用显著减弱,进一步证明小檗碱通过激活 SIRT3 促进LCAD脱乙酰化来促进线粒体β氧化[39]。丁静等[40]研究发现盐酸小檗碱能够降低ROS、MDA表达,通过促进NRf2核转位和NRf2 mRNA表达而对NAFLD小鼠模型肝脏发挥保护作用。Chen等[41]发现川芎嗪可降低高脂饮食诱导的NAFLD小鼠模型MDA和ROS水平,提高GSHpX活性,辛伐他汀组提高了SOD和GSH-pX水平,MDA未增高,川芎嗪与辛伐他汀组都能通过抑制TNFα/(p-NF-κB)/ ROS信号通路而发挥对NAFLD小鼠肝脏的保护作用。费雯婕等[42]发现氧化苦参碱干预组与二甲双胍组均能显著降低NAFLD细胞模型MDA和ROS生成,提高了总SOD、GSH-Px活性,表明氧化苦参碱能提高HepG2细胞的抗氧化能力,减少氧化应激损伤。另有学者[43]发现,荷叶碱治疗能使高脂饮食诱导的NAFLD大鼠模型肝脏中的SOD和GSH-Px的活性以及磷脂酰胆碱和1-酰基甘油磷酸胆碱的水平增加,而降低MDA水平和CYP2E1、CYP3A4和脂肪酸去饱和酶2的表达,表明荷叶碱抗氧化机制可能与抑制肝脏中CYP酶的表达有关,从而改善NAFLD大鼠的氧化应激反应,缓解肝脏脂肪变性。
2.5 三萜类 Cheng等[44]用人参皂苷Rg2处理油酸与棕榈酸诱导的原代肝细胞NAFLD模型后,可有效抑制ROS过量生成,促进抗氧化基因包括GCLC、GCLM、Kelch 样环氧氯丙烷相关蛋白-1(Keap1)、HOMX1、和 Nrf2表达,表明人参皂苷Rg2能纠正原代肝细胞的氧化还原失衡,可能与激活SIRT1有关。另一研究[45]表明人参皂苷Rg1预防氧化应激的作用可能是通过PPARα减少脂质过氧化,同时降低该NAFLD模型小鼠肝脏中GPR78、CHOP和Caspase- 12的表达来减轻肝脏内质网应激。人参皂苷Rg1亦可上调PPARα转录水平,进而靶向改善脂肪代谢[46]。Yang等[47]通过体内外实验发现高脂诱导可明显促进NAFLD小鼠模型铁的积累,表现为转铁蛋白受体1的上调和铁蛋白重链1的下调,银杏内酯B能显著降低NAFLD细胞和动物模型的TG、TC、MDA、游离脂肪酸、Fe2+、ROS水平,升高SOD、GSH-Px ,其减轻NAFLD模型的氧化应激水平和铁超载的机制与激活Nrf2通路有关。黄强等[48]用不同剂量积雪草苷干预NAFLD模型大鼠,结果发现各剂量组以不同程度降低模型小鼠的TG、TC水平以及CYP2E1的表达,其中高剂量组(45 mg/kg)能显著降低MDA水平,提高SOD活性,表明积雪草苷对NAFLD具有一定的抗氧化作用,其减轻肝脏脂质过氧化作用机制可能与抑制CYP2E1信号通路有关。
2.6 苷类 Shen等[49]通过体内体外实验诱导NAFLD模型,用栀子苷干预后,能显著降低大鼠模型TG、TC、LDL、VLDL水平,提高HDL、SOD水平,栀子苷改善NAFLD大鼠和HepG2细胞脂肪变性,抑制氧化应激损伤的机制与Nrf2通路有关。Ma等[50]发现芍药苷治疗降低了NAFLD大鼠模型肝脏脂肪变性,提高了小鼠模型肝脏和血清的SOD活性,降低了MDA、ROS产生并抑制肝脏中CYP2E1的表达,芍药苷预防氧化应激的潜在作用可能与减少自由基产生或增加自由基清除活性有关。许琼梅等[51]发现龙胆苦苷治疗组能降低NAFLD模型大鼠的血清TG、TC、LDL水平,提高HDL,改善大鼠肝脏的脂肪变性,同时龙胆苦苷治疗组SOD、GSH-Px升高,MDA降低,其抗氧化应激作用与增强p-AMPK、Nrf2蛋白水平有关。各中药活性成分对NAFLD的抗氧化作用总结如表1。
3 小结与展望
NAFLD所涉及的病理机制复杂,而氧化应激是NAFLD发病过程中的重要部分,因此抗氧化应激损伤成为治疗NAFLD的关键。中药抗氧化应激作用以防治NAFLD的机制主要有改善肝脏脂肪变性,提高抗氧化相关基因表达水平,增强抗氧化酶活性,降低脂质过氧化。但目前研究多集中于细胞和动物阶段,检测指标以TG、TC、SOD、MDA为主,研究指标相对单一,且缺少临床试验研究,另外,不同中药活性成分配伍研究较少。因此,探索特异性指标,从多角度、多条信号转导途径深入研究中药活性成分抗氧化应激的作用机制,组合不同中药活性成分复方,可为预防和治疗NAFLD提供科学依据。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:周静负责查找文献,分析资料,撰写论文初稿;张德新负责拟定写作思路,指导撰写文章并最后定稿。
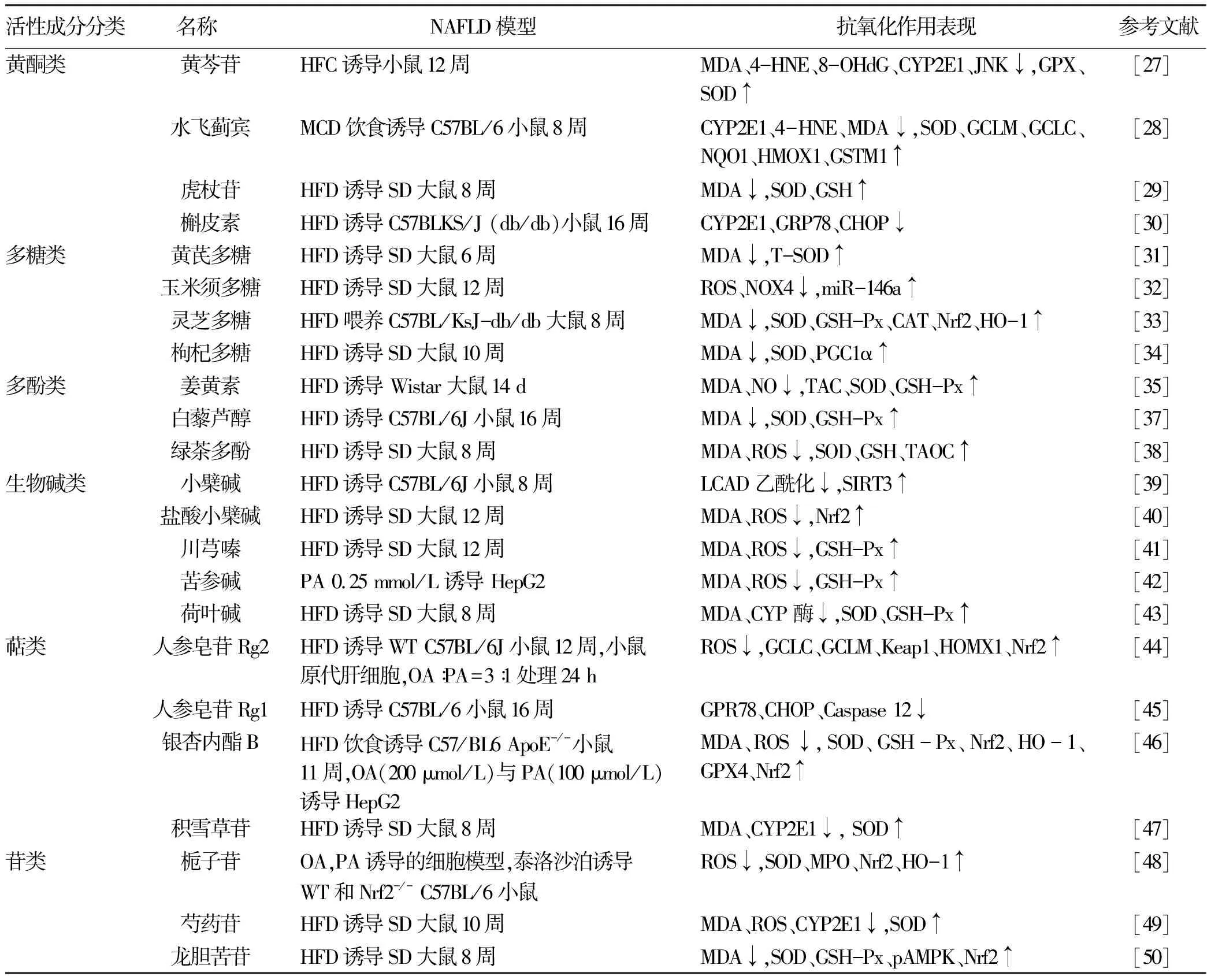
表1 中药活性成分对NAFLD的抗氧化作用
