脐带间充质干细胞外泌体携载miR-4465抑制食管癌细胞的侵袭及迁移
2022-01-05孙峰,谢玮
孙 峰,谢 玮
0 引 言
食管癌是临床上比较常见的一类消化道恶性肿瘤,尽管近年来针对食管癌的筛查及早诊早治工作,使食管癌的发病率和死亡率有所下降,但对于中晚期以及发生远端器官转移的食管癌患者的疗效仍较为有限[1-2]。因此,寻找新的有效地抑制癌细胞转移的治疗靶点和治疗手段成为了近年来的研究热点[3]。间充质干细胞(mesenchymal stem cell, MSC)是一种来源于中胚层的成体干细胞,因其具有低免疫原性、肿瘤趋向性和免疫调节能力而被广泛用于再生医学和肿瘤治疗领域[4]。近年来研究表明,MSC主要依赖其旁分泌效应发挥治疗作用,MSC旁分泌的外泌体是其发挥生物学作用的主要活性成分[5]。外泌体是细胞分泌的具有双层脂膜结构的微小胞外囊泡,包裹有来源细胞的各种核酸、蛋白质、脂质等生物活性物质[6]。MSC来源的外泌体(mesenchymal stem cells derived exosome, MSC-ex)具有与MSC类似的生物学活性,如低免疫原性、免疫调节能力及肿瘤归巢能力,且更具有易于储运、改造,无致瘤风险等优点,因而MSC-ex常被用作miRNA、蛋白或药物载体来治疗肿瘤[7-8]。如骨髓MSC-ex携带miR-196b-5p的抑制结肠癌细胞增殖、迁移和侵袭,并诱导细胞凋亡[9]。脂肪MSC-ex能够转运MSC来源的miR-122,提高肝癌细胞对化疗药物索拉非尼的敏感性,而脂肪MSC-ex对于肝癌细胞的体内外生长没有影响[10]。近来研究表明,miR-4465可作为抑癌miRNA[11],抑制宫颈癌[12]、结肠癌[13]、乳腺癌及肝癌的侵袭和转移[14-15],提高癌细胞的化疗敏感性。然而,miR-4465调控食管癌细胞生物学活性的作用尚未见报道,脐带MSC-ex能否作为miRNA载体抑制食管癌细胞的侵袭和转移仍然不清楚。本研究旨在探讨脐带MSC-ex作为载体装载miR-4465抑制食管癌细胞EC109侵袭、迁移的作用及机制。
1 材料与方法
1.1 试剂和仪器食管癌细胞株EC109 购自中国科学院上海细胞库;高糖DMEM、低糖DMEM、0.25%胰蛋白酶(美国Gibco公司);胎牛血清(澳大利亚Bovogen公司);100Kda MWCO超滤离心管(德国Millipore公司);外泌体提取试剂盒ExoQuick(美国SBI公司);荧光染料CM-DiR;二氧化碳培养箱(美国Forma公司);蛋白提取和BCA检测试剂盒(中国碧云天公司);小鼠抗人CD9抗体、小鼠抗人CD81抗体、兔抗人β肌动蛋白抗体、HRP标记山羊抗兔/鼠IgG (美国Bioworld公司);小鼠抗人Smad1/2抗体、兔抗人p-Smad1/2抗体(美国Abcam公司);兔抗人E-cadherin抗体、小鼠抗人Vimentin抗体、小鼠抗人N-cadherin抗体(Santa cruz公司);Matrigel基质胶(美国BD公司);Transwell小室(美国Corning公司);Trizol、lipofectamine 2000、Opti-MEM、引物(美国Invitrogen公司);miScript II RT kit、miScript SYBR Green PCR kit (德国QIAGEN公司);miR-4465 mimics(中国吉玛基因有限公司);超声破碎仪(美国Branson公司)荧光定量PCR仪(美国Bio-Rad公司);化学发光成像系统ImageQuant LAS4000mini (美国GE公司);HT7800透射电镜(日本HITACHI公司)。
1.2MSC-ex的分离及鉴定脐带标本来源于知情同意的健康产妇,根据本实验室已建立的方法分离脐带MSC。胎牛血清分装至超速离心管,120 000×g超离14~16 h, 45 μm滤器过滤上清,获得不含外泌体的胎牛血清。脐带MSC培养于10%不含外泌体的胎牛血清的低糖DMEM中,于37 ℃、5% CO2培养箱中贴壁培养。收集3~5代、处于对数生长期的脐带MSC的细胞培养上清,采用梯度-超速离心的方法提取MSC-ex。4 ℃、1000×g离心20 min去除细胞碎片;收集离心后上清,2000×g离心20 min,加入到15 mL 规格的100Kda MWCO超滤离心管中,1000×g离心30 min,得到浓缩液;根据外泌体提取试剂盒ExoQuick操作说明,加入快速提取试剂,4 ℃沉淀12 h;4 ℃、1500×g离心30 min收集MSC-ex;BCA 蛋白定量试剂盒测定蛋白浓度,0.22 μm滤膜过滤除菌。2%多聚甲醛固定MSC-ex,滴加于载样铜网,3%磷钨酸溶液(pH=6.8)复染5 min,室温干燥后采用透射电镜观察MSC-ex结构并采集图像。蛋白质免疫印迹检测外泌体表面标志CD9(1∶500)、CD81(1∶500),分装保存于-70 ℃。纳米颗粒分析检测MSC-ex的体积及浓度。
1.3超声法转运miR-4465 mimics进入MSC-ex超净台中取100 μg MSC-ex,分别加入miRNA mimics NC(阴性对照)、25 nmol/L和50 nmol/L的miR-4465 mimics(模拟物),混匀后室温静置5 min;采用超声仪在冰上进行超声, 每次脉冲4 s,超声6次,获得miRNA mimics NC修饰MSC-ex(NC miR-ex)及miR-4465 mimics修饰MSC-ex(miR-4465-ex)。
1.4EC109细胞培养、miR-4465修饰MSC-ex处理及miR-4465转染miR-4465修饰MSC-ex处理EC109细胞:EC109细胞培养于含10%胎牛血清的高糖DMEM,37 ℃、5% CO2培养箱中贴壁培养。取对数生长期浓度为2×105/mL的EC109细胞接种于6孔板,分别加入PBS、NC miR-ex及miR-4465-ex,培养48 h后收集细胞备用。miR-4465转染EC109细胞:取对数生长期浓度为2×105/mL的EC109细胞接种于6孔板,利用Lipofectamine 2000分别转染miRNA mimics NC(阴性对照)及浓度为50 nmol/L、100 nmol/L的miR-4465mimics(miR-4465模拟物),转染48 h后收集细胞备用。
1.5免疫荧光检测MSC-ex在EC109细胞内定位EC109细胞接种于置有细胞爬片的6孔板,细胞贴壁后加入MSC-ex,37 ℃避光孵育6 h。采用4% 多聚甲醛固定爬片15 min,PBS浸洗3次;0.5 %Triton X-100室温通透 20 min;PBS浸洗爬片3次,滴加正常山羊血清室温封闭 30 min;滴加稀释后CD9一抗(1∶100),4 ℃ 孵育过夜;PBST 浸洗3 次,滴加稀释好的荧光二抗,湿盒中37 ℃ 孵育 1 h,PBST 浸洗3次, 滴加DAPI避光孵育 5 min染核,用含抗荧光淬灭剂的封片液封固,荧光显微镜下观察采集图像。
1.6免疫印迹法(Western blot)检测EC109细胞的蛋白表达RIPA裂解液裂解EC109细胞,提取总蛋白,BCA 蛋白定量试剂盒测定蛋白浓度。采用10% 的SDS-PGAE,每孔加入20 μg 左右蛋白进行SDS-PGAE电泳。电泳结束后将蛋白转印至 PVDF 膜,5% 脱脂牛奶室温封闭 1 h;分别加入5% 脱脂牛奶稀释的兔抗人β肌动蛋白抗体(β-actin, 1∶3000)、兔抗人E-cadherin抗体(1∶2000)、小鼠抗人Vimentin抗体(1∶2000)、小鼠抗人N-cadherin抗体(1∶1000)、小鼠抗人smad2/3抗体(1∶1000)、兔抗人p-smad2/3抗体(1∶1000),4 ℃孵育过夜。TBST洗膜3次后加入5% 脱脂牛奶稀释的HRP标记山羊抗兔/鼠IgG (1∶3000),37 ℃温育1 h。TBST洗膜3次后加入化学发光试剂,化学发光成像系统显影分析。
1.7定量逆转录PCR(qRT-PCR) 检测EC109细胞中miR-4465水平TRIZOL法提取MSC-ex作用前后EC109细胞的总RNA,测定RNA浓度及纯度,采用 miScript II RT kit逆转录试剂按照说明合成cDNA,-20 ℃保存备用。采用miScript SYBR Green PCR kit检测EC109细胞的miR-4465表达。反应体系总体积20 μL,包括2× SYBR Green Super mix 10 μL、引物1和2各0.5 μL、cDNA 1 μL和DEPC水8 μL。引物序列: miR-4465上游引物序列为5'-CUCAAGUAGUCUGACCAGGGGA-3'。U6上游引物序列为5'-CTCGCTTCGGC AGCACATATACT-3'。通用引物序列为5'-ACGCTTCACGAATTTGGTTC-3'。采用 2-ΔΔCt法计算测EC109细胞中miR-4465水平。
1.8细胞划痕实验检测EC109细胞的迁移率取MSC-ex及miR-4465-ex处理的EC109细胞均匀接种至6孔板,培养至90%融合,用10 μL移液器吸头垂直于直尺,于6 孔板孔内形成划痕,PBS洗涤去除悬浮细胞,加入含10%FBS的培养基,5% CO2、37 ℃培养0、12、24及36 h后显微镜下观察、拍照并记录划痕宽度。根据细胞愈合的相对距离判断细胞的迁移率。
1.9Transwell小室法检测EC109细胞的侵袭细胞数取MSC-ex及miR-4465-ex处理的EC109细胞制成细胞悬液,调整细胞浓度为2×105/mL,充分混匀后,加入铺有Matrigel胶的 Transwell小室,每个Transwell 小室中接种 0.5 mL 细胞悬液,下室加入750 μL含10%FBS的培养基,培养48 h。取出培养小室,PBS洗涤后棉签擦去未侵袭细胞,4%多聚甲醛固定10 min,加入1 mL 0.5% 结晶紫溶液染色 20 min,PBS洗涤,微镜下随机选择5个视野进行观察拍照,计数每个视野的侵袭细胞数。
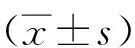
2 结 果
2.1 MSC-ex的鉴定及MSC-ex在EC109内分布免疫印迹法检测MSC及MSC-ex的外泌体生物标志物 CD9和CD81表达,结果显示MSC-ex高表达CD9、CD81,而MSC中未检测出标志物表达,见图1。透射电子显微镜(TEM)观察MSC-ex的结构,结果表明MSC-ex为直径30~150 nm的杯状囊泡,膜结构完整。纳米颗粒分析仪(NTA)检测MSC-ex的直径分布及浓度,结果显示MSC-ex平均直径约为110nm,提取获得的MSC-ex约为6×106/mL,见图2。这些结果提示成功提取得到MSC-ex。
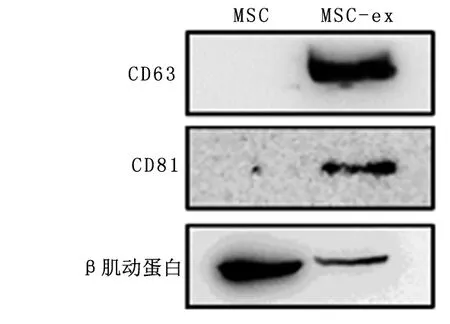
图 1 免疫印迹法检测外泌体标志Figure 1 Expression ofexosome marker wasexamined by Western blot
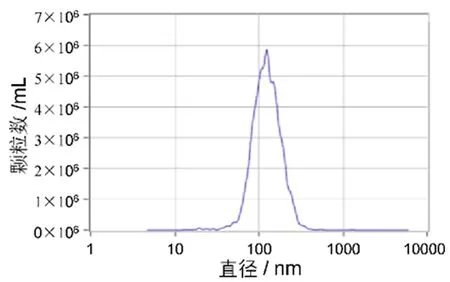
图 2 纳米颗粒分析仪检测MSC-ex的粒径分布及浓度Figure 2 Particle size distribution and concentration of MSC-exwas examined by nanoparticle analyzer
2.2MSC-ex传递miR-4465至EC109细胞荧光显微镜下观察显示,共培养6 h后,可见CD9阳性的MSC-ex分布在细胞细胞质及细胞核周围,表明MSC-ex可被EC109摄取。见图3。qRT-PCR检测mimics NC修饰的MSC-ex(NC miR-ex)及miR-4465修饰MSC-ex(miR-4465-ex)分别与EC109细胞共培养。与NC miR-ex组(1.00±0.09)比较,miR-4465-ex 25 nmol/L、miR-4465-ex50nmol/L组EC109细胞中miR-4465表达水平(20.26±2.75、34.71±5.26)显著升高(P<0.01),且具有剂量依赖性。结果表明,MSC-ex可转运miR-4465进入EC109细胞,增加EC109细胞中miR-4465水平。

图 3 免疫荧光检测MSC-ex作用后EC109细胞CD9表达Figure 3 Expression of CD9 in EC109 cells treated with MSC-exwas examined by immunofluorescence
2.3miR-4465抑制EC109细胞的迁移及侵袭与mimics NC组相比,miR-4465 mimics25 nmol/L和miR-4465 mimics50nmol/L转染组侵袭的EC109细胞数均明显减少,且具有浓度依赖性(P<0.01),见图4。与mimics NC组(84.67±4.60)相比,miR-4465 mimics25 nmol/L(23.67±4.14)转染组EC109细胞的迁移率明显降低(P<0.01),且miR-4465 mimics50nM(10.27±1.32)转染组EC109细胞的迁移率更加明显(P<0. 01)。提示miR-4465可显著抑制EC109细胞的迁移、侵袭。
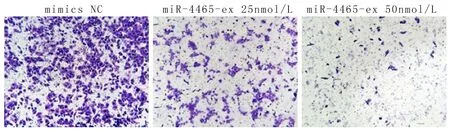
图 4 Transwell实验检测miR-4465转染后EC109细胞的侵袭Figure 4 Invasion of miR-4465 transfected EC109was examined by Transwell assay
2.4MSC-ex运载miR-4465抑制 EC109细胞的迁移及侵袭与PBS组相比,NC miR-ex组EC109细胞的侵袭数明显减少(P<0.01),见图5。与NC miR-ex组(82.35±4.52)比较,miR-4465-ex组(23.12±2.22)EC109细胞的迁移率明显降低(P<0.01),提示miR-4465修饰能够增强MSC-ex抑制EC109细胞迁移、侵袭的能力。Western blot结果表明,与PBS和NC miR-ex组相比,miR-4465-ex作用后EC109细胞N-Cadherin(P<0.05)、p-Smad1/2(P<0.01)和Vimentin(P<0.01)表达下调,E-Cadherin表达上调(P<0.01),见图6。表明miR-4465-ex能够抑制EC109细胞上皮-间质化相关蛋白的表达以及间质化通路Smad1/2的活化。

图 5 Transwell实验检测miR-4465转染后EC109细胞的侵袭Figure 5 Invasionof miR-4465-extreated EC109 was examined by Transwell assay
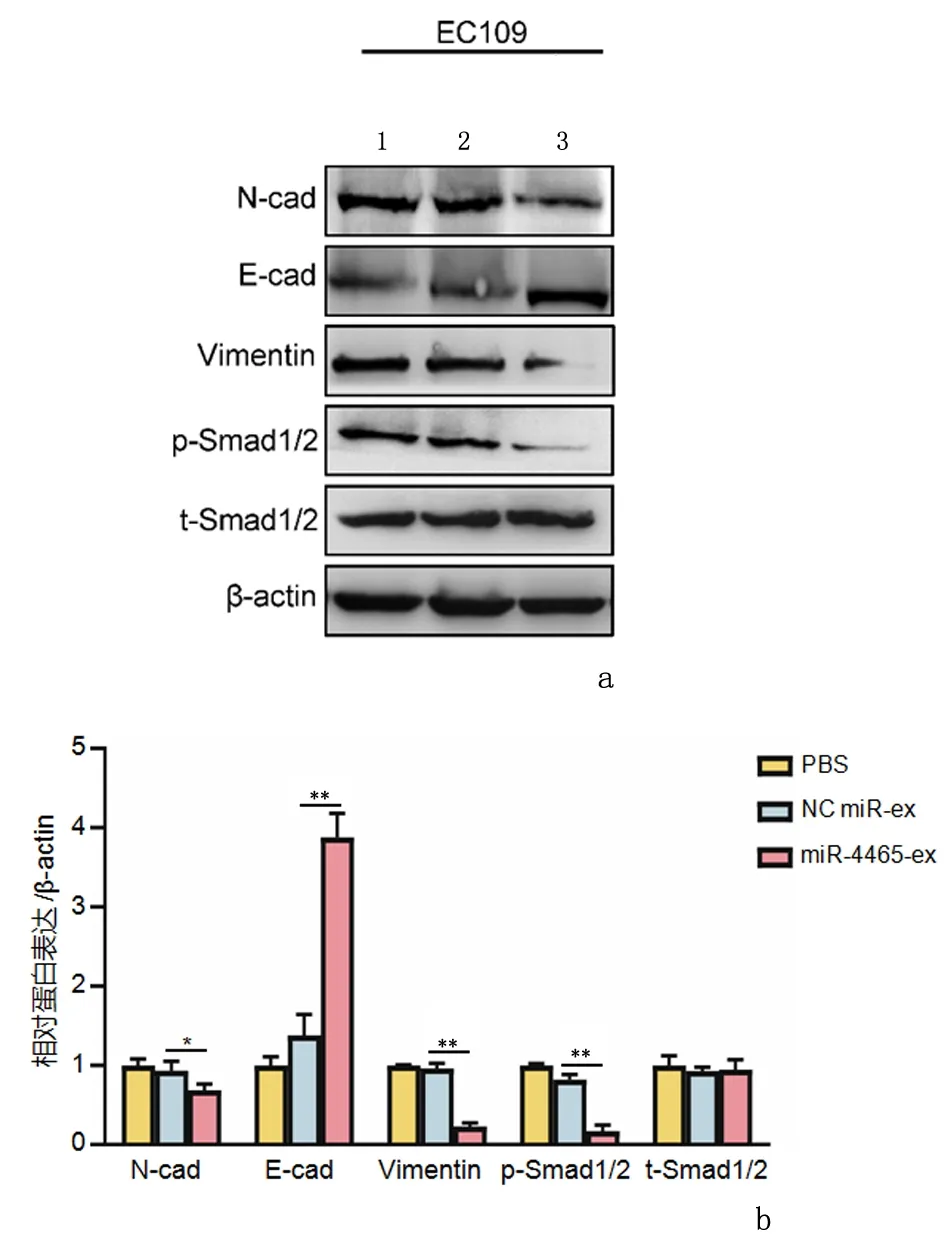
1:PBS; 2:NC miR-ex; 3:miR-4465-exa:蛋白表达;b: 蛋白表达相对定量与NC miR-ex组比较,*P<0.05、**P<0.01图 6 免疫印迹法检测EC109细胞上皮-间质化相关蛋白表达Figure 6 Expression of epithelial-mesenchymal transition related proteins in EC109 was detected by Western blot
3 讨 论
食管癌等恶性肿瘤是危害人类健康的主要疾病之一。随着外科手术及临床放化疗等常规治疗技术的进展,恶性肿瘤患者的生存率得到了显著提高,然而肿瘤细胞的远端转移及耐药性限制了恶性肿瘤的临床疗效[16-17]。寻找和建立新型抗肿瘤疗法对于食管癌的治疗具有重要意义。研究表明,不同MSC来源的外泌体(MSC-ex)具有不同的生物学潜能。MSC-ex在肿瘤发生发展过程中既可以促进,也可以抑制肿瘤的发展[18-19]。如骨髓MSC-ex能够激活Hedgehog信号通路促进胃癌细胞和骨肉瘤细胞增殖[20],也能够转运circ_0030167靶向Wif1/Wnt8/β-catenin信号通路抑制胰腺癌细胞的侵袭、迁移、增殖和干性[21]。脂肪MSC-ex能够转运miRNA-145促进肿瘤细胞凋亡抑制前列腺癌的生长[22]。脐带MSC-ex能够抑制乳腺癌和肝癌细胞的增殖[23-24]。与骨髓和羊膜来源的MSC-ex相比,脐带MSC-ex具有显著不同的免疫调节功能[25]。然而,脐带MSC-ex在食管癌细胞生长转移中的作用尚不十分清楚。本研究采用外泌体提取试剂盒提取获得MSC-ex,结果显示提取的MSC-ex直径为 30~150 nm,且观察到外泌体的膜蛋白 CD9和CD81表达,提示成功提取获得MSC-ex。免疫荧光实验提示,EC109细胞与MSC-ex共同孵育6h后CD9阳性的MSC-ex定位于EC109细胞的细胞质及核周围,表明MSC-ex可被EC109摄取。
近年来研究发现,miR-4465在肿瘤调控过程中具有重要的作用,miR-4465在宫颈癌、结肠癌、乳腺癌、肝癌等肿瘤中表达下调[12-15]。如在宫颈癌中,miR-4465可能通过下调KPNA2的表达从而抑制宫颈癌细胞的增殖、迁移及侵袭[12]。在结肠癌中,miR-4465靶向下调EZH2、HMGA1、HMGA2的表达,促进结肠癌细胞凋亡并抑制癌细胞侵袭[13]。因此,miR-4465可能作为肿瘤靶向治疗的潜在靶点。我们的结果表明,miR-4465过表达能够抑制EC109细胞的上皮-间质化转变及其迁移、侵袭。与之前的报道一致,在食管癌细胞中miR-4465是一个抑癌miRNA。
MSC-ex不仅可通过其携带的来源细胞的活性分子发挥生物学作用,而且可作为载体递送小分子化学药物、核酸和蛋白质等多种药物靶向到达肿瘤部位[6,26-28]。MSC-ex装载药物的方式有多种,一种是对MSC进行修饰,获得药物修饰的MSC-ex,如将小分子化学药物与MSC共培养,使细胞分泌出的MSC-ex内包含药物[26-27]。或通过细胞转染使MSC过表达基因药物,使MSC-ex携带药物[28-29]。另一种是直接将药物装入MSC-ex,如通过电穿孔技术将MSC-ex的磷脂膜结构击穿,从而将药物导入MSC-ex。本研究采用电穿孔法将miR-4465导入了MSC-ex,与未经修饰的MSC-ex相比,miR-4465修饰MSC-ex及其作用的EC109细胞中miR-4465的表达增加。细胞迁移和侵袭实验表明,miR-4465修饰能够增强MSC-ex抑制EC109细胞迁移及侵袭的能力。NC miR-ex作用后EC109细胞的迁移和侵袭没有显著变化。这些结果表明MSC-ex体外对于EC109细胞的迁移和侵袭没有显著的作用。MSC-ex可作为miR-4465的载体,抑制食管癌细胞的迁移及侵袭。
综上所述,脐带MSC-ex能够作为载体携带的高水平miR-4465,抑制食管癌癌细胞的迁移和侵袭。脐带MSC-ex携带 miR-4465可能为食管癌的治疗策略提供新思路。但本实验为体外研究结果,下一步我们将在动物模型和临床标本中检测miR-4465表达,探讨miR-4465修饰MSC-ex抑制食管癌细胞迁移和侵袭的作用和机制,以期为食管癌的临床治疗提供实验数据。
