PLR、D-二聚体和CA125在上皮性卵巢癌诊断及预后评估中的价值*
2022-01-05蔡针针潘世扬
蔡针针,周 军,任 真,潘世扬
南京医科大学第一附属医院检验学部,江苏南京 210029
在妇科恶性肿瘤中,卵巢癌的发病率位列第三位,并且恶性程度高,预后差[1-2]。美国癌症协会统计结果提示,在妇科恶性肿瘤中,卵巢癌致死率最高,占女性癌症死亡总数的 5%,与卵巢癌早期患者相比,卵巢癌晚期患者预后更差,5年生存率低于30%[3]。有研究显示,我国卵巢癌患者的年死亡人数约为5.2 万人,占全球卵巢癌死亡人数的 42%[4]。卵巢癌以上皮性卵巢癌最多见,占90%[5]。因为卵巢位于盆腔深部且体积偏小等原因,卵巢癌具有发病隐匿、发病初期缺乏明显的临床症状及体征等特点,而这些特点使大多数卵巢癌患者来院就诊时已处于疾病中、晚期,患者生命安全受到了严重威胁[6-7]。糖类抗原(CA)125是目前临床上常用的卵巢癌筛查血清标志物。有研究表明,慢性炎性反应会促进肿瘤的发生、发展及迁移[8-10]。近年来,炎性反应指标对恶性肿瘤的预测价值是研究的热点,如血小板计数/淋巴细胞计数(PLR)。D-二聚体(D-D)一直是癌症相关研究的重点关注指标[11]。本研究通过回顾性分析上皮性卵巢癌患者术前PLR、D-D和CA125水平,综合评价3项指标在上皮性卵巢癌诊断及预后评估中的价值。
1 资料与方法
1.1一般资料 回顾性分析2015年1月至2020年12月本院收治的136例上皮性卵巢癌患者(上皮性卵巢癌组)、126例卵巢良性肿瘤患者(卵巢良性肿瘤组)的资料。纳入标准:(1)年龄≥18岁;(2)临床病理资料齐全;(3)初诊患者,未接受过治疗;(4)病理学检查和临床确诊。排除标准:(1)合并其他肿瘤;(2)伴有出血、凝血性疾病,严重器质性疾病或感染;(3)临床病理资料不全。本研究经本院医学伦理委员会批准。
1.2方法
1.2.1检测指标 采集患者空腹状态下静脉血2 mL 于乙二胺四乙酸(EDTA)抗凝管中,充分混匀,采用 Sysmex XN-10全自动血液分析仪及配套试剂(日本Sysmex 公司)进行外周血全血细胞计数,并计算 PLR。采集静脉血 2.7 mL于 3.2% 的枸橼酸钠抗凝管中,1 500×g 离心15 min,分离血浆,采用Sysmex CS 5100全自动血凝分析仪及配套试剂(日本 Sysmex 公司)检测血浆纤维蛋白原(FIB)等凝血指标。采集静脉血3.5 mL于含分离胶的真空采血管中,1 200×g 离心10 min,分离血清,采用Beckman Coulter AU5800全自动生化分析仪及配套试剂(美国Beckman Coulter公司)检测血清三酰甘油(TG)、总胆固醇(TC)及清蛋白(ALB)。采集静脉血3.5 mL于含分离胶的真空采血管中,1 200×g 离心 10 min,分离血清,采用Cobas e602电化学发光免疫分析仪及配套试剂(瑞士Roche 公司)检测血清CA125。所有检测项目每年参加国家卫生健康委员会临床检验中心室间质评,成绩均合格,且当日室内质控均在控。
1.2.2收集资料 收集所有患者人口统计学特征和临床病理学特征资料。人口统计学特征包括患者年龄和是否绝经。临床病理学特征包括有无腹水、有无淋巴结转移等。
1.2.3随访方法 利用入院复查或电话联系等形式对上皮性卵巢癌患者进行随访,首次随访时间为术后1个月,之后每隔3个月随访一次;随访内容包括肿瘤标志物检测和影像学检查等,随访截止日期为2021年3月31日。随访终点事件为患者术后肿瘤复发、转移或因癌症及相关原因死亡。随访结束时,患者未发生终点事件,定义为预后良好;随访结束时,患者出现终点事件,定义为预后不良。失访定义为中途退出研究,或死于其他与研究无关的原因。
1.3统计学处理 采用SPSS21.0统计软件和R3.6.3软件进行数据处理及统计分析。计量资料经正态性检验,不符合正态分布的计量资料以M(P25,P75)表示,采用Mann-WhitneyU检验进行比较。对单因素分析中差异有统计学意义的变量进行多因素Logistic回归分析。采用受试者工作特征(ROC)曲线下面积(AUC)判定PLR、D-D和CA125 单独检测和联合检测诊断上皮性卵巢癌的效能。生存分析采用 Kaplan-Meier法,利用Log-rank检验比较组间生存率,各项指标在生存分析中的最佳界值(cut off值)采用“survminer”程序包分析。以P<0.05为差异有统计学意义。
2 结 果
2.1两组患者各项指标比较 上皮性卵巢癌组与卵巢良性疾病组的年龄、白细胞计数(WBC)、淋巴细胞计数(Lym#)、中性粒细胞计数(Neu#)、单核细胞计数(Mon#)、血小板计数(PLT)、PLR、血红蛋白(Hb)、TG、ALB、凝血酶原时间(PT)、凝血酶时间(TT)、FIB、D-D、CA125水平比较,差异均有统计学意义(P<0.05),见表1。
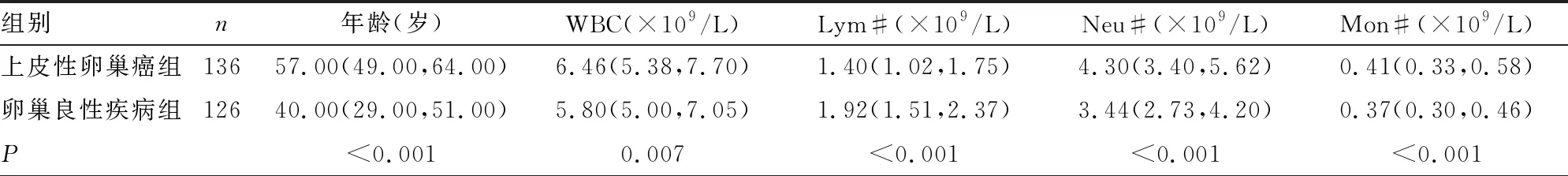
表1 两组患者各项指标比较[M(P25,P75)]
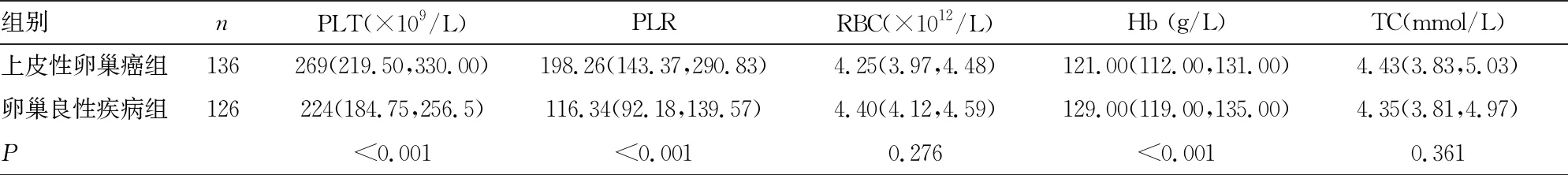
组别nPLT(×109/L)PLRRBC(×1012/L)Hb (g/L)TC(mmol/L)上皮性卵巢癌组136269(219.50,330.00)198.26(143.37,290.83)4.25(3.97,4.48)121.00(112.00,131.00)4.43(3.83,5.03)卵巢良性疾病组126224(184.75,256.5)116.34(92.18,139.57)4.40(4.12,4.59)129.00(119.00,135.00)4.35(3.81,4.97)P<0.001<0.0010.276<0.0010.361

组别nTG(mmol/L)ALB (g/L)PT (s)APTT (s)上皮性卵巢癌组1361.31(0.95,1.66)37.90(33.93,40.60)11.60(11.10,12.20)26.80(25.10,28.80)卵巢良性疾病组1260.93(0.67,1.32)40.00(37.70,42.80)11.10(10.70,11.70)27.50(26.00,29.43)P<0.001<0.0010.0080.100

组别nTT (s)FIB (g/L)D-D (mg/L)CA125(U/mL)上皮性卵巢癌组13617.20(16.50,18.00)3.24(2.68,4.41)2.09(0.94,3.19)461.35(105.30,1 447.50)卵巢良性疾病组12617.95(17.58,18.60)2.39(2.10,2.81)0.24(0.16,0.34)19.40(12.88,41.25)P<0.001<0.001<0.001<0.001
2.2多因素Logistic回归分析发生上皮性卵巢癌的危险因素 将单因素分析差异有统计学意义的指标纳入多因素Logistic回归分析。结果显示:患者年龄大,以及PLR、D-D、CA125升高均为上皮性卵巢癌发生的独立危险因素(P<0.05),见表2。
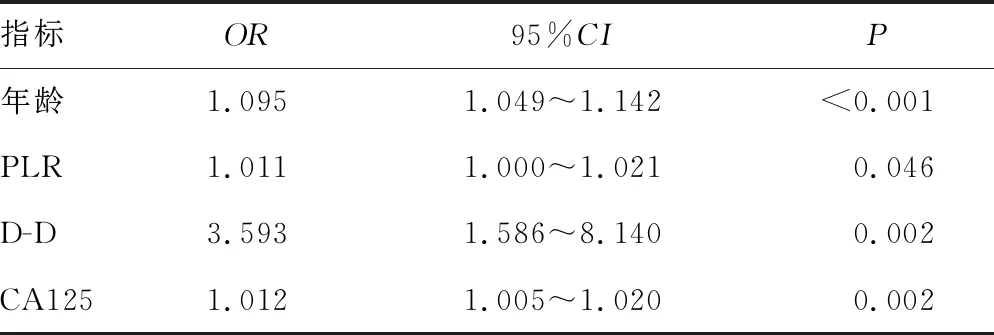
表2 多因素Logistic回归分析发生上皮性卵巢癌的危险因素
2.3PLR、D-D和CA125诊断上皮性卵巢癌的效能 绘制PLR、D-D和CA125单独和联合检测诊断上皮性卵巢癌的ROC曲线,结果显示:单独检测时,CA125诊断上皮性卵巢癌的效能最高,AUC为0.923,灵敏度和特异度分别为84.56%和88.10%,而后依次为D-D和PLR;两两联合检测时,D-D和CA125联合检测的AUC最大,为0.947,灵敏度和特异度分别为83.09%和96.83%;而3项指标联合检测的AUC最大,为0.955,灵敏度和特异度分别为86.03%和96.03%。见表3。
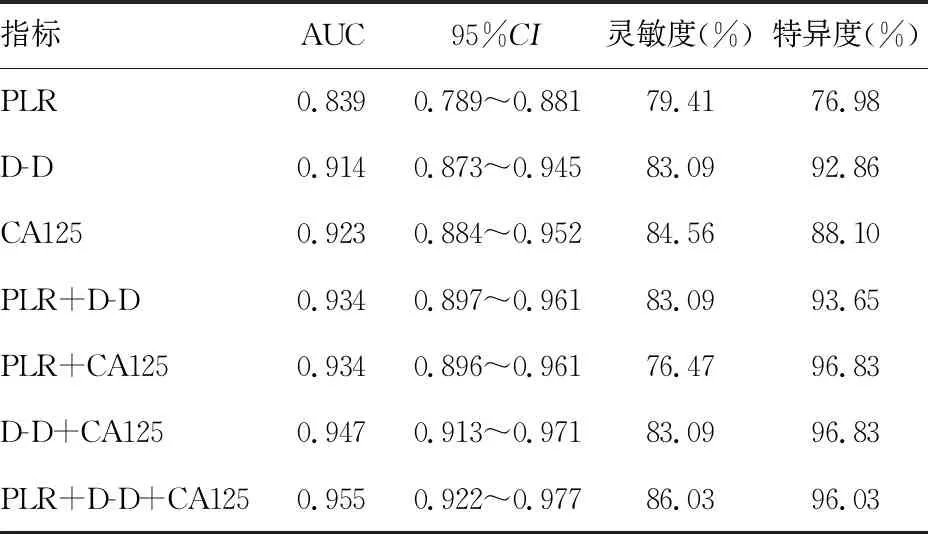
表3 3项目指标单独和联合检测诊断上皮性卵巢癌的效能比较
2.4不同特征上皮性卵巢癌患者PLR、D-D和CA125水平比较 不同年龄、绝经状态的患者PLR、D-D和CA125水平比较,差异均无统计学意义(P>0.05);肿瘤分期Ⅲ~Ⅳ期患者PLR、D-D和CA125水平明显高于肿瘤分期Ⅰ~Ⅱ期患者,差异有统计学意义(P<0.05)。腹水<1 000 mL的患者PLR水平明显低于腹水≥1 000 mL的患者,差异有统计学意义(P<0.05)。有淋巴结转移的患者PLR、D-D和CA125水平明显高于无淋巴结转移的患者,差异有统计学意义(P<0.05)。见表4。
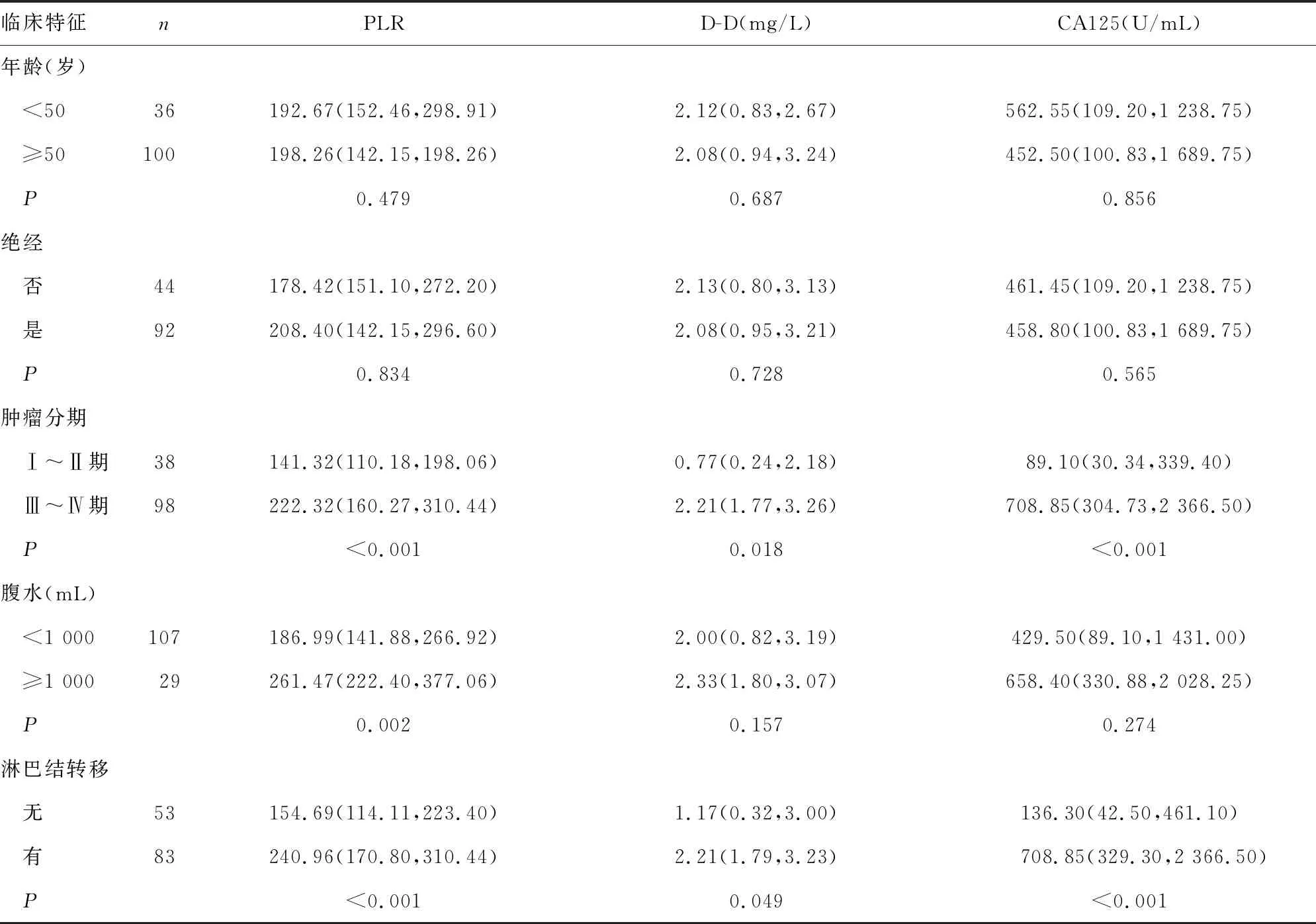
表4 不同特征上皮性卵巢癌患者PLR、D-D和CA125水平比较[M(P25,P75)]
2.5不同PLR、D-D和CA125水平患者预后比较 随访结果显示,136例患者中,44例失访,共92例患者纳入生存分析,其中34例预后良好,58例预后不良(肿瘤复发33例,转移16例,死亡9例)。92例患者PLR、D-D和CA125的cut-off值分别为189.73、1.52 mg/L、583.20 U/mL。以此cut-off值将患者分为高PLR亚组(>189.73)和低PLR亚组(≤189.73)、高D-D亚组(>1.52 mg/L)和低D-D亚组(≤1.52 mg/L)、高CA125亚组(>583.20 U/mL)和低CA125亚组(≤583.20 U/mL)以分析各亚组预后情况。生存曲线分析结果显示,低PLR亚组的生存时间长于高PLR亚组(Z=4.154,P<0.001);低 D-D亚组的生存时间长于高D-D亚组(Z=3.29,P=0.001);低CA125亚组的生存时间长于高CA125亚组(Z=3.41,P<0.001)。见图1。
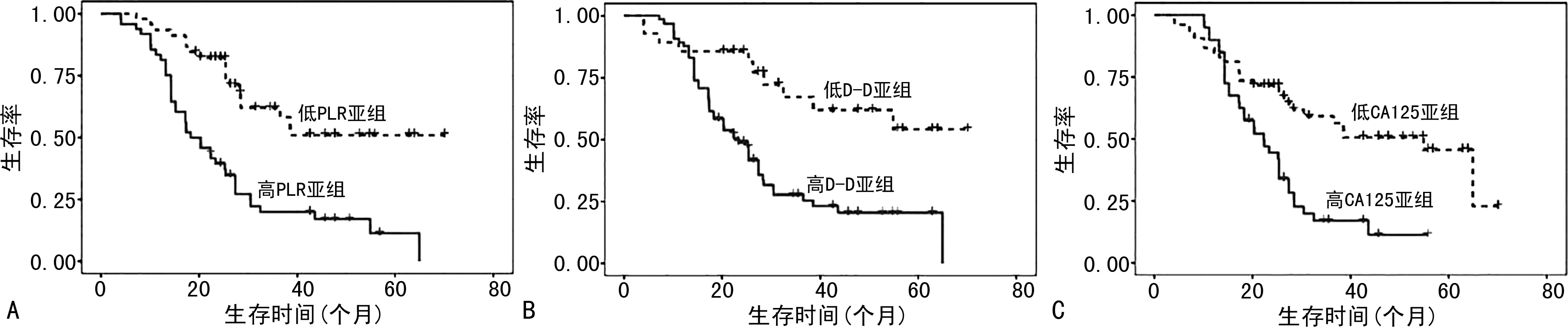
注:A为不同PLR水平患者生存曲线分析;B为不同D-D水平患者生存曲线分析;C为不同CA125水平患者生存曲线分析。
3 讨 论
卵巢癌属于女性常见的恶性肿瘤,发病率和病死率均很高,尤其是晚期患者生存率低且生活质量差。卵巢癌的临床症状无特异性,主要包括盆腔疼痛、腹胀、尿频、尿急、进食困难、饱腹感等。影像学检查和血清肿瘤标志物检测是辅助诊断卵巢癌的重要手段,但其确诊尚需病理组织学证据。尽管对多种肿瘤标志物单独或联合检测,以及超声检查等用于卵巢癌的筛查进行了很多探索,但目前尚无有效的筛查手段。有研究显示,Ⅲ~Ⅳ期上皮性卵巢癌患者5年生存率仅为15%~45%[12]。因此,为有效改善卵巢癌患者预后,提高患者生存质量,对卵巢癌患者的早期诊断尤为重要。
近年来,炎性反应指标对恶性肿瘤的预测价值是研究的热点[13-14],如PLR。肿瘤患者常伴有凝血-纤溶系统的异常[15]。CA125是目前筛查卵巢癌的常用指标,有研究表明80%的晚期卵巢癌患者伴有CA125升高,50%~60%的早期卵巢癌患者伴有CA125升高,且乳腺癌、肺癌等其他恶性肿瘤患者,以及子宫内膜异位症、妊娠期、月经期女性 CA125水平也会升高[16]。CA125诊断肿瘤特异性较差,单靠 CA125诊断卵巢癌存在局限性。本研究通过分析上皮性卵巢癌患者术前血常规、凝血指标和CA125水平,综合评价PLR、D-D和CA125在上皮性卵巢癌诊断及预后中的价值。
本研究结果显示,与卵巢良性肿瘤患者相比,上皮性卵巢癌患者PLR、D-D和CA125水平均明显升高,提示这3项指标对诊断上皮性卵巢肿瘤有一定价值。而且当PLR、D-D和CA125联合检测时,AUC最大(AUC=0.955),灵敏度和特异度分别为86.03%和96.03%,诊断效能优于CA125。生存曲线分析结果显示,高水平PLR、D-D和CA125患者的生存时间短于低水平PLR、D-D和CA125患者,提示较高的PLR、D-D和CA125水平预示上皮性卵巢癌患者可能预后不良。已有研究表明,在卵巢癌患者中可见PLT升高,并且PLT水平与卵巢癌患者的生存率相关[17],血小板通过多种途径与卵巢癌细胞相互作用,促进卵巢癌细胞的扩散和转移,导致疾病的恶化。此外,血液中淋巴细胞的下降也被确定为影响多种癌症预后的独立危险因素[18],其可能导致机体免疫防御功能低下,从而降低癌症患者的存活率。RAUNGKAEWMANEE等[19]研究表明PLR≥200的患者5年无进展生存期和5年总生存期明显低于PLR<200的患者。另有研究对196例女性肿瘤患者(包括良恶性肿瘤)进行研究,发现卵巢癌患者D-D水平明显升高[20]。上述研究都与本研究的结果一致,因此,PLR、D-D联合CA125检测有助于提高对上皮性卵巢癌的诊断及预后评估。
综上所述,PLR、D-D和CA125联合检测可以作为上皮性卵巢癌诊断和预后评估的一种新方法,且操作简便,成本低,值得临床推广。
