续断离子液体提取物质量和药效学评价*
2022-01-05胡献跃黄东纬陈笑笑刁银军
胡献跃,黄东纬,陈笑笑,刁银军
(金华职业技术学院,浙江 金华 321016)
历代本草将续断列为强筋骨、续折伤良药,其有效成分续断皂苷可诱导大鼠骨髓间充质干细胞(BMSC)向成骨细胞分化和矿化[1],促进骨形成蛋白2(BMP-2)表达的同时,明显增高其下游关键磷酸化蛋白SMAD1/5/8,P38,ERK1/2 的表达量[2],还可明显上调成骨细胞护骨因子(OPG)/核因子-κB(NF-κB)受体激活蛋白配体(RANKL)的表达,通过调节成骨细胞的分泌因子而调节破骨细胞的活化[3],广泛用于治疗骨质疏松症。续断提取工艺的不同会影响提取物的质量和药效,本研究中采用高氯酸显色法、液相色谱-质谱(LC-MS)法和体外释放法测定,评价了续断离子液体提取物与上市对照药材间的质量差异;通过MC3T3-E1 细胞生长和碱性磷酸酶(ALP)活力测定,评价了续断离子液体提取物对成骨细胞的作用;通过测定对破骨细胞RAW264.7 生长和抗酒石酸酸性磷酸酶(StrACP)活力的抑制作用,评价了续断离子液体提取物对破骨细胞的影响。现报道如下。
1 仪器、试药与细胞
1.1 仪器
KQ-500DA 型超声波清洗器(昆山市超声仪器有限公司);LC-MS8045 型液质联用仪(日本岛津公司),配有UV2600 型紫外分光光度计;3111 型CO2水套培养箱(美国热电公司);Micro Beta 2450 型液体闪烁计数仪,D961962 型细胞收集仪(Perkin Elmer 公司),细胞收集器为FilterMate Harvester;HR40-Ⅱ-A2 型医用净化工作台(青岛海尔特种电器有限公司);5810R 型低温离心机(德国Eppendorf 公司);BS210S 型电子天平(德国Sartorius 公司,精度为0.1 mg);CK40-F200 型倒置显微镜(日本Olympus 公司);YXQ-208SD 型电热蒸汽灭菌器(嘉兴市中新医疗仪器有限公司);RCZ-6C3 型智能溶出仪(天津天大公司)。
1.2 试药
离子液体提取物(自制,批号分别为20200630,20200702,20200705,分别含川续断皂苷Ⅵ68.43%,69.21%,68.72%);续断壮骨胶囊(浙江迪耳药业有限公司,批号为20191004,每粒含续断皂苷提取物0.28 g);α-MEM 培养液(批号为2005060303),磷酸盐缓冲液(PBS,批号为2005080101),0.25%胰蛋白酶(批号为2004240202),均购自浙江森瑞生物科技有限公司;超级胎牛血清(杭州四季青生物工程材料有限公司,批号为19110501);二甲基亚砜(DMSO,成都市科龙化工试剂厂,分析纯);氚-胸腺嘧啶核苷(3H-TdR,中国同辐股份有限公司,产品编号为NET027L,批号为201807,浓度为1 mci/mL,活度为37 Mbq);ALP 测试盒(货号为A059-1-1,批号为20200724),StrACP 测试盒(货号为A058-1-1,批号为20200803),均购自南京建成生物工程研究所;小鼠重组可溶性NF-κB 受体活化因子配体(sRANKL,美国Peprotech 公司,货号为315-11C,批号为0815612-A2518);1-丁基-3-甲基咪唑四氟硼酸盐([Emim]BF4,中科院兰州化学物理研究所,批号为CP0082216,含量≥99%),异绿原酸A 对照品(批号为DST190918-036),异绿原酸B对照品(批号为DST191008-037),异绿原酸C对照品(批号为DST190904-038),马钱苷酸对照品(批号为DST191025-033),绿原酸对照品(批号为DST190906),咖啡酸对照品(批号为DST191030-013),马钱苷对照品(批号为DST200628-038),川续断皂苷乙对照品(批号为DST191202-56),川续断皂苷Ⅵ对照品(批号为DST191126-041),均购自成都德思特生物技术有限公司,含量均高于98.0%。
1.3 细胞
小鼠单核细胞RAW264.7 细胞株(破骨细胞),MC3T3-E1 细胞株(成骨细胞),均由中国科学院干细胞库提供。
2 方法与结果
2.1 续断总皂苷提取物制备
取续断药材100 g,粉碎,过10 目筛,加入0.90 mol/L的[Emim]BF41 000 mL,超声(功率为500 W,频率为40 kHz,下同)提取60 min,滤过,取提取液,置旋转蒸发仪中浓缩至200 mL,加入大孔树脂柱中,用1 个柱体积的水洗至近无色,用3 个柱体积的20%乙醇洗至淡黄色,用60%乙醇洗至近无色,60%乙醇洗脱液旋转蒸发(80 ℃,-0.08 MPa)近干,刮下沉淀物,真空干燥(60 ℃,-0.08 MPa),得续断总皂苷提取物[4-5]。
2.2 续断总皂苷提取物质量分析
2.2.1 续断总皂苷含量测定
线性关系考察:取川续断皂苷Ⅵ对照品适量,精密称定,加甲醇制成质量浓度为0.5 mg/mL 的溶液。精密量取上述溶液0.2,0.4,0.6,0.8,1.0 mL,分别置10 mL具塞试管中,于65 ℃水浴氮气流吹干甲醇,精密加入高氯酸5 mL,涡旋混合1 min,65 ℃水浴加热20 min,冰浴放冷。于406 nm 波长处测定吸光度,以吸光度(Y)为纵坐标、溶液质量浓度(X,mg/mL)为横坐标进行线性回归,得回归方程Y =9.015X+0.0035(r =0.999 1,n =5)。结果表明,续断总皂苷质量浓度在0.02~0.10 mg/mL 范围内与吸光度线性关系良好。
含量测定:取样品0.1 g,精密称定,置50 mL 容量瓶中,加甲醇适量,超声处理30 min,放冷,加甲醇稀释并定容,摇匀,过滤。精密量取续滤液3 mL,置10 mL 容量瓶中,加甲醇稀释并定容,摇匀,精密量0.4 mL,置10 mL具塞试管中,按线性关系考察项下方法处理,计算总皂苷的含量。结果见表1。
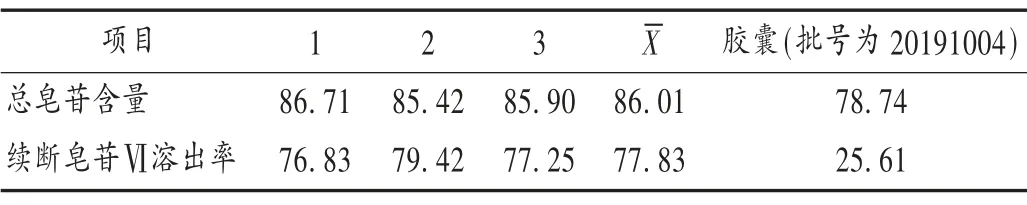
表1 样品中总皂苷含量和川续断皂苷Ⅵ溶出率测定结果(%)Tab.1 The content of total saponins and the dissolution rate of asperosaponin Ⅵin the samples(%)
可见,续断离子液体提取物中总皂苷含量高于续断壮骨胶囊,这可能是由于大孔树脂柱层析不仅除去了离子液体成分,还利用了各成分的极性差异,将多糖等在水和低浓度乙醇中溶解度较高的成分先行洗脱,而皂苷类成分主要集中于60 %乙醇洗脱液中,从而使皂苷类成分得到纯化。
2.2.2 体外溶出度测定
漏槽试验:取续断壮骨胶囊2 粒,置50 mL 容量瓶中,加水适量,超声30 min,溶解,定容,滤过,测得漏槽中溶剂的质量浓度为0.226 mg/mL。
体外溶出度试验:取样品,照浆法测定体外溶出度。以1 000 mL 水为溶出介质,100 r/min 旋转60 min,取溶液10 mL,滤过,取续滤液,作为供试品溶液。另取川续断皂苷Ⅵ对照品20 mg,加20 %甲醇溶解,定容至100 mL,即得质量浓度为0.2 mg/mL 的对照品溶液。于215 nm 波长处测定吸光度,按外标法计算含量。结果见表1。可见,续断壮骨胶囊中川续断皂苷Ⅵ的溶出率低于续断离子液体提取样品,这是因为其多糖成分含量较高,在水中迅速糊化,抑制水进一步渗透,使川续断皂苷Ⅵ不能释放,造成溶出率较低。
2.2.3 样品中9 种成分含量测定
色谱条件:岛津C18柱(150 mm×2.1 mm,3 μm);流动相:流动相A 为乙腈-甲醇溶液(6 ∶4,V/ V),流动相B 为0.2%甲酸-水溶液(梯度洗脱程序见表2);流速:0.4 mL/min;柱温:40 ℃;进样量:10 μL。
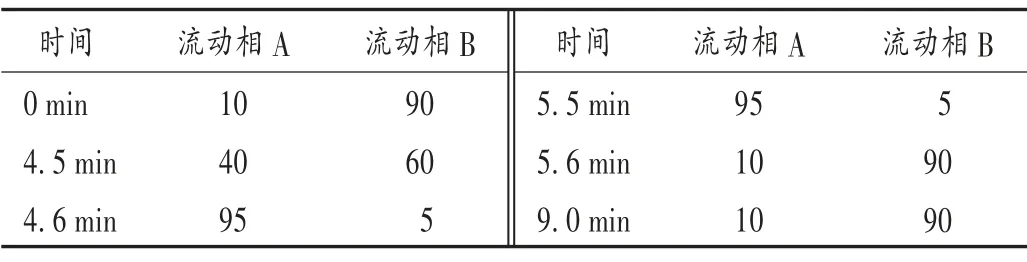
表2 流动相梯度洗脱程序(%)Tab.2 Gradient elution program of mobile phase(%)
质谱条件:电喷雾离子源,负离子模式,多反应监测(MRM),雾化气、干燥气、加热气均为高纯氮,流量分别为3,10,10L/min;接口温度:300℃;加热块温度:400℃。通过一级质谱全扫描确定前体离子,根据前体离子进行二级质谱碎裂,确定相应的定性和定量离子,建立离子对,创建MRM 方法。离子对选择及碰撞电压条件参数见表3。
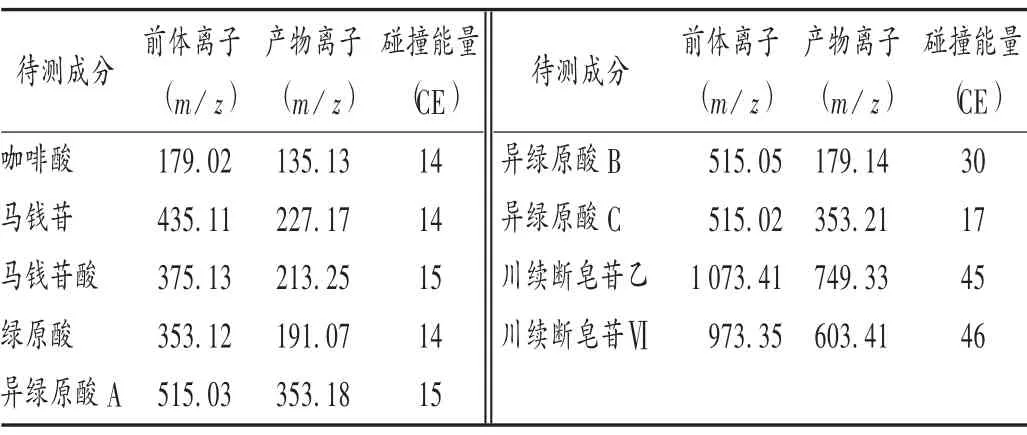
表3 质谱条件参数Tab.3 Parameters of mass spectrum conditions
线性关系考察:分别取异绿原酸A,B,C 及马钱苷酸、咖啡酸、马钱苷、绿原酸、川续断皂苷乙、川续断皂苷Ⅵ9 种对照品各适量,用20% 甲醇配制成质量浓度为0.1 mg/mL 的对照品贮备液。分别取上述对照品贮备溶液各适量,加入20%甲醇稀释成质量浓度为0.5,1.0,2.0,4.0,6.0μg/mL 的各适量系列单一对照品溶液,按上述色谱/质谱条件进样测定。以峰面积(Y)为纵坐标、对照品溶液质量浓度(X,μg/mL)为横坐标进行线性回归。结果见表4。表明各对照品溶液质量浓度在0.5~6.0 μg/mL范围内与峰面积线性关系良好。

表4 线性关系考察结果(n =5)Tab.4 Results of the linear relation test(n =5)
样品含量测定:取续断离子液体提取物(批号为20200630)和续断壮骨胶囊(批号为20191004)各20 mg,精密称定,加20%甲醇适量,置100 mL 容量瓶中,超声溶解,加20 %甲醇定容,取1 mL,用20%甲醇稀释至50 mL,按色谱/质谱条件进样测定。结果见表5。可见,续断离子液体提取物中有效成分川续断皂苷Ⅵ较续断壮骨胶囊高13.83%。

表5 样品中9 种成分含量测定结果(mg/g)Tab.5 Results of content determination of nine components in the sample(mg/g)
2.3 药效学试验
对MC3T3-E1 及RAW264.7 细胞生长的影响:取对数生长期小鼠单核细胞RAW264.7 细胞株及MC3T3-E1 细胞株,分别制成5×104mL-1单细胞悬液,分别取100 μL 加入96 孔平底培养板中,37 ℃及5%CO2条件下培养24 h 后分别加入含不同质量浓度的续断离子液体提取物/续断壮骨胶囊(1.56~200.00 μg/mL)培养液100 μL,每个浓度做3 个复孔,空白对照组加入相同体积的DMSO,继续培养48 h 后分别加入含0.3 μci3H-TdR 的培养液50 μL,继续培养16 h,收集细胞,测定每个样品的脉冲数,用三孔的平均脉冲数评估各浓度样品对破骨细胞RAW264.7 及成骨细胞MC3T3-E1 生长的影响。结果见表6 和表7。与空白对照组(0 μg/mL)比较,质量浓度为6.25~100.00 μg/mL 的续断离子液体提取物可显著促进MC3T3-E1 细胞生长,且呈量效依赖关系(P <0.05),但高浓度(200 μg/mL)时促进作用不明显,提示高浓度的续断皂苷可能存在一定细胞毒性作用。显微镜下可见MC3T3-E1 细胞呈多角形,贴壁生长,几乎无脱落,胞质饱满,相邻细胞生长融合成片,药物作用后的细胞数量明显多于空白对照组,且续断离子液体提取物的作用明显优于续断壮骨胶囊。由表7 和图2 可见,与空白对照组(0 μg / mL)比较,质量浓度为12.50~200.00 μg / mL 的续断离子液体提取物可显著抑制RAW264.7 细胞生长,且呈量效依赖关系(P <0.05)。显微镜下可见RAW264.7 细胞呈多变形,贴壁生长,部分细胞脱落,药物作用后的细胞数明显少于空白对照组,且续断离子液体提取物对RAW264.7细胞的抑制作用优于续断壮骨胶囊。
表6 续断皂苷对成骨细胞MC3T3 -E1 生长的影响(± s,cpm,n =3)Tab.6 Effect of asperosaponin Ⅵon the growth of osteroblasts MC3T3 -E1 cells(± s,cpm,n =3)

表6 续断皂苷对成骨细胞MC3T3 -E1 生长的影响(± s,cpm,n =3)Tab.6 Effect of asperosaponin Ⅵon the growth of osteroblasts MC3T3 -E1 cells(± s,cpm,n =3)
注:与0 μg/mL 比较,*P <0.05,**P <0.01,***P <0.001。表7 至表9 同。Note:Compared with 0 μg/mL,*P <0.05,**P <0.01,***P <0.001,as well as Tab.7 to Tab.9.
表7 续断皂苷对破骨细胞RAW264.7 生长的影响(± s,cpm,n =3)Tab.7 Effect of asperosaponin Ⅵon the growth of osteoclasts RAW264.7 cells(± s,cpm,n =3)

表7 续断皂苷对破骨细胞RAW264.7 生长的影响(± s,cpm,n =3)Tab.7 Effect of asperosaponin Ⅵon the growth of osteoclasts RAW264.7 cells(± s,cpm,n =3)
对成骨细胞MC3T3-E1 ALP 活性的影响:取对数生长期的成骨细胞MC3T3-E1 细胞株,胰酶消化后吹打成单个细胞悬液,配成浓度为5×104mL-1的细胞,接种于24 孔板中,每孔1 mL,设2 个复孔,置37 ℃及5 %CO2培养箱中培养24 h 后分别加入含不同质量浓度的续断离子液体提取物/续断壮骨胶囊培养液(6.25~200.00 μg/mL),置37 ℃及5 %CO2培养箱中,继续培养48 h,吸去上清液,PBS 洗涤2 次,每孔加入400 μL 0.1% Triton X-100 以裂解细胞,冰浴10 min。取上清液,用BCA 试剂盒测定裂解液中的蛋白质浓度,按试剂盒操作方法测定ALP 的活性。结果见表8。可见,与空白对照组比较,不同质量浓度的续断离子液体提取物及续断壮骨胶囊均可提高MC3T3-E1 细胞ALP 的活性,但差异不显著(P >0.05)。
表8 续断皂苷对成骨细胞MC3T3 -E1 ALP 的影响(± s,U/gprot,n =3)Tab.8 Effect of asperosaponin Ⅵon the activity of ALP in osteoblast MC3T3 -E1 cells(± s,U/gprot,n =3)

表8 续断皂苷对成骨细胞MC3T3 -E1 ALP 的影响(± s,U/gprot,n =3)Tab.8 Effect of asperosaponin Ⅵon the activity of ALP in osteoblast MC3T3 -E1 cells(± s,U/gprot,n =3)
对破骨细胞RAW264.7 StrACP 活性的影响:取对数生长期的破骨细胞RAW264.7 细胞株,胰酶消化后吹打成单个细胞悬液,制成5×104mL-1细胞悬液,接种于24 孔板中,每孔1 mL,设2 个复孔,置37 ℃及5 %CO2培养箱中培养24 h,RANKL 对照组每孔加入50 μL无血清培养基配制的RANKL 和100 μL 无血清培养基,试验组每孔加入以无血清培养基配制的RANKL 50 μL和不同浓度的续断离子液体提取物/ 续断壮骨胶囊(终浓度6.25~200.00 μg/mL),RANKL 的终浓度为100 ng/mL。置37 ℃及5%CO2培养箱中,继续培养48h,吸去上清液,PBS 洗涤2 次,每孔加入400μL1%TritonX-100 以裂解细胞,冰浴10 min。取上清液,用BCA 试剂盒测定裂解液中的蛋白质浓度,按StrACP 试剂盒操作方法测定StrACP 的活性。结果见表9。可见,与0 μg/mL比较,质量浓度为12.5~200.0 μg/mL 的续断离子液体提取物可显著抑制RAW264.7 细胞StrACP 酶的活性(P <0.05)。
表9 续断皂苷对破骨细胞RAW264.7 StrACP 活性的影响(± s,U/gprot,n =3)Tab.9 Effect of asperosaponin Ⅵon the activity of StrACP in osteoclasts RAW264.7 cells(± s,U/gprot,n =3)

表9 续断皂苷对破骨细胞RAW264.7 StrACP 活性的影响(± s,U/gprot,n =3)Tab.9 Effect of asperosaponin Ⅵon the activity of StrACP in osteoclasts RAW264.7 cells(± s,U/gprot,n =3)
3 讨论
骨质疏松症的发病机制为成骨细胞和破骨细胞失衡,造成骨的形成低于骨的吸收[6-7]。续断提取物中主要成分川续断皂苷Ⅵ可通过促进BMP-2 的生成,调节c-Jun 的磷酸化,激活c-Jun 氨基端激酶(JNK)信号通路,诱导BMSC 向成骨细胞分化,增加骨形成和生长,发挥治疗骨质疏松的作用[8]。且川续断皂苷Ⅵ能提高β 联蛋白(β-catenin)、Runx2 及骨钙素的表达,从而激活Wnt / β -catenin 信号通路,进而促进BMSC 的成骨分化[9]。因此,续断提取物可通过多种细胞通路促进成骨细胞的分化与增殖,发挥治疗骨质疏松的作用,但其对破骨细胞的抑制作用仍有待进一步研究[10]。
由表1 可知,续断离子液体提取物中总皂苷含量较续断壮骨胶囊高9.23%,川续断皂苷Ⅵ溶出率高203.90%,提示续断离子液体提取物较续断壮骨胶囊药效更强。由表6 至表9 可知,与空白对照组比较,续断离子液体提取物和续断壮骨胶囊质量浓度均在25~100 μg/mL 范围内可显著促进MC3T3-E1 细胞生长(P <0.01);当续断离子液体提取物的质量浓度为200 μg/mL 时,对MC3T3-E1 细胞的增殖作用反而不明显,预示存在一定的细胞毒性作用,临床使用时应注意给药剂量。但2 种提取物对MC3T3-E1 细胞ALP 活性的影响均不显著(P >0.05),这可能是由于ALP 是成骨细胞早期分化的标志物[1],而本研究中成骨细胞处于生长阶段,故指标变化不显著;2 种提取物质量浓度大于12.5 μg/mL时均可显著抑制RAW264.7 细胞生长,同时还抑制了骨吸收的标志性指标StrACP 的表达[11],提示2 种提取物均有抑制破骨细胞生长的作用。
综上所述,续断离子液体提取物质量优于续断壮骨胶囊,具有促进破骨细胞RAW264.7 生长和抑制成骨细胞MC3T3-E1 活性的双向作用。
