PR结构域蛋白5过表达对人急性髓系白血病细胞系U937迁移侵袭的影响及其机制
2022-01-05苏杰杨小静周雪
苏杰 杨小静 周雪
急性髓系白血病(AML)是造血干细胞恶性克隆引起的造血功能异常疾病,可浸润肝脏、脾脏、淋巴结等各个脏器[1-2]。目前治疗AML的方案主要为造血干细胞移植和药物治疗,但只对急性早幼粒细胞白血病有效,其余类型的AML均无明显疗效[3]。因此,寻找新治疗靶点和深入研究AML的发病分子学机制对提高AML疗效至关重要。PR结构域蛋白(PRDM)属于转录调节家族之一,主要参与细胞增殖凋亡、生长发育及代谢等过程,过表达PRDM5可促进AML细胞系U937的迁移和侵袭[4]。微小RNA(miRNA)是由19~24个核苷酸组成的非编码单链RNA,可与mRNA序列结合并诱导其降解,调控细胞增殖、凋亡、迁移和侵袭等过程[5]。在AML的发生发展过程中,PRDM5和miRNA的作用尚不清楚,且PRDM5对AML细胞系U937迁徙侵袭的分子学机制仍不明确。基于此,本研究采用脂质体转染对AML细胞系U937进行过表达或沉默PRDM5和miR-489-3p,探讨PRDM5和miR-489-3p对U937的影响、机制及与Wnt通路的相关性。
材料与方法
1.材料:AML细胞系U937购自中科院上海细胞库。FBS胎牛血清、MEM培养基和0.05%的胰蛋白酶(Thermofisher scientific lnc);LipofectamineTM2000(Merck lnc);Trizol试剂和BCA试剂(Thermofisher scientific lnc);0.25%甲紫溶液(索莱宝科技有限公司);侵袭迁移小室(Transwell小室,密理博科技有限公司);PrimeScriptTMRT试剂盒(Takara bio lnc);SYBR-Green qPCR Master Mix(北京康润诚业生物科技有限公司);RIPA缓冲液、SDS-PAGE和PVDF膜(上海碧云天生物技术有限公司);鼠抗人PRDM5、GSK3β、β-catenin和GAPDH单分子抗体(Cell signaling technology lnc);兔抗鼠二抗(Cell signaling technology lnc)。
2.方法
(1)骨髓样本收集:收集2018年~2019年我院收治的40例AML患者(AML组)和20例健康志愿者(正常组)骨髓样本,AML均通过骨髓细胞形态学、免疫学、细胞遗传学和分子生物学等方法检查确诊。本研究通过我院伦理委员会审批,所有受试者均签署知情同意书。
(2)细胞培养:U937细胞通过常规复苏后,采用含10% FBS的MEM培养液,于37 ℃恒温、5% CO2的培养箱培养。隔天传代1次,实验使用的细胞为对数生长期的细胞。
(3)细胞转染和分组:将对数生长期的细胞无血清培养12 h后,分别将无效序列过表达质粒、含PRDM5过表达序列的质粒、shRNA阴性对照质粒、PRDM5沉默shRNA质粒、miRNA过表达对照质粒、miR-489-3p模拟物转染至U937细胞作为pcDNA3.1组、pcDNA3.1-PRDM5组、shNC组、shPRDM5组、NC组和miR-489-3p mimics组。miR-489-3p+pcDNA3.1-PRDM5组是PRDM5过表达质粒干预后,再用miR-489-3p干扰U937细胞。具体转染步骤参考LipofectamineTM2000试剂盒说明书。
(4)细胞划痕实验:各组细胞长至80%,用10 μl枪头尖端在培养皿中央垂直划一道痕迹,在0 h、24 h观察划痕两侧细胞迁移的距离,迁移率(%)=(划痕宽度0 h-划痕宽度24 h)/ 划痕宽度0 h×100%,需独立重复3次取平均值。
(5)Transwell小室法检测细胞侵袭能力:各组细胞于Transwell小室中培养12 h。甲醇固定15 min,0.25%甲紫溶液染色30 min。在倒置显微镜下随机选取5个视野(×200)拍照记录迁移下室的细胞总数。
(6)实时荧光定量聚合酶链反应(RT-qPCR)法检测相关基因mRNA表达水平:提取各组RNA,采用NanoDrop 2000分光光度计检测RNA纯度和浓度,采用miRNA第一链cDNA合成(加尾法)试剂盒将总RNA逆转录扩增为cDNA。按照荧光定量试剂盒使用步骤进行PCR,扩增条件为:95 ℃预变性2 min,95 ℃变性15 s,60 ℃退火45 s,72 ℃延伸30 s,共计40个循环。分别以GAPDH和U6作为mRNA和miRNA的标准内参,基因表达结果均以2-△△Ct进行统计。本实验所有PCR引物序列见表1。
(7)蛋白质免疫印迹法(Western blot)检测相关蛋白表达水平:提取各组总蛋白,采用BCA试剂检测蛋白质浓度。各组蛋白上样量20 μg,经SDS-PAGE电泳分离,转膜至PVDF膜。5%脱脂牛奶封闭2 h,TBST洗涤3次,加入对应的一抗(β-catenin、GSK3β和GAPDH),4 ℃孵育过夜。TBST洗涤3次,放入二抗,室温孵育2 h。采用化学发光成像仪显影,Image J软件分析结果,相对蛋白表达水平以GAPDH标准化。
(8)双荧光素酶报告实验:双重荧光素酶报告基因检测使用Dual Luciferase Reporter Assay System试剂盒,使用双重荧光素酶报告基因检测系统检测荧光素酶活性,以海肾荧光素酶活性标准化。
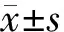
结 果
1.AML组和正常组受试者骨髓miR-489-3p及PRDM5 mRNA表达水平比较:AML组受试者骨髓miR-489-3p表达水平低于正常组(0.189±0.017比0.528±0.011,P<0.05),而AML组受试者骨髓PRDM5 mRNA表达水平高于正常组(0.489±0.009比0.147±0.006,P<0.05)。
2.NC组和miR-489-3p mimics组AML细胞系U937 miR-489-3p、PRDM5 mRNA表达水平、侵袭能力及迁移能力比较:miR-489-3p mimics组AML细胞系U937 miR-489-3p表达水平高于NC组(1.836±0.102比1.012±0.063,P<0.05),PRDM5 mRNA表达水平、穿过基质胶膜的细胞数量及24 h内迁移率均低于NC组[0.497±0.039比1.003±0.046;(31±2)个比(63±5)个;(34.26±6.92)%比(57.56±10.25)%,P均<0.05]。
3.pcDNA3.1组和pcDNA3.1-PRDM5组、shNC组和shPRDM5组AML细胞系U937 PRDM5 mRNA表达水平、侵袭能力及迁移能力比较:pcDNA3.1-PRDM5组AML细胞系U937 PRDM5 mRNA表达水平、穿过基质胶膜的细胞数量及24 h内迁移率均高于pcDNA3.1组[2.231±0.184比1.015±0.141;(252±5)个比(68±4)个;(86.53±8.42)%比(59.76±7.42)%,P均<0.05]。shPRDM5组AML细胞系U937 PRDM5 mRNA表达水平、穿过基质胶膜的细胞数量及24 h内迁移率均低于shNC组[0.237±0.039比1.085±0.071;(34±2)个比(75±4)个;(36.91±4.15)%比(58.46±5.28)%,P均<0.05]。
4.双荧光素酶报告实验结果:根据TargetScan的预测,miR-489-3p 3’-UTR中的靶向位点与PRDM5部分互补(图1)。双荧光素酶活性测定结果显示,miR-489-3p-Wt组相对荧光素酶活性低于NC组(0.417±0.049比1.021±0.075,P<0.05),但miR-489-3p-Mut组和NC组萤光素酶活性比较差异无统计学意义(P>0.05),表明PRDM5是miR-489-3p的靶基因。
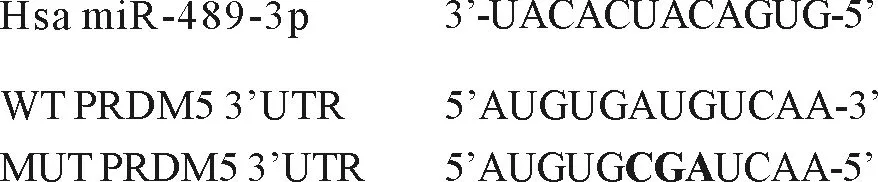
图1 双荧光素酶报告实验结果miR-489-3p与PRDM5存在结合位点
5.miR-489-3p mimic组和miR-489-3p+pcDNA3.1-PRDM5组AML细胞系U937侵袭能力及迁移能力比较:miR-489-3p+pcDNA3.1-PRDM5组穿过基质胶膜的细胞数量及24 h内迁移率均高于miR-489-3p mimic组[(121±7)个比(31±2)个,(56.49±4.52)%比(34.58±4.13)%,P均<0.05]。
6.不同组别AML细胞系U937 Wnt/β-catenin信号通路蛋白表达水平比较:miR-489-3p mimic组AML细胞系U937 β-catenin蛋白表达水平低于NC组(0.43±0.05比1.02±0.09),GSK3β蛋白表达水平高于NC组(1.53±0.12比0.96±0.11),差异均有统计学意义(P<0.05)。pcDNA3.1-PRDM5组AML细胞系U937 β-catenin蛋白表达水平高于pcDNA3.1组(1.62±0.15比1.08±0.12),GSK3β蛋白表达水平低于pcDNA3.1组(0.47±0.05比0.98±0.09),差异均有统计学意义(P<0.05)。shPRDM5组AML细胞系U937 β-catenin蛋白表达水平低于shNC组(0.56±0.06比0.95±0.09),GSK3β蛋白表达水平高于shNC组(1.51±0.13比1.07±0.10),差异均有统计学意义(P<0.05)。miR-489-3p+pcDNA3.1-PRDM5组AML细胞系U937 β-catenin蛋白表达水平高于miR-489-3p mimic组(1.73±0.15比1.10±0.12),GSK3β蛋白表达水平低于miR-489-3p mimic组(0.46±0.06比1.07±0.09),差异均有统计学有意义(P<0.05)。
讨 论
白血病是常见的血液系统恶性肿瘤,包括淋巴系白血病和髓系白血病[6]。AML的发生主要是髓系细胞的终末分化受阻碍,髓系前体细胞无限制的增殖,导致骨髓造血功能衰竭[7-8]。PRDM5蛋白属于一种转录调节因子,位于人类染色体区域4q26,该区域具有许多活跃于几种恶性肿瘤中的抑癌基因[9]。PRDM5对造血功能、细胞凋亡、迁移和侵袭均有明显作用[10]。本研究通过RT-qPCR检测AML患者骨髓,发现PRDM5 mRNA表达水平明显降低。划痕实验和Transwell侵袭实验检测结果显示,过表达PRDM5可抑制人AML细胞系U937的侵袭和迁移能力,而沉默U937中的PRDM5后,其侵袭和迁移能力明显被激活,表明PRDM5对AML细胞系U937的侵袭和迁移能力均有抑制作用。
近年来对miRNA功能的深入研究发现,miRNA通过与靶基因结合,影响靶基因转录和翻译过程,从而参与多种疾病的发生发展[11]。白血病中miRNA可以作为诊断的新生物标记,并为白血病提供有希望的治疗方法和新颖的药物筛选策略[12]。本研究结果显示,AML患者骨髓miR-489-3p表达水平低于对照组。过表达miR-489-3p mimic后,U937的侵袭和迁移能力受到抑制,且PRDM5 mRNA表达水平也明显减少。Targetscan软件预测miR-489-3p与PRDM5有互补序列。而双荧光素酶报告实验结果显示,PRDM5是miR-489-3p的靶基因。为了进一步验证miR-489-3p靶向PRDM5对U937侵袭和迁移能力的影响,本研究在miR-489-3p mimic转染U937后,采用PRDM5过表达质粒干扰,结果显示,miR-489-3p+pcDNA3.1-PRDM5组U937侵袭和迁移能力高于miR-489-3p mimic组,表明PRDM5可拯救miR-489-3p对AML细胞系U937侵袭和迁移能力的抑制作用。综上可知,miR-489-3p可通过靶向PRDM5抑制AML细胞系U937的侵袭和迁移能力。
为了进一步探究miR-489-3p靶向PRDM5调控AML细胞系U937侵袭和迁移能力的分子学机制,本研究观察了Wnt/β-catenin信号通路的变化。既往研究表明,PRDM5影响Wnt/β-catenin信号的传导,抑制癌基因表达从而起到抑癌作用[3]。过表达miR-489-3p后,AML细胞中Wnt/β-catenin信号传导被阻碍,AML细胞的生长从而受到抑制[13]。本研究结果显示,过表达miR-489-3p后,β-catenin蛋白表达水平降低,GSK3β蛋白表达水平升高,表明miR-489-3p可抑制Wnt/β-catenin信号通路。过表达PRDM5后,β-catenin蛋白表达水平升高,GSK3β蛋白表达水平降低,但沉默PRDM5后,结果与之相反,表明PRDM5可激活Wnt/β-catenin信号通路的传导。过表达miR-489-3p后,再过表达PRDM5后,U937中Wnt/β-catenin信号通路传导恢复,表明miR-489-3p通过靶向PRDM5抑制Wnt/β-catenin信号通路。
综上所述,AML患者骨髓miR-489-3p和PRDM5呈异常表达,miR-489-3p通过靶向抑制PRDM5的表达,进一步抑制Wnt/β-catenin信号通路,从而降低AML细胞系U937的迁移和侵袭能力。
